
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Гидролиз
ЗАКОН ДЕЙСТВИЯ МАСС И ПРОЦЕССЫ ГИДРОЛИЗА И АМФОТЕРНОСТИ
Лекция 5
1 Гидролиз
2 Константа и степень гидролиза
3 Значение гидролиза в качественном анализе
Гидролизом называется реакция обменного разложения между водой и растворенным в нем веществом, сопровождающаяся изменением величины рН раствора. Гидролиз является частным случаем сольволиза, т. е. реакции обменного разложения растворенного вещества и растворителя. Гидролизу подвергаются химические соединения различных классов, в том числе соли, гидриды, галогенангидриды, тиоангидриды, сульфиды, нитриды, различные органические соединения и т. д.Гидролиз солей является обратимым процессом; он рассматривается как частный случай химического равновесия, подчиняющегося закону действия масс. Обратной реакцией его является реакция нейтрализации.
Гидролиз: СН3СООNа + НОН ↔ CH3COOH + NaOH
Нейтрализация: СН3СОО - + НОН ↔ СН3СООН + ОН-
Накопление в растворе ионов ОН- и ведет к изменению величины рН раствора.Механизм гидролиза для разных классов химических соединений весьма различен. Так, гидролиз электролитов, распадающихся в растворе на ионы, можно рассматривать как результат поляризационного взаимодействия ионов с их гидратной оболочкой. При этом характер и степень распада молекул гидратной оболочки зависят от природы катионов и анионов электролита. Чем сильнее поляризующее действие ионов растворенного электролита, тем в большей степени протекает гидролиз.Катионы щелочных и щелочноземельных металлов, имеющие сферическую симметрию внешних электронов и слабую поляризуемость, не вызывают заметного разложения воды и изменения рН раствора. Это говорит об электростатическом характере взаимодействия названных катионов с дипольными молекулами воды при образовании гидратной оболочки ионов.Обратимое разложение молекул воды, а, следовательно, и изменение величины рН раствора вызывают двух- и трехзарядные катионы, способные образовывать с водой комплексы за счет донорноакцепторного взаимодействия. К числу таких катионов относятся катионы, имеющие вакантные р- и d-орбитали, способные заполняться неподеленными электронными парами кислорода молекул воды. Обычно это катионы переходных металлов с незаконченным 3d-, 4d- или 5d-электронным слоем, или, же это амфотерные катионы, имеющие вакантные p-орбитали. Установлено, что, чем больше заряд, меньше ионный радиус и устойчивее электронная оболочка иона, тем сильнее его акцепторная способность и прочнее связь Me — OH2 в гидратированном катионе. При образовании ковалентной связи по донорно-акцепторному механизму между катионом металла и гидратирующей его молекулой воды связь О—Н в координированной молекуле воды поляризуется и, следовательно, ослабляется. Водородная же связь между ионом водорода координированной молекулы воды и молекулами растворителя, наоборот, усиливается. В результате этих двух процессов может произойти разрыв связи О—Н в координированной молекуле воды и превращение водородной связи Н···ОН2 в ковалентную с образованием иона гидроксония Н3О+ и гидроксоаква - комплекса катиона металла, что и приводит к накоплению в растворе ионов гидроксония Н3О+ и изменению величины рН раствора.Например, при гидратации ионов цинка образуется аквакомплекс цинка, ионы водорода которого испытывают отталкивающее действие ионов цинка и притяжение со стороны дипольных молекул воды вторичной гидратной оболочки. В результате этого и образуется гидроксоаква комплекс цинка и ионы гидроксония. Следовательно. протоны аквакомплекса могут переходить в раствор и накапливаться в нем в виде ионов Н3О+, что схематично можно представить так:

По такому же механизму идет гидратация и гидролиз и других катионов — акцепторов неподеленных электронных пар кислорода воды.
Гидратация анионов осуществляется за счет водородной связи молекул воды с анионами. Однако поляризационное взаимодействие между анионом и молекулами воды может вызвать превращение водородной связи в ковалентную с образованием нового химического соединения — гидроанионов или же молекул слабых кислот и гидроксильных ионов, что опять-таки ведет к накоплению в растворе ионов ОН- и изменению величины рН. Этот процесс схематично можно представить так:
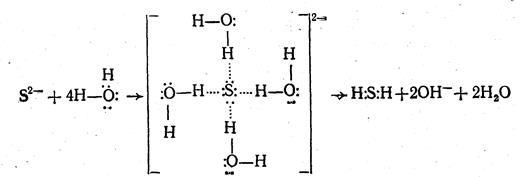
Гидратация сульфид-анионов приводит к образованию сероводорода и накоплению в растворе гидроксильных ионов. Следовательно, в этом процессе гидратирующие молекулы воды выступают в качестве донора протонов, т. е. вода ведет себя как кислота, а анионы сульфида — в качестве доноров неподеленных электронных пар или акцепторов протонов.
Естественно, что чем больше отрицательный заряд и меньше ионный радиус аниона, тем более сильным донором он выступает в этом взаимодействии и тем легче отрывает протон от молекулы воды. В зависимости от донорной активности анионов возможны два случая:
а). Анион является слабым донором электронной пары или слабым акцептором протона воды. В этом случае водородная связь между анионом и гидратирующей молекулой воды не переходит в ковалентную и реакция химического взаимодействия практически не идет. Следовательно, процесс ионизации воды не нарушается и рН раствора остается постоянным. Так ведут себя слабые доноры электронных пар—анионы Cl-, Br-, I-, NO-3, SO42-, С1O4-, SiF62- и некоторые другие.
б) Анионы обладают хорошо выраженной донорной способностью, обусловливающей образование ковалентных связей с протонами воды. В этом случае происходит процесс разложения молекул воды, образующих гидратную оболочку, и изменение величины рН, как это было показано на примере гидратации сульфид-аниона.
Так ведут себя анионы, являющиеся донорами электронных пар. Типичными донорами электронных пар являются анионы слабых органических кислот СН3СОО-, НСОО-, C4H4O62- и слабых минеральных кислот S2-, CO32-, SO32-, SiO32-, PO43-, а также анионы CN-, SCN- и др.
Суммарный эффект гидролиза определяется природой образующихся в растворе катионов и анионов. В зависимости от состава солей различают три вида реакций гидролиза.
1. Гидролиз солей, образующих в растворе катионы, не обладающие поляризационными и акцепторными свойствами, и анионы с ясно выраженной донорной способностью, или (по старой терминологии) гидролиз солей, образованных катионами сильного основания и анионами слабой кислоты.
При растворении в воде такой если, как ацетат натрия, в растворе образуются катионы Na+ и анионы СН3СОО-. Катионы натрия, имеющие сферическую симметрию внешних электронов и не имеющие вакантных орбиталей во внутренних электронных слоях, не обладают поляризующими и акцепторными свойствами, поэтому они не вступают в реакцию обменного разложения воды. Анионы же CH3COO- обладают ясно выраженной донорной способностью. Кислород карбоксильной группы аниона, имеющий неподеленные пары электронов, вначале гидратируется, а затем образует ковалентную связь с протоном воды, и анион превращается в слабую уксусную кислоту, а в растворе накапливаются ионы гидроксила, что схематично можно представить так:

Этот процесс можно выразить следующими уравнениями:
Гидратация и ионизация СН3СОONa ↔ nа+гидр + СН3СОО- гидр
Гидролиз: СН3СОО- гидр + НОН ↔ CH3COOH + ОН- гидр
Такой процесс называется гидролизом по аниону, так как анион вступает в реакцию обменного разложения воды и обусловливает накопление в растворе ионов гидроксила. Он продолжается до тех пор, пока в системе не установится равновесие между концентрацией неионизированных молекул уксусной кислоты и ее ионами. Поскольку уксусная кислота является слабой (Kдис = 1,74 · 10-5), то концентрация ионов [OН-] в растворе будет значительной, а рН 1 н. раствора ацетата натрия равен 9,4. Аналогично раствору ацетата натрия, растворы других бинарных электролитов, образующих в растворе катионы, не обладающие поляризационными и акцепторными свойствами, и анионы со средневыраженной донорной способностью, также показывают щелочную реакцию. Например, рН 1 н. раствора цианида калия равен 11,6, а рН 1 н. раствора сульфида натрия при гидролизе по первой ступени равен 13.
Гидролиз солей, образованных катионами сильного основания и анионами многоосновной слабой кислоты, идет ступенчато, например:
СO32- + НОН ↔ НСО3-- + ОН-
НСО3- + НОН ↔ Н2СО3 + ОН-
Гидролиз солей фосфорной кислоты идет в три ступени:
РО43- + НОН ↔ НРО42- + ОН-
HРО42- + НОН ↔ Н2РО4- + ОН-
Н2РО4- + НОН ↔ Н3РO4 + ОН-
Гидролиз по второй и третьей ступеням идет в незначительной степени или же только при создании определенных условий.
2. Гидролиз солей, образующих в растворе катионы комплексообразователи и анионы — слабые доноры электронных пар, или гидролиз солей, образованных слабыми основаниями и анионами сильной кислоты, идет по катиону.
При растворении в воде соли типа А1С13 или CuSO4 происходит гидролиз по катиону, ведущий к образованию гидроксо-и аквакомплексов катиона или его основания и к накоплению в растворе ионов гидроксония.
Гидролиз кристаллогидрата [А1(ОН2)6]С13 в кислой среде идет в три ступени. При растворении в воде он подвергается дальнейшей гидратации и ионизации:
[А1(ОН2)6]С13 + хH2O ↔ [А1(ОН2)6]3+гидр + 3С1- гидр
Гидратированные ионы алюминия вступают в реакцию с молекулами воды, образующими вторичную гидратную оболочку. При этом ионы водорода координированных молекул воды испытывают отталкивающее действие одноименно заряженных ионов алюминия и притяжение со стороны дипольных молекул воды вторичной гидратной оболочки. Вследствие протекания этих процессов гидратированные ионы алюминия и вызывают обменное разложение воды, что схематично можно представить так:
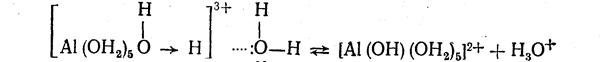
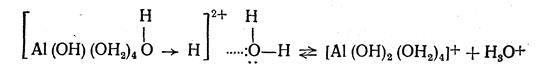
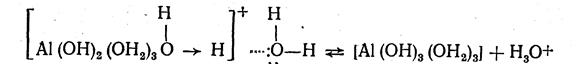
В кристаллогидрате сульфата меди CuSO4 · 5Н2О или [Си (OH2)4] SО4 · H2O координационное число катионов Сu2+ равно четырем, поэтому они могут координировать четыре молекулы воды. Гидратированные катионы меди вызывают обменное разложение воды и реакцию гидролиза с изменением рН раствора:

В рассмотренных примерах активными компонентами являются катионы солей, которые, являясь акцепторами электронных пар, вызывают обменное разложение воды и накопление в растворе ионов гидроксония, ведущее к изменению рН раствора. Анионы же солей (Сl-, SO42-) - слабые доноры электронных пар и слабые акцепторы протонов, поэтому они заметно не реагируют с водой и не изменяют рН раствора.
3. Гидролиз солей, образующих в растворе сильнополяризующие катионы-комплексообразователи и анионы — доноры электронных пар, или гидролиз солей, образованных катионами слабых оснований и анионами слабых кислот, идет по катиону и аниону, так как в этом виде реакции гидролиза происходит обменное разложение воды под действием как катиона, так и аниона. В результате образуются слабые основания и слабые кислоты. Например, при гидролизе ацетата железа образуются основные соли железа, гидроксид железа (III) и слабая уксусная кислота.
Ацетат железа, гидратируясь, образует аквакомплекс железа:
Fe(СН3СОО)3 + 6Н20 ® [Fe(ОН2)6] (СН3СОО)3,
который диссоциирует на гидратированные ионы:
[Fe(ОН2)6] (СН3СОО)3 + хН2О ↔ [Fe(ОН2)6]3+гидр + 3СН3СОО- гидр
Гидратированные ионы железа (так же как и ионы алюминия и меди) вызывают обменное разложение воды. Гидролиз идет в три ступени:
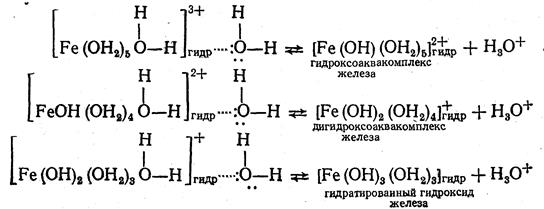
Гидролиз аквакомплекса железа [Fe(OH2)6] (СН3СОО)3 по второй и третьей ступеням идет при разбавлении раствора водой и при нагревании. Анионы же СН3СОО- являются донорами электронных пар и обладают довольно высоким протонным сродством, поэтому они также вступают в реакцию обменного разложения воды, образуя в растворе слабую уксусную кислоту и гидроксильные ионы.
Реакция раствора будет зависеть от силы образующихся при гидролизе кислоты и основания. Так, при гидролизе ацетата железа и ацетата алюминия получаются слабокислые растворы, так как получающиеся основания более слабые, чем уксусная кислота, и, следовательно, концентрация ионов гидроксония будет больше концентрации ионов ОН-. При гидролизе ацетата аммония получается практически нейтральный раствор с рН @ 7, так как константы ионизации (KNH4OH = 1,76 · 10-5 и KCH3COOH = 1,74 · 10-5) почти равны.
Гидролиз солей, образующих в растворе катионы, не обладающие поляризующими и акцепторными свойствами, и анионы, представляющие слабые доноры электронных пар, практически не идет, так как в этом случае не происходит обменного разложения воды ни катионами, ни анионами соли и рН раствора остается постоянным. Например, NaCl хотя и взаимодействует с водой с образованием гидратированных ионов: NaCI + хН2O ® [Na(OH2)n]+ + [Cl(HOH)x-n], но это не гидролиз, так как рН раствора не изменяется. Здесь нет обменного разложения воды и образования избытка Н3О+ или ОН- ионов.
Некоторые соли, реагируя с водой, образуют кристаллогидраты, например: Na2SO4 · 7Н2O, Na2SO4 · 10Н2O, NaClO4 · Н2O, MgCl2 · 6Н2O и др., но рН при этом не изменяется. Поэтому эти реакции также нельзя назвать гидролизом.
|
|
Дата добавления: 2015-06-30; Просмотров: 4718; Нарушение авторских прав?; Мы поможем в написании вашей работы!