
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Превращение одних малорастворимых электролитов в другие
|
|
|
|
В качественном анализе довольно часто приходится производить превращение одних малорастворимых электролитов в другие. Указанные процессы можно понять, исходя из произведения растворимости. Например, если к равновесной системе, состоящей из насыщенного раствора и осадка хромата серебра Ag2CrO4, прилить избыток раствора КС1 и содержимое взболтать, то кирпично-красный осадок хромата серебра Ag2CrO4 превращается в белый творожистый осадок хлорида серебра AgCl
Причину этого превращения понять нетрудно. Раствор над осадком Аg2СrО4 содержит ионы Ag+ и анионы СrO42-. При добавлении раствора КС1 ионы Ag+ будут сталкиваться с анионами С1-, а так как растворимость AgCl во много раз меньше, чем растворимость Ag2CrO4, то концентрация ионов Ag+ в растворе окажется достаточной, чтобы превысить величину произведения растворимости хлорида AgCl, который и выпадет в осадок. Удаление ионов Ag+ из раствора в виде AgCl делает этот раствор ненасыщенным в отношении Ag2CrO4, вследствие чего осадок Ag2CrO4 будет растворяться. Перешедшие в раствор ионы Ag+ вновь будут связываться ионами С1- и переходить в осадок. При наличии избытка КС1 этот процесс будет продолжаться до тех пор, пока весь осадок Ag2CrO4 не растворится, а AgCl не перейдет в осадок. Процесс превращения хромата серебра Ag2CrO4 в хлорид серебра AgCl можно представить следующей системой равновесий:
Ag2CrO4 ↔ 2Ag+ + СrO42-
2КС1 ↔ 2Сl- + 2К+
¯
2AgCl¯
По такой же схеме происходит превращение и других малорастворимых электролитов в другие, еще менее растворимые.
Большое практическое значение имеет растворение малорастворимых осадков, например сульфатов бария, стронция и кальция. Сульфаты названных катионов, как соли сильной кислоты, нерастворимы ни в кислотах, ни в щелочах. Чтобы растворить сульфаты, их сначала превращают в карбонаты, которые легко растворяются даже в уксусной кислоте. Превращение сульфатов в карбонаты производят действием концентрированного раствора карбонатов натрия Na2CO3 при нагревании. При этом имеет место следующая реакция:
CaSO4 + Na2CO3 ↔ СаСО3¯ + Na2SO4
Эта реакция идет легко и практически до конца в направлении слева направо, так как ПРCaCO3 равное 4,8 · 10-9, почти в 5000 раз меньше ПРCaSO4, равного 2,37 · 10-5.
Труднее происходит превращение сульфата стронция SrSO4 в карбонат стронция SrCO3:
SrSO4¯ + Na2CO3 ↔ SrCO3¯ + Na 2SO4,
так как разница произведений растворимости ПРSrCO3 = 1,1 · 10-10, ПРSrSO4 = 3,2 · 10-7 значительно меньше, чем для соответствующих солей кальция.
Если сопоставить величину ПР BaSO4 = 1,1 · 10-10 и ПРваСО3 = 5,1 · 10-9, то может показаться, что превратить сульфат бария в карбонат бария нельзя. И действительно, реакция эта сама по себе не идет, так как слабая угольная кислота не может вытеснить из солей более сильную серную кислоту, да и растворимость сульфата бария меньше растворимости карбоната бария. Но если учесть закон действия масс и действовать на осадок сульфата бария BaSO4 большим избытком карбоната натрия Na2CO3, то можно вызвать смещение равновесия слева направо и получить осадок карбоната бария ВаСО3:
BaSO4¯ + Na2CO3 ↔ ВаСО3¯ + Na2SO4
Осадок карбоната бария ВаСО3 образуется тогда, когда произведение растворимости его окажется превышенным, т. е.
[Ba2+][CO32-] > ПPBaCO3
В этом неравенстве концентрация ионов Ва2+ определяется растворимостью BaSO4 и равна:
| [Ba2+] = | ПРBaSO4 |
| [SO42-] |
Следовательно, мы можем увеличивать только концентрацию ионов [СO32-] и добиваться, чтобы отношение ПРBaSO4 /[CO32-], стало меньше отношения ПРBaSO4/ [SO42-], т.е.:

Преобразуя полученное неравенство, мы можем написать;
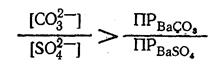
Подставив в это неравенство числовые значения произведений растворимости, получим:

Итак, для осуществления превращения ВаSО4 в ВаСО3 необходимо, чтобы концентрация ионов CO32- в растворе в 46,4 раза превышала концентрацию ионов SO42-. Добиться этого вполне возможно, так как молярная растворимость [BaSO4] весьма мала; следовательно, и [SO42-] в растворе тоже очень мала и равна10-5 г-ион/л. Значит, для превращения BaSO4 в ВаСО3 достаточно иметь раствор Na2CO3, с концентрацией 46,4 · 10-5, или 4,64 · 10-4 моль/л.
Практически же пользуются 1 - 1,5 М раствором Na2CO3. Однако, несмотря на применение концентрированного раствора соды, превращение сульфата бария BaSO4 в карбонат бария ВаСО3 до конца не происходит, так как в системе устанавливается равновесие между ионами SO42- и CO32-. В момент, когда отношение [CO32-]/[SO42-] = 46,4, превращение ВаSО4 в ВаСО3 останавливается. Чтобы довести реакцию до конца, раствор, содержащий карбонат натрия Na2CO3, сливают с отстоявшегося осадка. К осадку приливают новую порцию карбоната натрия, нагревают до кипения и после отстаивания осадка сливают раствор с вновь образовавшимися сульфат-иономи. Итак, действуя избытком соды и выводя из реакционной смеси анионы SO42-, добиваются полного превращения в карбонат бария. Однако подобные реакции возможны лишь при не очень большом различии величин произведений растворимости. В то время как превращение малорастворимых электролитов в еще менее растворимые идет сравнительно легко, превращение же малорастворимых электролитов в более растворимые протекает значительно труднее, а при превышении ПР в 106 раз практически не происходит совсем, как например переход AgI (ПPAgI = 8,3 ·10-17) в AgCl (ПPAgCl = 1,78 · 10-10).
|
|
|
|
|
Дата добавления: 2015-06-30; Просмотров: 3900; Нарушение авторских прав?; Мы поможем в написании вашей работы!