
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Вычисление рН буферных растворов, образованных слабой кислотой и ее солью
|
|
|
|
Вычисление рН буферных растворав
Буферные системы и их значение в анализе
Для поддерживания определенной величины рН в исследуемом растворе пользуются буферными системами.
Чаще всего в качестве буферных растворов используют смеси растворов слабых кислот и их солей, или же смеси растворов слабых оснований и их солей, или, наконец, смеси растворов солей многоосновных кислот различной степени замещения (табл. 3.3).
Таблица 3.3 Буферные растворы, применяемые в анализе
| Состав буферной смеси (при молярном соотношении 1: 1) | Название смеси | рН |
| Смесь муравьиной кислоты НСООН и формиата натрия HCOONa Смесь уксусной кислоты СН3СООН и ацетата натрия CH3COONa, Смесь дигидрофосфата натрия NaH2PO4 и гидрофосфата натрия Na2HPO4 Смесь аммиака и хлорида аммония NH4Cl | Формиатная смесь Ацетатная смесь Фосфатная смесь Аммонийная смесь | 3,8 4,7 6,6 9,25 |
Способность буферных систем поддерживать постоянство рН при добавлении к ним небольших количеств сильной кислоты или сильного основания основана на том, что одна составная часть буферной системы может взаимодействовать с ионами Н+ кислоты, а другая — с ионами ОН- прибавляемого основания. Вследствие этого буферная система может связывать как Н+, так и ОН- ионы приливаемых кислот и оснований и до определенного предела сохранять постоянство величины рН. Например, если к ацетатной буферной системе приливать сильную кислоту (НС1, Н2SO4, НNO3), то пойдет реакция между ацетат-ионом и ионами водорода кислоты, что можно выразить уравнением:
CH3COONa + НCl ↔ СН3СООН + NaCI
СН3СОO- + Н+ ® СН3СООН
Сильная кислота (НС1 или H2SO4) замещается слабой уксусной кислотой, посылающей в раствор ничтожно малое количество ионов водорода.При добавлении же к ацетатной буферной системе сильной щелочи (NaOH, КОН) пойдет реакция нейтрализации уксусной кислоты сильным основанием:
СН3СООН + NaOH ® CH3COONa + H2O
Н+ + ОН- ® H2O
В том и другом случае в растворе существенно не изменяются концентрации ни [Н+], ни [ОН-] ионов.
В аммиачной буферной системе протекают следующие реакции. При добавлении сильной кислоты идет нейтрализация раствора аммиака кислотой:
NH4OH + НNО3 ®NH4NO3 + Н2О
ОН- + Н+ ® Н2О
При добавлении сильного основания идет реакция обмена между солью и сильным основанием с образованием слабого основания NH4OH:
NH4Cl + NaOH ® NH4OH + NaCI
NH4+ + ОН- ® NH4OH
Величину рН, создаваемую тем или иным буферным раствором, можно вычислить.
Пример 1. Вычислить рН смеси уксусной кислоты с ее натриевой солью.
Решение.
1. Из уравнения константы ионизации кислоты находим концентрацию ионов водорода:
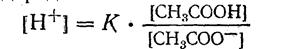
Уксусная кислота присутствует в растворе в смеси с ацетатом натрия CH3COONa в виде неионизированных молекул. Поэтому концентрацию молекул можно принять равной общей молярной концентрации кислоты в растворе, т. е. [CH3COOH] =С кисл. Концентрацию анионов уксусной кислоты можно принять равной концентрации соли, т. е. [CH3COO-] = Ссоли, так как ацетат натрия CH3COONa — сильный электролит, диссоциирующий в растворе на
100 %. Приняв эти упрощения, получим:
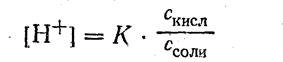
2. Логарифмируя полученное уравнение и заменяя знаки логарифмов на обратные, получаем:
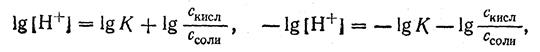
но -lg [Н+] есть рН, а -lg К есть рК — силовой показатель кислоты.
Если при приготовлении буферной системы взять одинаковые концентрации кислоты и соли, то концентрация ионов водорода в таком растворе будет равна константе ионизации кислоты, так как отношение
| Скисл | = 1 и [Н+] = К · 1, т. е. [Н+] = К, поэтому рН = рК. |
| с соли |
Изменяя отношение концентрации кислоты к концентрации соли, можно получить серию буферных систем с различной величиной рН.
Обычно приготовляют ряд буферных систем из одних и тех же компонентов, меняя лишь отношение концентрации кислоты к концентрации соли от 10: 1 до 1: 10. В таких растворах водородный показатель будет изменяться от рН =рК — 1 до рН = рК + 1.
Пример 2. Сколько 0,5 М раствора ацетата натрия CH3COONa нужно прибавить к 100 мл 2М раствора уксусной кислоты CH3COOH, чтобы получить буферный раствор с рН = 4?
Решение.
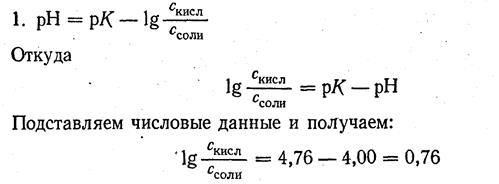
Число lg 0,76 = 5,754. Следовательно, отношение концентрации кислоты к концентрации соли должно быть равно 5,754: 1.
2. Находим концентрацию кислоты в буферной системе:
в 1000 мл 2 М раствора содержится 2 моль СН3СООН
в 100 мл 2 М»» 0,2 моль СН3СООН
3. Зная концентрацию кислоты, находим концентрацию соли в буферной системе; она должна быть равна 0,2: 5,754 = 0,03475 (моль).
4. Находим количество 0,5 М раствора ацетата натрия CH3COONa, содержащего 0,03475 моль:
в 1000 мл 0,5 М раствора содержится 0,5 моль CH3COONa
в х мл 0,5 М»» 0,03475 моль СН3СООNа
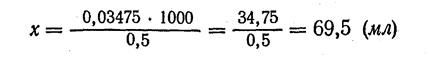
Пример 3. Вычислить рН раствора, полученного путем смешивания 20 мл 0,05 М. раствора азотистой кислоты HNQ2 и 30 мл 1,5 М раствора нитрита натрия NaNO2.
Решение.
1. Находим объем раствора после смешивания кислоты HNO2 и соли NaNO2 и их концентрации в полученной смеси;
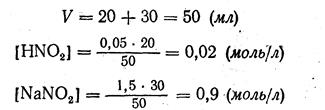
2. По табличным данным находим, что рКHNO2, = 3,29.
3. Вычисляем рН:
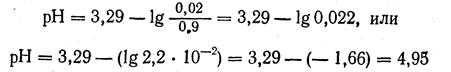
Пример 4. В каких молярных соотношениях следует взять растворы солей состава NaH2PO4 и Na2HPO4, чтобы получить буферную систему с рН = 6?
Решение.
1. По условию задачи нам известна лишь величина рН. Поэтому по величине рН находим концентрацию ионов водорода:

2. В данной буферной системе в качестве кислоты выступает ион Н2РО4-, получающийся при диссоциации соли дигидрофосфата натрия NaH2PO4. Константа диссоциации фосфорной кислоты по второй ступени K2, H3PO4 = 6,2 · 10-8.
3. Зная концентрацию ионов водорода и величину константы диссоциации кислоты, вычисляем отношение концентрации кислоты к концентрации соли в данной буферной системе:
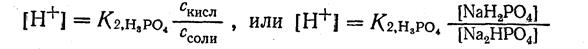
Отсюда молярное отношение солей, составляющих буферный раствор, будет равно:

|
|
|
|
|
Дата добавления: 2015-06-30; Просмотров: 7214; Нарушение авторских прав?; Мы поможем в написании вашей работы!