
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Смещение ионных равновесий. Действие одноименного иона
|
|
|
|
Степень и константа ионизации характеризуют собой один и тот же процесс распада молекул на ионы, поэтому можно одну из этих величин выразить через другую.
Если обозначить молярную концентрацию электролита через c, а степень ионизации через а, то концентрация каждого из ионов будет равна с · а, а концентрация неионизированных молекул будет равна
с—са, или с · (1— а). Подставив полученные значения в уравнение константы ионизации бинарного электролита, получим:
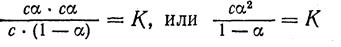
В такой форме полученное уравнение выражает закон разбавления, выведенный В. Оствальдом. Он устанавливает зависимость между степенью ионизации слабого электролита и его концентрацией. Если электролит является достаточно слабым и раствор его не слишком разбавлен, то степень ионизации его (а) мала и величина (1 - а) мало отличается от 1. Следовательно, можно принять, что
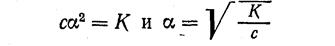
Закон разбавления позволяет вычислять степень ионизации, если известна константа ионизации и молярная концентрация раствора электролита, и, наоборот, определив тем или иным методом степень ионизации, можно вычислить константу ионизации по уравнению:
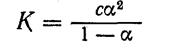
Ознакомимся с методикой вычисления константы и степени ионизации на основе использования закона разбавления.
Пример 1. Вычислить константу ионизации уксусной кислоты, если степень ионизации 0,1 н. раствора ее равна 1,35%.
Решение.
Для вычисления константы ионизации уксусной кислоты необходимо перейти от величины степени ионизации, выраженной в процентах, к ее величине, выраженной в молях. Уксусная кислота одноосновная, следовательно, 0,1 н. раствор ее является 0,1 М. Отсюда:
1 моль составляет 100%
x моль составляет 1,35% x = 1,35 · 1/ 100 = 0,0135 (моль/л)
или a = 1,35/ 100 = 0,0135 (моль/л).
По закону разбавления получим: K = 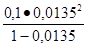 = 1, 85 · 10 -5
= 1, 85 · 10 -5
Обе найденные величины констант ионизации уксусной кислоты очень хорошо согласуются между собой. Следовательно, ионизация уксусной кислоты — типичного слабого электролита — подчиняется закону действия масс и вполне согласуется с теорией электролитической диссоциации.
Пример 2. Вычислить степень ионизации и концентрацию ионов [NН4+] и [ОН-] в 0,1н. растворе гидроксида аммония, если К NН4ОН =1,76 · 10-5.
Решение.
1. Молярная концентрация 0,1 н. раствора гидроксида аммония равна 0,1 М. Подставим значения К, и с в уравнение закона разбавления и сделаем расчет:
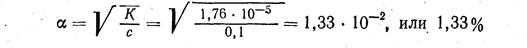
2. концентрация ионов в растворе оинарного электролита равна
с · а, а так как бинарный электролит ионизирует с образованием одного катиона и одного аниона, то
[NH4] = [ОН-] = 0,1 · 1,33 · 10-2 = 1,33 · 10-3 (г-ион/л)
Пример 3. Вычислить степень ионизации угольной кислоты по первой ступени, если константа ионизации в 0,01 М растворе равна
4,50 · 10-7.
Решение.
1. Угольная кислота слабая, поэтому ионизация ее даже по первой ступени идет в незначительной степени:
Н2СО ↔ Н+ + НСО3-
При вычислении степени ионизации можно пользоваться упрощенной формулой:
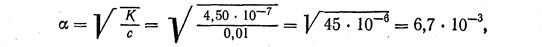
или 0,67%
Пример 4. Вычислить степень и константу ионизации муравьиной кислоты, если концентрация ионов водорода в 0,2 н. растворе муравьиной кислоты равна 6,0 · 10-3 г-ион/л.
Решение.
| 1.[Н+] = с · а, а = | [Н+] | = | 6 · 10-3 | = | 3 · 10 -2, или 3 % |
| с | 0,2 |
2. Зная степень ионизации и концентрацию данного раствора, легко вычислить константу ионизации муравьиной кислоты:
К = са2 = 0,2 · (3 · 10-2) 2 = 1,8 · 10-4.
При введении в раствор слабого электролита одноименных ионов существующее в растворе равновесие между ионами и недиссоциированными молекулами нарушается и согласно закону действия масс смещается в сторону образования недиссоциированных молекул. Частным случаем этого положения является уменьшение ионизации слабых кислот и оснований при прибавлении к кислоте или основанию соли этой же кислоты или соли этого же основания. Так, например, если к раствору уксусной кислоты прибавить какую-либо ее соль, то при этом будет введено много «одноименных» ионов СН3СОO-. Это приведет к нарушению химического равновесия:
СН3СООН ↔ СН3СОО - + Н +
CH3COONa ↔ CH3COO- + Na+
Восстановление нарушенного равновесия происходит в результате соединения ионов [Н+] и [СН3СОО-] в неионизированные молекулы CH3COOH. При этом концентрация ионов [Н+] в растворе понижается, вследствие чего уксусная кислота ведет себя как гораздо более слабая кислота.
Пользуясь уравнением константы ионизации, можно подсчитать, какое изменение концентрации того или иного иона, а также степени ионизации в растворе слабого электролита вызовет прибавление к нему определенного количества сильного электролита с одноименным ионом.
Пример 5. Во сколько раз. уменьшится концентрация ионов водорода, если к 1 л 0,2 М раствора уксусной кислоты прибавить 0,1 моль ацетата натрия, степень диссоциации которого составляет 80 %?
Решение.
1. Определим концентрацию ионов [Н+] в 0,2 М растворе уксусной кислоты до прибавления соли ацетата натрия:
СН3СООН ↔ СН3СОО- + H+
| [СН3СОО-] · [H+ ] | = | KСН3СООН | = 1,74 · 10-5 |
| [СН3СООН] |
Концентрация ионов водорода может быть вычислена по упрошенной формуле: [ H +] = 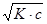 =
= 
 = 1,87 · 10 –3 (г-ион/л)
= 1,87 · 10 –3 (г-ион/л)
2. Определим концентрацию ионов [H+] после прибавления соли ацетата натрия CH3COONa.
Равновесное состояние будет характеризоваться, как и до добавления соли, законом действия масс и уравнением константы ионизации уксусной кислоты. Обозначим искомую концентрацию ионов водорода через х. Тогда концентрация недиссоциированных молекул будет равна 0,2 - х. Концентрация же анионов СН3СОО будет слагаться из двух величин: из концентрации х, создаваемой ионизацией молекул уксусной кислоты и концентрацией, обусловленной диссоциацией прибавленной соли. Последняя может быть вычислена с учетом степени диссоциации соли.
В 0,1 М растворе она равна (0,1 · 0,80) 0,08 г-ион/л. Таким образом, равновесная концентрация ионов СН3СОО будет равна 0,08 + х. Подставив найденные величины концентрации ионов в формулу константы ионизации СН3СООН, получим:
| х ·(0,08 + х) 0,2 - х | = 1,74 · 10-5 |
3. Расчет можно упростить, принимая во внимание, что величина х мала по сравнению с 0,2 и 0,08 и ею можно пренебречь, т. е. принять
0,2 – х @ 0,2 и 0,08 + x @ 0,08. Тогда получим:
| х · 0,08 | = 1,74 ·10-5 |
| 0,02 |
Откуда
| х = | 1,2 · 1,74 ·10-5 | = 4,35 ·10-5 (г-ион/л) |
| 0,08 |
Сравнивая концентрации ионов [Н+] до и после прибавления к раствору ацетата натрия находим, что прибавление соли CH3COONa вызвало уменьшение концентрации ионов водорода в 43 раза
Пример 6. Вычислить концентрацию ионов НСОО- в растворе, литр которого содержит 0,1 М раствора муравьиной кислоты и 0,01 М раствора соляной кислоты, считая диссоциацию НС1 полной.
Решение.
1. В растворе происходят процессы ионизации данных кислот:
НСООН ↔ Н+ + НСОО - (слабый электролит)
НС1 ↔ Н+ + Сl - (сильный электролит)
Ионизация муравьиной кислоты в присутствии сильной соляной кислоты будет сильно подавлена присутствием одноименных ионов Н+.
Равновесие ионизации муравьиной кислоты определяется ее константой ионизации, т. е.
| [Н+] · [НСОО-] | = K НСООН = 1,8 · 10-4 |
| [НСООН] |
2. Обозначим искомую концентрацию ионов НСОО- через х. Тогда концентрация ионов водорода в данной смеси будет слагаться из двух величин, а именно: из х г-ион/л, образующихся при ионизации муравьиной кислоты, и 0,01 г -ион/л, образующегося при диссоциации НС1. Следовательно, [H+] = (0,01+ х). Концентрацию неионизированных молекул кислоты НСООН можно найти, вычитая из общей концентрации ее количество молей, продиссоциировавших на ионы,
т. е. х. Следовательно, [НСООН] = (0,1- х). Подставив найденные величины концентраций в уравнение константы ионизации НСООН, получим:
| (0,01 + х) · х | = 1,8 · 10-4 |
| 0,1 - х |
Степень ионизации муравьиной кислоты мала, поэтому ею можно пренебречь и вычисление вести по упрощенной формуле:
| 0,01 · х | = 1,8 · 10-4 |
| 0,1 |
Откуда
| х = | 1,8 ·10-4 · 0,1 | = 1,8 · 10-3 (г-ион/л) |
| 0,01 |
Следовательно, искомая концентрация анионов [НСОО-] в равновесной системе равна 1,8 · 10-3 (г-ион/л).
|
|
|
|
|
Дата добавления: 2015-06-30; Просмотров: 5648; Нарушение авторских прав?; Мы поможем в написании вашей работы!