
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ионное произведение воды и водородный показатель
|
|
|
|
Чистая вода, не содержащая примеси, обладает вполне измеримой электропроводностью, так как молекулы ее, хотя и незначительно, все же распадаются на ионы. Вода является типичным амфотерным электролитом: H2O + H2O ↔ H3O+ + ОН-
кислота1 основание2 кислота2 основание1
Такой процесс ионизации, воды становится понятным, если учесть, что стереохимия молекулы воды определяется конфигурацией из четырех внешних электронных пар вокруг центрального атома кислорода, из четырех две пары связывающие и две неподеленные.
Из четырех внешних электронных пар, окружающих ядро атома кислорода, две пары обобществлены между ядром кислорода и двумя протонами водорода, а две пары электронов кислорода остаются неподеленными; они направлены к противоположным от протонов вершинам тетраэдра, в центре которого расположен ион кислорода. При равновесном положении ядер молекулы воды в парообразном состоянии имеют следующие характеристики: расстояние между атомами кислорода и водорода в воде равно 0,0958 нм; расстояние между атомами водорода равно 0,1515 нм; угол между атомом кислорода и атомами водорода равен 104°27΄; дипольный момент молекулы воды составляет 1,86 (дебая), или 1,86 · 10-18 электростатических единиц.
При взаимной ориентации двух молекул воды вследствие притяжения протона одной из неподеленных электронных пар кислорода связь между кислородом и протоном Н+, расположенным по оси ориентации, ослабляется и становится возможным протекание реакции (рис. 3.1). Следовательно, ион водорода Н+ в водных растворах существует в виде иона гидроксония H3O+. Однако в целях упрощения записей в расчетах вместо Н3О+ пишут Н+, так как такая замена не влияет на результаты вычисления.
По электропроводности можно вычислить активность ионов Н+ и ОН- и константу ионизации воды. Ионизация воды представляет собой обратимый процесс, который схематично представляется так:
H2O ↔ Н+ + ОН-
Применив к нему закон действия масс, выводят уравнение термодинамической константы ионизации:
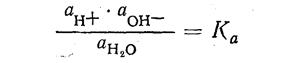
Ка — термодинамическая константа ионизации воды.
Экспериментально найдено, что при 25° С Ка = 1,8 · 10-16. В 1 л воды содержится: (1000 / 18,016) 55,50 моль воды, из которых 1 · 10-7 моль находится в ионизированном состоянии, а остальное количество во 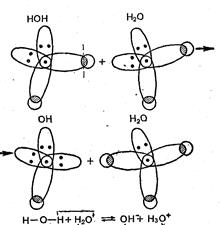 ды - в виде неионизированных молекул. Зная, что концентрация неионизированных молекул воды (равная 55,50 - 1 · 10-7) в 555 млн. раз превосходит концентрацию ионизированных молекул, ее считают величиной постоянной.
ды - в виде неионизированных молекул. Зная, что концентрация неионизированных молекул воды (равная 55,50 - 1 · 10-7) в 555 млн. раз превосходит концентрацию ионизированных молекул, ее считают величиной постоянной.
\Рис. 3.1 Взаимная ориентация двух молекул воды
Преобразуя уравнение константы ионизации воды и подставляя в него экспериментально найденную величину К а и концентрацию неионизированных молекул, получаем:

Постоянная Кн2о, равная произведению активностей ионов водорода и гидроксила, называется ионным произведением воды..
В химически чистой воде концентрации ионов [H+] и [ОН-] ничтожно малы (1 · 10-7 г-ион/л), поэтому их активности практически равны концентрации:
a H+ · a OH - = [H+ ] · [ OH -] = 1·10 –14 (t = 25ºC)
Следовательно, для чистой воды, так же как и для сильно разбавленных растворов электролитов, произведение концентраций водородных и гидроксильных ионов практически равно ионному произведению воды:
[Н+] · [ОН-] = Кн2о
Ионизация воды является эндотермическим процессом, протекающим с поглощением теплоты. Поэтому в соответствии с принципом Ле-Шателье при повышении температуры равновесие ионизации смещается в сторону образования ионов, что приводит к увеличению Кн2о Концентрация ионов [Н+] и [ОН-] изменяется в обратной пропорциональной зависимости относительно друг друга, но никогда не становится равной нулю:

Характеризовать кислотность и основность растворов концентраций ионов водорода, выражаемых числами с отрицательными показателями степени, оказалось практически неудобным. Поэтому
С. П. Зеренсен предложил реакцию водных растворов характеризовать водородным показателем:
рН = - lg [H +]
В нейтральной среде рН = 7 (при 25 °С), в кислой среде рН < 7, в щелочной среде рН > 7. Чем меньше величина рН, тем больше концентрация ионов водорода, тем больше кислотность раствора.
При анализах, а также в технологических процессах многих химических производств большое значение имеет концентрация водородных ионов. Поэтому аналитику приходится часто или определять рН растворов опытным путем, или же вычислять теоретически.
Пример 1. Вычислить рН и определить реакцию раствора, если концентрация ионов водорода [H+] равна 7,45 ·10-4 г-ион/л.
Решение

Реакция раствора кислая.
Пример 2. Вычислить концентрацию ионов водорода в растворе, если рН раствора равен 5,25.
Решение.
1. рН = -lg[H+]. Следовательно, lg[H+] = -рН = -5,25.
2. -lg[H+] = -5,25 = lg 6,75; откуда, [Н+] = 5,62 · 10-6 г-ион/л.
Гидроксильным показателем рОН называется отрицательный десятичный логарифм концентрации ионов гидроксила:
рОН = -lg[ОН-]
Между рН и рОН существует соотношение, выражаемое формулой: рН + рОН = 14 (при 25°С).
Пример 3. Вычислить рН и рОН раствора, если концентрация ионов водорода [Н+] в растворе равна 2,5 ·10-3 г-ион/л.
Решение.
1. По концентрации ионов [Н+] находим рН раствора:
рН = - lg [H+] = - lg 2,5 · 10-3 = 2,6
2. рОН = 14 — рН = 14 — 2,6 = 11,4. Реакция раствора кислая.
Поскольку сильные кислоты ионизированы полностью, растворы их имеют большую концентрацию ионов водорода. Поэтому рН раствора сильных кислот вычисляется с учетом ионной силы раствора и коэффициента активности ионов водорода.
Пример 4. Вычислить рН 0,01 н. раствора НС1.
Решение.
1. Находим ионную силу раствора:

2. По таблице 2.2 находим f H+ При ионной силе 0,01 f H+ = 0,91.
3. Зная концентрацию соляной кислоты НС1 и коэффициент активности f H+, находим активность ионов водорода:
a н+ = c HCl · f H+ = 0,01 · 0,91 = 9,1 · 10-3 (г-ион/л)
4. Вычисляем раН: -lg 9,l ·10-3 = 2,04
раН —показатель активности ионов водорода: раН = -lg а H+. Следовательно, пользуясь понятием а H+, мы находим раН, а не рН раствора. Однако в большинстве учебников аналитической химии пользуются лишь понятием рН, которое вошло в науку раньше и прочно закрепилось. Понятия, же раН (показатель активности ионов водорода) и раОН (показатель активности гидроксильных ионов) являются новыми понятиями, которыми пользуются лишь в научной литературе.
Следовательно, для разбавленных растворов сильных кислот и сильных оснований приближенные подсчеты значения рН можно вести по концентрации ионов [H+] без учета влияния ионной силы раствора.
Пример 5. Вычислить рН 0,01 н. раствора уксусной кислоты, константа ионизации которой равна 1,74 · 10-5.
Решение.
1. Находим активную концентрацию ионов водорода в данное растворе.
СН3СООН — одноосновная кислота. Следовательно, 0,01 н. раствор ее будет обладать такой же молярной концентрацией, т.е.0,01 М:
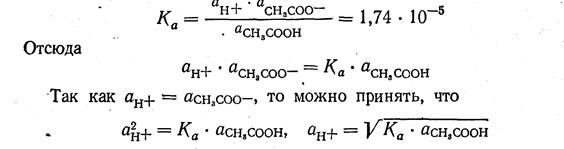
СН3СООН — кислота слабая, поэтому большая часть ее молекул в растворе находится в неионизированном состоянии.
2.Коэффициент активности неионизированных молекул принимается равным единице. Следовательно:

|
|
|
|
|
Дата добавления: 2015-06-30; Просмотров: 1970; Нарушение авторских прав?; Мы поможем в написании вашей работы!