
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Индикаторные ошибки титрования
|
|
|
|
Кроме метода кривых титрования, для выбора индикатора применяют способ вычисления индикаторной ошибки титрования.
Индикаторной ошибкой титрования называют погрешность, которая вызывается несовпадением показателя титрования, используемого индикатора с величиной рН в точке эквивалентности.
Благодаря этой погрешности анализируемый раствор или немного перетитровывают, или недотитровывают, поэтому после окончания титрования смесь содержит свободные ионы Н+ или ОН- Различают несколько типов индикаторных ошибок.
Водородная ошибка титрования обусловливается наличием в растворе избытка ионов водорода. Это может быть или в результате недотитрования сильной кислоты сильной щелочью (Н+нед-ошибка), или вследствие перетитрования сильного основания сильной кислотой (Н+пер-ошибка).
Гидроксильная ошибка может быть двух видов: ОН-нед-ошибка и ОН-пер-ошибка.
Кислотная ошибка титрования обусловливается наличием в растворе нейтральных молекул слабой кислоты.
Основная ошибка титрования вызывается присутствием в растворе (после окончания титрования) нейтральных молекул слабого основания.
Водородная ошибка титрования
Пример 1. Вычислить водородную ошибку титрования, если даны показатель титрования индикатора рТ, нормальность раствора сильной кислоты н., объем ее V¢ мл и общий объем в конце титрования V " мл.
Решение.
Выведем формулу для расчета. Каждый миллилитр нормального раствора будет содержать н.: 1000 г-экв кислоты, а для титрования взяли 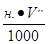 г-экв кислоты, содержащих такое же количество грамм-ионов Н+. Сколько же грамм-ионов Н+ останется несвязанными, если титрование закончили при рН = рТ применяемого индикатора?
г-экв кислоты, содержащих такое же количество грамм-ионов Н+. Сколько же грамм-ионов Н+ останется несвязанными, если титрование закончили при рН = рТ применяемого индикатора?
Поскольку рН = -lg [Н+], постольку данным величинам рН и соответствует концентрация Н+. Оставшееся количество недотитрованных ионов Н+ будет равно [Н+]= 10 -pT г-ион/л.
После титрования в объеме V" мл раствора количество грамм-ионов Н+ будет равно:
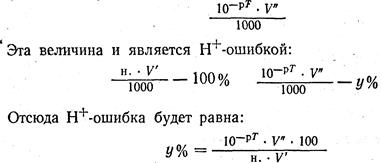
Таким образом вычисляют индикаторную ошибку и решают вопрос, можно ли применять данный индикатор или нет. В том случае, если индикатор не дан, его подбирают так, чтобы рТ был возможно ближе к величине рН в точке эквивалентности (эта ошибка должна быть примерно ± 0,2%).
Пример 2. Вычислить индикаторную ошибку, если титровать 0,12 н. раствор соляной кислоты 0,12 н. раствором гидроксида натрия с метиловым оранжевым.
Решение.
1. Точка эквивалентности при титровании соляной кислоты НС1 гидроксидом натрия достигается при рН = 7, а титрование заканчивают при рН = 4. Следовательно, раствор по окончании титрования будет содержать некоторое количество ионов Н+ (избыточная кислотность), что и вызовет Н+нед- ошибку.
2. Так как нормальность обоих растворов одинакова, тонареакцию затрачиваются равные объемы кислоты и щелочи. Поэтому объем в конце титрования увеличится в два раза и будет равен 2V¢, т. е. V¢¢ = 2V ¢.
Используя формулу, находим:

Знак «минус» показывает, что анализируемый раствор НС1 недотитрован. Величина 0,2% говорит о том, что погрешность не выходит за допустимые пределы, и, следовательно, индикатор метиловый оранжевый в данном случае применим.
Гидроксидная ошибка титрования.
Пример 3. Вычислить ОН--ошибку, если титруют V¢ мл нормального раствора сильной щелочи сильной кислотой и если объем раствора в конце титрования будет V " мл.
Решение.
Титрование заканчивают при рН = рТ взятого индикатора, т. е. в данном случае при рН = 14 — рТ. Следовательно, в конце титрования [0Н-] = 10-(14 — рТ) Тогда в V " мл раствора будет содержаться:

грамм-ионов ОН-, а это и будет ОН--ошибкой.
Для выражения данной ошибки в процентах также составляем пропорцию:

Пример 4. При титровании 0,1 н. раствора соляной кислоты НС1 0,1 н. раствором гидроксида натрия NaOH в присутствии фенолфталеина титрование заканчивается при рН = рТ – 9, т. е, при [H+], = 10-9 г-ион/л (в щелочной среде). Следовательно, при титровании будет иметься некоторый избыток щелочи, что приведет к ОН—ошибке, которую необходимо определить в %..
Решение.
Пользуясь формулой, имеем:
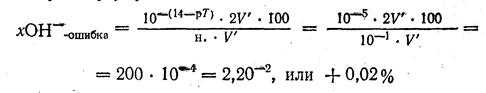
Кислотная ошибка титрования. Вычислим кислотную ошибку титрования, т. е. погрешность, вызванную наличием недиссоциированных молекул слабой кислоты в конце титрования (НАn).
Написав уравнение постоянной диссоциации данной кислоты в растворе, имеем:
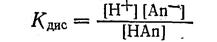
Преобразовав данное уравнение, получим;
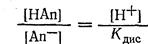
Поскольку НАn — кислота слабая, величина (НАn) практически будет равна общей концентрации свободной кислоты в растворе, а величина [An-] — концентрации соли в растворе.
Но каждый моль соли образуется в результате нейтрализации 1 моль кислоты. Поэтому отношение:
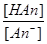
можно рассматривать как отношение концентраций неоттитрованной части кислоты к оттитрованной и считать его мерой величины кислотной ошибки титрования.
Зная, что [Н+] = 10-pT, а К. = 10-pK, введем эти величины в уравнение

получим окончательную формулу:
НАn-ошибка = 10pK-pT
Пример 5. Вычислить ошибку титрования 0,1 н. раствора уксусной кислоты 0,1 н. раствором гидроксида натрия с индикатором метиловым оранжевым.
Решение.
Для выяснения типа ошибки вычисляем рН раствора в точке эквивалентности:
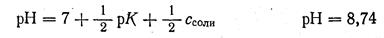
При вычислении Ссоли учитывается увеличение объема раствора в два раза при титровании. Вследствие этого Ссоли будет равна 0,05 М.
Поскольку титрование с метиловым оранжевым заканчивается при рН = 4, то в растворе по окончании титрования будет присутствовать избыточная (неоттитрованная) уксусная кислота. Уксусная кислота -кислота слабая, поэтому она вызовет НАn-ошибку.
Используя уравнение:
НАn-ошибка = 10 pK - pT = 104,76-4 = 10 0,76
и, следовательно, НАn-ошибка = 5,7. Отсюда следует, что неоттитрованная часть уксусной кислоты будет относиться к оттитрованной ее части как 5,7: 1, т. е. из 6,7 части, взятой для титрования, кислоты останется неоттитрованной 5,4. Выражая ошибку (в %), получим:
6,7 ч. кислоты составляет 100%
5,7 ч.»» х %

Следовательно, титровать уксусную кислоту в присутствии индикатора метилового оранжевого нельзя, так как ошибка во много раз превышает допустимую величину.
При выборе индикатора для титрования слабых кислот сильными основаниями рекомендуется руководствоваться правилом.
Если титрование нужно провести так, чтобы индикаторная ошибка титрования не превышала 0,1%, т. е. чтобы оставшаяся неоттитрованная часть составила не более 0,001 от количества оттитрованной кислоты, нужно, чтобы рТ индикатора превышал бы величину рК не менее чем на 3 единицы, т. е.
рТ ³, или рК + 3, или 10рК-рТ ≤ 10-3
Пользуясь этим правилом, можно сказать, что для получения хороших результатов уксусную кислоту можно титровать с индикаторами, у которых рТ ³ 7,73. Следовательно, целесообразно использовать индикатор фенолфталеин с рТ = 9, крезоловый пурпурный с рТ = 8,2.
Щелочная ошибка титрования. Щелочная ошибка титрования вычисляется так же, как и кислотная. Для вычисления ошибки пишут уравнение постоянной диссоциации основания и преобразуют его:
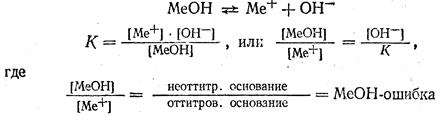
Поскольку рН в конце титрования равен рТ, а рОН- =14 - рТ. получим:
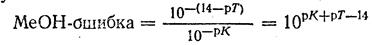
Следовательно, титрование может быть достаточно точным при условии, если МеОН-ошибка равна или меньше величины 10-3, т. е.
рК + рТ - 14 ≤ 3, или рТ ≤ 11 — рК. Поэтому при титровании раствора аммиака в воде (р/С = 4,75) можно применить индикатор с рТ ≤ 6,25. Для того положения можно использовать индикаторы метиловый красный (рТ = 5,5) и метиловый оранжевый (рТ = 4).
|
|
|
|
|
Дата добавления: 2015-06-30; Просмотров: 25232; Нарушение авторских прав?; Мы поможем в написании вашей работы!