
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Индикаторы, применяемые в редоксиметрии
|
|
|
|
В некоторых случаях редоксиметрии при титровании оказывается возможным обойтись без индикатоов.
Подобное безындикаторное титрование возможно, например, при окислении различных восстановителей перманганатом, особенно в кислой среде. Как известно, малиново-фиолетовая окраска МпО4- при этом исчезает в результате восстановления этого иона до почти бесцветного Мп2+. Когда весь восстановитель будет оттитрован, одна лишняя капля перманганата окрасит раствор в явственно розовый цвет.
Без индикатора можно также титровать восстановители раствором иода, поскольку присущая ему темно-бурая окраска исчезает в результате восстановления I2 до I-, и раствором соли церия (IV), так как он окрашен в желтый цвет, а соли церия (III) бесцветны. Однако результаты титрования получаются менее точными, чем при титровании перманганатом, потому что окраска перечисленных веществ менее интенсивна, чем окраска КМпО4. Поэтому в редоксиметрическом титровании, как правило, применяют индикаторы.
Индикаторы для редоксиметрических титрований по их действию можно разделить на две группы.
1 Индикаторы, которые вступают в специфическую реакцию с окислителем или восстановителем. Например, крахмал является прекрасным индикатором на I2, так как образует с иодом смешанные адсорбционные и комплексные соединения ярко-синего цвета.
2 Индикаторы, у которых перемена окраски не зависит от специфических свойств окислителя или восстановителя, реагирующих между собой при титровании, а связана с достижением титруемым раствором определенного окислительно-восстановительного потенциала. Такие индикаторы называются окислительно-восстановительными или редокс-индикаторами.
Из сказанного ясно, что окислительно-восстановительные индикаторы представляют собой вещества, способные обратимо окисляться или восстанавливаться, причем окисленная и восстановленная формы их имеют различную окраску.
Если обозначить эти формы схематически через Indок и Indвос, то их превращения друг в друга можно представить при помощи следующего уравнения: Indок + n e ↔ Indвос
Очевидно, эта система представляет собой окислительно-восстановительную пару. Применяя к ней уравнение Нернста, получим:
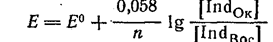
где Е° - стандартный потенциал данной пары, т. е. потенциал, отвечающий случаю, когда [Indок] == [Indвос].
Если к раствору какого-либо восстановителя (или окислителя прибавить 1-2 капли раствора того или иного окислительно-восстановительного индикатора, то установится соответствующее потенциалу раствора отношение между концентрациями окисленной и восстановленной форм индикатора. При этом раствор приобретет соответствующую данному отношению окраску. Если такой раствор титровать каким-либо окислителем (или восстановителем), то величина потенциала Е будет изменяться. Соответственно будет меняться также и отношение [Indок]/[Indвос]. Однако, как и для индикаторов метода кислотно-основного титрования, не всякое изменение этого отношения наш глаз воспринимает как изменение окраски. Если принять, что приЕсли принять, что присутствие одной из различно окрашенных форм индикатора глаз перестает замечать тогда, когда концентрация ее становится в 10 раз меньше, чем концентрация другой формы, то для области перехода окислительно-восстановительного индикатора получим следующие пределы значений Е:
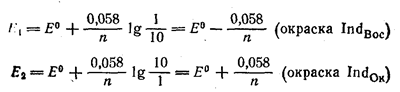
Следовательно, интервал перехода (рТ) описывается уравнением
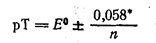
Таким образом, интервал перехода индикатора лежит между значениями двух потенциалов, один из них на 0,058/n больше, другой на 0,058/n меньше, чем его стандартный потенциал.
В случае индикатора дифениламина, для которого Е° = + 0,76 в, а п = 2, интервал перехода лежит в пределах
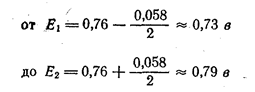
Приведем несколько примеров редокс-индикаторов.
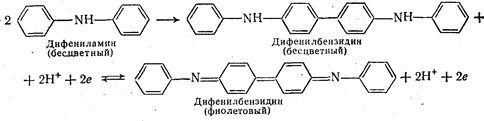
Дифениламин является одним из первых редокс-инфакторов, описанных в литературе; Е° дифениламина 0,76 в при рН = 0. Дифениламин вначале необратимо окисляется до дифенилбензидина, который обратимо окисляется до дифенилбензидина фиолетового:
N-Фенилантраниловая кислота. Стандартный потенциал Е0 этого индикатора равен 1,08 в; переход окраски от бесцветной к красно-фиолетовой обратим:
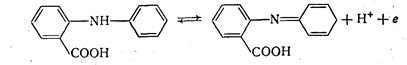
Реакция окисления аналогична реакциям, протекающим с другими дифениламинами.
Ферроин. Этот индикатор принадлежит к группе очень интресных индикаторов, которые представляют собой комплексы неорганических ионов с органическими реагентами. Ферроин-комплексное соединение 1,10-фенантролина (о-фенантролин) с железом. (II), окрашенное в ярко-красный цвет:

При окислении ферроина образуется комплексное соединение Fе111, имеющее бледно-голубой цвет:

Потенциал перехода окраски зависит от [Н+]; в 1 М Н2SO4 Е°== 1,06 в.
Чтобы окраска окислительно-восстановительного индикатора изменялась при титровании резко и индикаторная ошибка титрования была незначительной, интервал перехода индикатора должен находиться в пределах скачка потенциалов на кривой титрования.
Основной недостаток окислительно-восстановительных индикаторов в том, что в зависимости от рН раствора обычно изменяется значение потенциала, при котором наблюдается переход индикатора из одной формы в другую. Изменение окраски некоторых окислительно-восстановительных индикаторов происходит довольно медленно, нередко образуются промежуточные соединения.
Некоторые окислительно-восстановительные индикаторы приведены в таблице 11.1.
Таблица 11.1Окислительно-восстановительные индикаторы
| Индикатор | Окраска | E0, в при [H+]=1 | |
| Indок | Indвос | ||
| Дифениламин | Сине-фиолетовый | Бесцветный | +0,76 |
| Дифениламиназосульфоновая кислота | Красно-фиолетовый | Бесцветный | +0,84 |
| Фенилантраниловая кислота | Красно-фиолетовый | Бесцветный | +1,08 |
| о-Фенантролин-Fе2+-комплекс (ферроин) | Бледно-голубой | Красный | +1,06 |
| о,о'-Дифениламиндикарбоно- вая кислота | Сине-фиолетовый | Бесцветный | +1,26 |
|
|
|
|
|
Дата добавления: 2015-06-30; Просмотров: 6642; Нарушение авторских прав?; Мы поможем в написании вашей работы!