
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Скорость реакций окисления - восстановления
|
|
|
|
Окислительно-восстановительные реакции имеют ряд особенностей, затрудняющих их использование в титриметрическом анализе.
К этим особенностям относится, например, обратимость. Поэтому в некоторых случаях приходится тем или иным способом сдвигать равновесие в желаемом направлении. Другой особенностью является различная скорость разных окислительно-восстановительных реакций.
Зная Е°, можно лишь предвидеть возможность или невозможность прохождения окислительно-восстановительной реакции: данная система может быть окислена лишь такой системой, окислительно-восстановительный потенциал которой выше. Следует учитывать также и скорость протекания реакции: система может иметь очень высокий потенциал, но действовать как окислитель с очень малой скоростью, например для персульфата Е° (S2O82-/SO42-) = +2,0 в, однако этот окислитель реагирует с некоторыми восстановителями с такой малой скоростью, что ее можно считать равной нулю.
Как известно, медленно протекающие реакции непригодны для титрования, так как оно в этом случае не только затянулось бы, но не могло бы быть выполнено достаточно точно. Поэтому при использовании таких реакций в объемном анализе необходимо их ускорять.
Есть ряд способов для увеличения скорости реакций:
1. Повышение температуры. Как правило, с повышением температуры на каждые 10 град скорость реакции увеличивается в 2-3 раза. Поэтому нередко реакция, практически не идущая при комнатной температуре, при нагревании протекает с достаточной скоростью. В качестве аналитически важного примера можно привести реакцию, происходящую при титровании сурьмы (III) броматом калия в кислой среде:
BrO3- + 3[SbCI5]2- + 6H+ + 3CI- → Br - + 3[SbCI6]- + 3H2O
При комнатной температуре эта реакция протекает очень медленно. Титрование проводят при 70-80°С, в этих условиях титрование проходит нормально, так как скорость реакции значительно увеличивается.
2. Изменение [Н+] и концентраций реагирующих веществ. Согласно закону действия масс скорость химических реакций в гомогенной (однородной) среде прямо пропорциональна произведению концентраций реагирующих веществ, причем концентрации эти должны быть взяты в степенях, равных соответствующим стехиометрическим коэффициентам. Например, скорость реакции:
2I- + H2O2 +2H+ ↔ I2 +2H2O (1)
по закону действия масс должна равняться:
υ = k [I-]2[H2O2][ H+]2
где k — константа скорости реакции.
Если концентрации всех трех веществ сделать одинаковыми, равными С, тo получим:
υ = k C5
Однако, в действительности скорость этой реакции пропорциональна не пятой степени концентрации, а ее квадрату, т. е. υ = k C 2. Причина отклонений заключается в том, что в процессе реакций часто происходит не только переход электронов, но и изменение состава участвующих в реакции ионов. Сложные реакции проходят всегда через ряд промежуточных стадий, так что уравнения реакций не отражают действительного течения процесса, а являются лишь суммарными. Скорость же всего процесса зависит именно от скоростей течения отдельных промежуточных стадий и потому не может быть заранее определена на основании суммарного уравнения реакции.
Обычно неизвестно, каковы именно эти промежуточные стадии. В отдельных случаях, однако, удается выяснить их и, таким образом, проследить действительное течение процесса.
Например, реакция (1), является, судя по приведенному уравнению, пятимолекулярной. Экспериментально установлено, что в одной из промежуточных стадий ее происходит образование аниона иодноватистой кислоты по уравнению:
I- + H2O2 ↔ IO- + H2O (2)
Далее, образовавшиеся IO- -ионы соединяются с Н+:
IO- + H+ ↔ HIO (3)
и, наконец, HIO, являющаяся энергичным окислителем, окисляет 1--ионы:
HIO + I- + H+ ↔ I2 +2H2O (4)
Почленно складывая уравнения (2), (3) и (4), получаем суммарное уравнение реакции (1).
Очевидно, скорость подобной сложной реакции определяется скоростью наиболее медленно протекающей промежуточной стадии ее. Наиболее медленной стадией рассматриваемого окислительно-восстановительного процесса является реакция (2), а так как она бимолекулярная, скорость всего процесса должна быть пропорциональна квадрату концентрации, что и наблюдается на опыте.
Следовательно, отклонения от закона действия масс, наблюдаемые в отношении скоростей окислительно-восстановительных реакций, являются лишь кажущимися и объясняются существованием обычно точно неизвестных промежуточных стадий окислительно-восстановительных процессов.
3. Присутствие катализатора. Различают положительные катализаторы, которые ускоряют реакции, и отрицательные, замедляющие их. Катализатором может быть постороннее вещество и может быть продукт реакции — автокатализ.
В качестве примера можно привести реакцию между оксалатионом и перманганатом. Эта реакция рассматривалась многимиисследователями. Впервые она была детально изучена Н. А. Шиловым. Известно, что если смешать чистые, не содержащие примесей растворы щавелевой кислоты и перманганата калия, то реакция, несмотря на большую разность потенциалов, практически не протекает. И только спустя значительный промежуток времени реакция начинает протекать с большой скоростью. При титровании растворов оксалата перманганатом первые капли перманганата обесцвечиваются очень медленно, но потом реакция протекает очень быстро, и перманганат обесцвечивается мгновенно. Уже давно было замечено, что реакция протекает быстро лишь в том случае, если в растворе присутствуют Мп2+-ионы, которые играют роль катализатора в данной реакции. Пока их концентрация мала, реакция протекает медленно. Это типичный пример автокатализа.
4. Индуцированные реакции. Скорость химической реакции может резко изменяться при возникновении индуцированных (сопряженных) реакций. Явление химической индукции известно более ста лет. Его изучали и изучают многие исследователи, так как возникновение индуцированных реакций служит источником многих ошибок в анализе. Сущность явления состоит в том, что некоторые окислительно-восстановительные реакции без индуктора не протекают или протекают медленно. Индуктор в отличие от катализатора обязательно принимает участие в первичной реакций и не регенерируется.
В качестве примера индуцированных реакций рассмотрим реакцию титрования солей Fе2+ перманганатом:
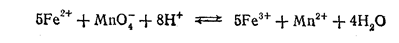
Как видно из уравнения, реакция идет с участием Н+-ионов, и поэтому ее следует проводить в кислой среде. Однако для количественного протекания реакции далеко не безразлично, с какой кислотой вводят Н+-ионы. Опыт показывает, что при титровании в сернокислой среде расход перманганата строго соответствует содержанию Fе2+ и результат определения получается правильным. Наоборот, при титровании в присутствии НСI или хлоридов наблюдается повышенный расход КМпO4. Это указывает на то, что он затрачивается на какую-то побочную реакцию. Если учесть, что титруемый раствор пахнет хлором, станет ясным, что эта реакция протекает следующим образом:
10CI- + 2MnO4- + 16H+ → 5CI2 + 2Mn2+ + 8H2O
Конечно, хлор, образующийся в этой реакции, должен, в свою очередь, окислять Fе2+:
2Fе2+ + CI2 → 2Fе3+ + 2CI-
Если бы весь хлор оставался в растворе, то количество окисленного им железа было бы строго эквивалентно количеству перманганата, затраченного на образование CI2. В действительности, часть хлора успевает улетучиться, что и является причиной повышенного расход, КМпO4 при титровании.
Таким образом, реакция между MnO4- и Fе2+ индуцирует реакцию между MnO4- и CI-.
|
|
|
|
|
Дата добавления: 2015-06-30; Просмотров: 3939; Нарушение авторских прав?; Мы поможем в написании вашей работы!