
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
В. Кривая титрования слабого основания сильной кислотой
|
|
|
|
При титровании слабого основания раствора аммиака в воде сильной кислотой для наглядности и удобства сравнения также берут 20 мл 0,1 н. слабого основания и добавляют из бюретки 0,1 н. раствор соляной кислоты. Необходимо отметить, что, поскольку в бюретке в данном случае будет кислота, а в колбе (для титрования) раствор гидроксида аммония, кривая титрования пойдет снизу вверх, так как начальная точка будет лежать при рН 0,1 н. раствора аммиака.
Точка эквивалентности будет соответствовать рН соли, образованной слабым основанием и сильной кислотой, и, следовательно, будет лежать в кислой среде (гидролиз).
Расчет начальной, конечной и промежуточных точек будет примерно идентичен второму случаю. Результаты его помещены в таблице 10.3
Таблица 10.3 Изменение рН при титровании 20 мл 0,1 н. раствора гидроксида аммония 0,1 н. раствором соляной
кислоты
| Прибавлено HСl | Остаток NH4OH | рН | |
| % | Мл | % | |
| 99,9 100,1 | 19,8 19,98 20,00 20,02 20,2 | 0,1 Избыток 0,1 | 11,3 9,4 8,4 7,3 6,2 5,1 |
На основании этих данных аналогичным методом строят кривую (рис.10.3).
Анализируя характер кривой, можно сделать следующие выводы:
а) точка эквивалентности расположена в слабокислой среде (рН = 5,0);
б) начальная точка лежит в слабощелочной среде;
в) скачок рН на кривой титрования от рН = 4,0 до рН = 6,2.
В данном случае для титрования могут быть применены индикаторы, интервал рН которых лежит в зоне скачка кривой титрования, а именно метиловый красный (рТ = 5,5) и метиловый оранжевый (рТ = 4,0).
Титрование слабых оснований слабыми кислотами не применяют, так как оно невозможно, что и подтверждает отсутствие скачка на кривой.
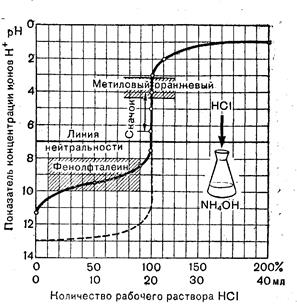
Рис. 10.3 Кривая титрования слабого основания сильной кислотой.
Многоосновные кислоты ионизируют по ступеням. Для сильных кислот ступенчатая ионизация не отражается на характере кривых титрования. Кривые титрования их идентичны кривым титрования одноосновных кислот. При титровании слабых многоосновных кислот для каждой ступени ионизации на кривой титрования определяется своя точка эквивалентности, которая характеризуется плавным перегибом (изгибом, рис. 10.4).

Рис.10.4. Кривая титрования фосфорной кислоты
В том случае, когда эти перегибы резко вырисовываются, имеется возможность определить точки эквивалентности при титровании.
Аналогичные варианты наблюдают и при титровании многоатомных оснований.
Выбор индикатора. Прежде чем приступить к титрованию, необходимо рассчитать величину рН, при которой следует закончить процесс титрования. Определяя значение рН в точке эквивалентности и зная рН изменения окраски индикатора, подбирают соответствующий индикатор метода нейтрализации. Так, например, если мы хотим оттитровать раствор уксусной кислоты при помощи раствора гидроксида калия, мы узнаем рН в точке эквивалентности. Эта величина равна 9,0. Следовательно, берем индикатор с интервалом перехода около 9,0. Мы знаем, что таким индикатором является фенолфталеин, область перехода которого 8—10, а рТ = 9,0.
Вести титрование в методе нейтрализации необходимо в присутствии индикатора, область перехода которого соответствует скачку рН.
|
|
|
|
|
Дата добавления: 2015-06-30; Просмотров: 4190; Нарушение авторских прав?; Мы поможем в написании вашей работы!