
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
В интегральной форме соотношение (1) имеет вид
|
|
|
|
Тем не менее, никто не видел, чтобы, например, разбившаяся ваза самопроизвольно восстановилась из осколков. Этот процесс можно наблюдать, если предварительно засняв на пленку, просмотреть ее в обратном направлении, но никак не в действительности.
По существу все процессы в макросистемах являются необратимыми
(строго говоря, таковыми являются и процессы, которые мы называли обратимыми — это идеализация, удобная для решения многих важных вопросов).
Возникает принципиальный вопрос: в чем причина необратимости? Это выглядит особенно странно, если учесть, что все законы механики обратимы во времени.
| Решение этой сложной проблемы пришло с открытием новой термодинамической величины — энтропии — и раскрытием ее физического смысла. |
Понятие энтропии было открыто теоретически Клаузиусом — одно из самых удивительных, сделанных «на кончике пера».
Несмотря на это обстоятельство и отсутствие приборов, которые бы измеряли энтропию вещества, это понятие оказалось необычайно плодотворным.
Энтропия S вводится через ее элементарное приращение как
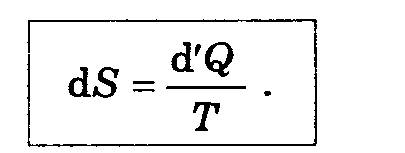 (1)
(1)
d'Q не есть приращение какой-то функции, но после деления на температуру Т, оказывается, получается приращение некоторой функции (энтропии).
В отличие от теплоты, энтропия:
· такая же функция состояния как температура T,
· внутренняя энергия E,
· давление P.
| Полученное системой тепло Q зависит от процесса перехода из начального состояния в конечное. |
Приращение же энтропии 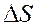 совершенно не зависит от процесса, а только от начального и конечного состояний. совершенно не зависит от процесса, а только от начального и конечного состояний.
|
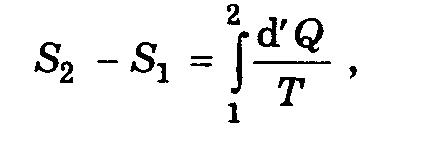 (2)
(2)
при этом не играет роли, какой именно процесс перевел систему из состояния 1 в состояние 2.
Важно лишь, чтобы состояния 1 и 2 были равновесными, расчет же с помощью (2) может проводиться по любому обратимому процессу между состояниями 1 и 2.
Замечание. Знак равенства в формулах (1) и (2) относится только к равновесным (квазистатическим) процессам. В случае же неравновесных процессов дело обстоит иначе: знак «=» заменяется на «>».
| Введение таким образом энтропии S означает, что мы можем вычислять только разность энтропии, но нельзя сказать, чему равна энтропия в каждом из состояний, т.е. энтропия этими формулами может быть определена с точностью до прибавления произвольной аддитивной постоянной. |
Свойства энтропии
1. Итак, энтропия — функция состояния. Если процесс проводят вдоль адиабаты, то энтропия системы не меняется
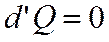
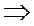
 .
.
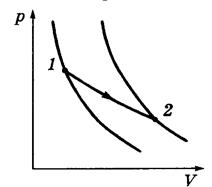
Рис.1.
|
|
|
|
|
Дата добавления: 2015-07-02; Просмотров: 487; Нарушение авторских прав?; Мы поможем в написании вашей работы!