
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Термодинамика
|
|
|
|
Работа 2. Энтропия и второе начало термодинамики
Идеальный газ - физическая модель, согласно которой:
1) собственный объем молекул газа пренебрежимо мал по сравнению с объемом сосуда;
2) между молекулами газа отсутствуют силы взаимодействия;
3) столкновения молекул газа между собой и со стенками сосуда абсолютно упругие.
Исходя из этого, идеальный газ можно рассматривать как совокупность беспорядочно движущихся молекул-шариков, имеющих пренебрежимо малый собственный объем и не взаимодействующих друг с другом на расстоянии.
Уравнением состояния называется уравнение, которое связывает давление р,объем Vи температуру Ттермодинамической системы, находящейся в состоянии термодинамического равновесия. Для идеального газа уравнением состояния является уравнение Клапейрона- Менделеева: 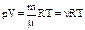 где константа R =8,31 Дж/(моль×К) — называется универсальной газовой постоянной.
где константа R =8,31 Дж/(моль×К) — называется универсальной газовой постоянной.
Внутренняя энергия U — это энергия хаотического (теплового) движения микрочастиц системы (молекул, атомов, электронов, ядер и т.д.) и энергия взаимодействия этих частиц. К внутренней энергии не относятся кинетическая энергия движения системы как целого и потенциальная энергия системы во внешних полях.
Внутренняя энергия — однозначная функция термодинамического состояния системы — в каждом состоянии система обладает вполне определенной внутренней энергией. Поэтому, внутренняя энергия не зависит от того, каким образомсистема пришла в данное состояние. При переходе системыиз одного состояния в другое изменение внутренней энергии определяется только разностью значений внутренней энергии этих состоянийи не зависит от пути перехода.
Число степеней свободы — это число независимых переменных,полностью определяющих положение системы в пространстве. В реальных молекулах нет жесткой связи между атомами в молекуле, поэтому необходимо учитывать также степени свободы колебательного движения атомов внутри молекулы.
Независимо от общего числа степеней свободы молекулы, три степени свободы всегда поступательные. На каждую из них приходится треть кинетической энергии поступательного движения молекулы (e0):
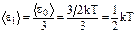
Закон Больцмана о равномерном распределении энергии по степеням свободы (закон равнораспределения): Для системы, находящейся в состоянии термодинамического равновесия на каждую поступательную и вращательную степень свободы приходится в среднем кинетическая энергия, равная kT/2, а на каждую колебательную степень свободы — в среднем энергия, равная kT.
Энергия колебательных степеней свободы вдвое больше, поскольку колебательная система обладает равными по величине средними значениями как кинетической, так и потенциальной энергии. Таким образом, средняяэнергия молекулы, 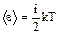 ,где i — сумма числа поступательных, числа вращательных и удвоенного числа колебательных степеней свободы молекулы:i = iПОСТ + iВРАЩ + 2iКОЛЕБ.
,где i — сумма числа поступательных, числа вращательных и удвоенного числа колебательных степеней свободы молекулы:i = iПОСТ + iВРАЩ + 2iКОЛЕБ.
|
|
|
|
|
Дата добавления: 2015-07-02; Просмотров: 310; Нарушение авторских прав?; Мы поможем в написании вашей работы!