
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Второе начало термодинамики
|
|
|
|
Количество тепла δQ, которое должно быть доставлено системе или отнято у неё при переходе от одного состояния в другое, не определяется однозначно начальным и конечным состояниями, но существенно зависит от способа осуществления этого перехода (δQ не является функцией состояния системы).
Однако, приведенное количество теплоты — отношение теплоты δQ к температуре Т системы при бесконечно малых изменениях состояния системы — есть функция состояния системы. В любом обратимом круговом процессе
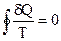
Следовательно, подынтегральное выражение есть полный дифференциал некоторой функции, которая определяется только начальным и конечным состояниями системы и не зависит от пути, каким система пришла в это состояние.
Энтропией S называется функция состояния системы, дифференциалом которой является δQ/Т:
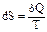
Т.о. первое начало термодинамики δQ = dU + dA можно записать в виде: TdS = dU + δA,
откуда δA = TdS – dU = d(TS) – SdT – dU = - d(U – TS) – SdT = - dF - SdT
Функция F = U – TS является функцией состояния системы и называется энергией Гельмгольца или свободной энергией.
В замкнутой системе для обратимых процессов ΔS = 0; для необратимых циклов ΔS >0.
Энтропия замкнутой системы может либовозрастать (в случае необратимых процессов), либо оставаться постоянной (в случае обратимых процессов).
ΔS ≥ 0 — неравенство Клаузиуса.
Поскольку dS и δQ имеют один и тот же знак, то по характеру изменения энтропии можно судить о направлении процесса теплообмена. При нагревании тела δQ > 0 и его энтропия возрастает dS > 0, при охлаждении δQ < 0 и энтропия тела убывает dS < 0.
Изоэнтропийным называется процесс, протекающий при постоянной энтропии (S = соnst).
В обратимом адиабатическом процессе δQ = TdS = 0, так что dS = 0и S = соnst,поэтому адиабатический процесс является изоэнтропийным.
Статистическое толкование энтропии. Термодинамическая вероятность W состояния тела или системы —это число способов, которыми может быть реализовано данное конкретное термодинамическое состояние (макросостояние).Иначе говоря, это число всевозможных микрораспределений частиц по координатам и скоростям (микросостояний),которыми может быть осуществлено данное макросостояние.
Формула Больцмана: 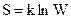 , где k —постоянная Больцмана.
, где k —постоянная Больцмана.
Энтропия системы определяется логарифмом числа микросостояний, с помощью которых может быть реализовано данное макросостояние.
Энтропия является мерой неупорядоченности системы, — чем больше число микросостояний, реализующих данное макросостояние, тем больше энтропия.
Принцип возрастания энтропии. Все процессы е замкнутой системе ведут к увеличению еёэнтропии.В замкнутой системе процессы идут в направлении от менее вероятныхсостояний к более вероятным,до тех пор, пока вероятность состояния не станет максимальной. В состоянии равновесия — наиболее вероятного состояния системы — число микросостояний максимально, при этом максимальна и энтропия.
Второе начало термодинамики. Любой необратимый процесс в замкнутой системе происходит так, что энтропия системы при этом возрастает (закон возрастания энтропии).
Первое началотермодинамики выражает закон сохранения и превращения энергии применительно к термодинамическим процессам.
Второе началотермодинамики определяет направление протекания термодинамических процессов, указывая, какие процессы в природе возможны, а какие — нет.
Существую ешё две формулировки второго начала термодинамики, эквивалентных закону возрастания энтропии:
1) по Кельвину: невозможен круговой процесс, единственным результатомкоторого является превращение теплоты, полученной от нагревателя, в эквивалентную ей работу;
2) по Клаузиусу: невозможен круговой процесс, единственным результатомкоторого является передача теплоты от менее нагретого тела к телу более нагретому.
|
|
|
|
|
Дата добавления: 2015-07-02; Просмотров: 455; Нарушение авторских прав?; Мы поможем в написании вашей работы!