
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Модель термодинамической системы
|
|
|
|
Третье начало термодинамики.
Третье начало термодинамики — теорема Нернста-Планка — постулирует поведение термодинамических систем при нуле Кельвина (абсолютном нуле): энтропия всех тел в состоянии равновесия стремится к нулю по мере приближения температуры к нулю Кельвина:
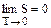
Изучая различные процессы и явления, часто используют достаточно простые модели, позволяющие, однако, выяснить основные закономерности, не отвлекаясь на многочисленные нюансы. Например, теплообмен можно моделировать с помощью системы, состоящей из 1600 атомов. Каждый атом может находиться в двух состояниях: возбужденном (нагретом) и невозбужденном (холодном). Возбужденные атомы помечаются красным цветом. Движения возбужденных атомов независимы, возбуждение передается только ближайшим соседям (для квадратной сетки их число равно 8) и случайным образом, так что вероятность передачи возбуждения любому соседнему атому одинакова. Если в начальный момент времени в подсистеме (какой-либо части системы, содержащей небольшое число атомов) число возбужденных атомов велико, то в дальнейшем будет наблюдаться миграция энергии из подсистемы во внешнюю систему. Другими словами подсистема будет охлаждаться за счет нагревания внешней (оставшейся части) системы. Каким будет конечное состояние системы? Если наблюдать за системой на микроскопическом уровне, то есть следить за движением отдельных атомов, то конечное состояние не существует. Энергия будет бесконечно долго мигрировать по системе. Однако для наблюдателя следящего за системой “ в целом”, и не различающего движение отдельных атомов, существует конечное состояние. Это состояние характеризуется равномерным распределением энергии по всей системе и называется состоянием термодинамического равновесия. Таким образом, процесс, сопровождающийся взаимодействием частиц (например, соударениями) и случайной передачей энергии возбуждения, приводит к рассеянию энергии. Как только энергия равномерно распределяется по всем доступным состояниям, состояние системы “в среднем” остается в дальнейшем неизменным.
|
|
|
Результатом миграции энергии является охлаждение подсистемы и нагревание внешней системы. В состоянии равновесия, когда возбуждение равномерно распределено по всем атомам, энергия подсистемы меньше, чем энергия внешней системы, так как размеры подсистемы меньше размеров внешней системы, а значит в ней меньше число возбужденных атомов. Однако отношение числа возбужденных атомов к общему числу атомов одинаково в обеих системах. Таким образом, температуру можно определить как величину пропорциональную отношению числа возбужденных атомов к общему числу атомов системы. Температура служит мерой неупорядоченного движения, являясь термодинамической характеристикой систем, состоящих из большого числа частиц. Важное отличие температуры и энергии состоит в том, что система может иметь большую энергию, но низкую температуру. Например, для достаточно большой системы число возбужденных атомов может быть велико, а значит и велика суммарная энергия, однако, отношение числа возбужденных атомов к общему числу атомов мало (система велика), и, следовательно, энергия мала. Все перечисленные свойства рассматриваемой модели отражают свойства реальных процессов, реальной Вселенной. Вместе с тем в рассматриваемой модели можно получить состояния, который не реализуются в действительности. Например, если задать начальные условия так, чтобы все возбужденные атомы находились в подсистеме, а во внешней системе все атомы оставались невозбужденными, то это соответствовало бы абсолютному нулю температуры внешней системы. Классическая термодинамика утверждает невозможность такого состояния, т. е. недостижимость абсолютного нуля температуры. Это утверждение известно как теорема Нернста. Количественно термодинамическую температуру можно определить следующим образом:
|
|
|
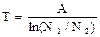
где А – постоянная, зависящая от энергии возбуждения атомов, N1 – число возбужденных атомов, N2 – число невозбужденных атомов. В процессе теплообмена температуры систем стремятся к некоторому промежуточному значению. Достигнув равенства температур, системы останутся в этом состоянии бесконечно долго.
Количественно описать степень разупорядоченности системы позволяет соотношение, установленное Л. Больцманом: 
Величина S - энтропия (entropia - поворот, превращение), термодинамическая функция, существование которой обусловлено вторым началом термодинамики, энтропия определяет направление всех самопроизвольных процессов. Величина W характеризует меру рассеяния энергии и степень хаоса. Энтропия - макроскопический параметр, характеризующий состояние системы в целом, не вникая в свойства системы на атомном уровне. W представляет собой величину, связанную с микроскопическими параметрами, параметрами, характеризующими состояние отдельных частиц, входящих в систему. В случае рассматриваемой модели, W - число возможных распределений возбужденных атомов (число микросостояний), посредством которых реализуется данное макросостояние (состояние с определенным значением энтропии, энергии, давления, объема и других макропараметров).
Рассмотрим подсистему, состоящую из 100 атомов (рисунок 1). Пусть в начальный момент времени все атомы этой подсистемы находятся в возбужденном состоянии. Среди атомов оставшейся частя системы нет ни одного возбужденного. Если предположить, что все атомы тождественны, то имеется всего одно возможное распределение, при котором все атомы подсистемы возбуждены, следовательно, W = 1 и S = 0. Если в результате теплообмена во внешней системе окажется один возбужденный атом, то число возможных комбинаций, посредством которых 99 возбужденных атомов можно разместить в подсистеме из 100 атомов равно:
|
|
|
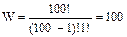 .
.

Рисунок 1
Энтропия такого состояния S = ln100 = 4,61. Энтропия подсистемы увеличилась, следовательно, возросла степень беспорядка. Дальнейший переход возбуждения от подсистемы во внешнюю систему приведет к еще большему возрастанию энтропии. Вместе с тем будет увеличиваться и энтропия внешней системы, причем более быстро, чем для подсистемы. Это связано с тем, что размеры внешней системы больше размеров подсистемы. Суммарная энтропия системы из 1600 атомов будет так же возрастать, и достигнет максимума, когда температуры обеих систем будут равны, причем равенство температур будет определяться равенством отношений числа возбужденных атомов к числу невозбужденных атомов. Таким образом, из формулы Больцмана следует, что процессы, протекающие в замкнутой системе (в нашем случае это система из 1600 атомов) сопровождаются рассеянием энергии и возрастанием энтропии. Максимум энтропии достигается, когда системы, входящие в модельную Вселенную, приходят в состояние теплового равновесия. Состояние равновесия является динамическим. Это значит, что значения температур систем постоянно меняются случайным образом, флуктуируя вблизи равновесной температуры. Из формулы Больцмана также следует, что одному и тому же макроскопическому состоянию соответствует несколько различных распределений или микроскопических состояний. Два возможных распределения, соответствующих состоянию термодинамического равновесия, показаны на рисунках 2,3. Число их может быть достаточно большим. Так, например, когда 5 возбужденных частиц находятся в системе из 1500 атомов число распределений (микросостояний) равно:
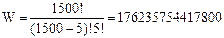
Таким образом, каждое макросостояние можно охарактеризовать термодинамической вероятностью. Эта вероятность тем больше, чем больше число распределений, которыми оно реализуется. Расчеты показывают, что наиболее вероятным состоянием вселенной является состояние термодинамического равновесия. В этом состоянии энергия распределена равномерно по всей вселенной, энтропия максимальна. Если продолжать следить за изменениями, происходящими во вселенной достаточно долго, то можно наблюдать все возможные состояния (распределения) возбужденных атомов. С течением времени система проходит все энергетически доступные ей состояния. Однако большую часть времени система будет находиться в состояниях с равномерным распределением энергии, хотя возможны и достаточно редкие события, когда все возбужденные атомы будут находиться в некоторой небольшой области вселенной. Осуществить такое маловероятное состояние позволяет случайный характер переноса возбуждения. Если в начальном состоянии вселенная находилась в таком маловероятном, упорядоченном состоянии, то с течением времени она будет переходить во все более вероятные состояния, энтропия будет возрастать, первоначальный порядок разрушаться. Именно такой характер имеют спонтанные, самопроизвольные процессы, протекающие в природе. Достигнув наиболее вероятного состояния, которое соответствует термодинамическому равновесию, вселенная никогда не вернется в начальное, упорядоченное состояние. Такое состояние можно рассматривать как гигантскую, макроскопическую флуктуацию, вероятность возникновения которой пренебрежимо мала. Вместе с тем малые отклонения от состояния равновесия - флуктуации будут возникать постоянно, равновесие будет носить динамический характер.
|
|
|

Рисунок 2

Рисунок 3
|
|
|
|
|
Дата добавления: 2015-07-02; Просмотров: 742; Нарушение авторских прав?; Мы поможем в написании вашей работы!