
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Реакції аніонів II аналітичної групи
До складу II аналітичної групи відносяться Сl-, Вr-, І-, S2-, SCN-, [Fе(CN)6]4-, [Fе(СN)6]3- та інші аніони. Утворені ними солі з іонами срібла Аg+ не розчиняються в розведеній азотній кислоті НNOз.
На відміну від аніонів II групи, аніони III групи, а також аніони SО42- і F- утворюють з іонами Аg+ розчинні у воді солі. Решта аніонів I групи утворює з іонами Аg+ малорозчинні у воді солі, які добре розчинні в розведеній НNО3. Тому груповим реагентом на аніони II аналітичної групи є АgNO3 в присутності розведеної азотної кислоти.
Оскільки іони S2- окиснюються азотною кислотою до вільної сірки або навіть і до іонів SО42-, то азотну кислоту слід добавляти не до розчину, що аналізується, а до розчину АgNО3.
Солі іонів барію з аніонами II аналітичної групи розчинні у воді, тому аніони II групи не осаджуються іонами Ва2+.
У водних розчинах аніони II групи, за винятком [Fе(CN)6]4-, [Fе(СN)6]3--іонів, безбарвні.
Реакції хлорид-аніонів Сl-
Дія срібла нітрату АgNO3. Іони Аg+ осаджують Сl-іони у вигляді білого сирнистого осаду АgСl:

Осад не розчиняється в розведеній НNО3, але розчиняється в розчинах NH4OH, (NH4)2СО3, Nа2S2О3, КСN
Дія ртуті (І) і свинець нітрату Нg2(NО3)2, Рb(NО3)2
Іони Нg22+ і Рb2+ утворюють білі осади Нg2Сl2 і РbСl2.
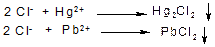
Осади не розчиняються в розведеній НNО3, NH4OH, але розчинність РbС12 значно збільшується при підвищенні температури розчину.
Дія окисників. Вільний хлор Сl2 є дуже сильним окисником, стандартний окисно-відновний потенціал пари Сl2/2Сl- {Сl2/2Сl-=1,36B} досить високий і окиснити Сl- іони можна тільки за допомогою окисника, для якого величина стандартного окисно-відновного потенціалу буде вища за +1,36 В. Такою системою може бути МnО4-/Мn2+ для якої {МnО4-/Мn2+=1,51B}
10Сl-+2МnО4-+16Н+  5Сl2+2Мn2++8Н2О.
5Сl2+2Мn2++8Н2О.
Не дивлячись на те, що приведена реакція супроводжується знебарвленням реагенту МпО4--іона, для виявлення іонів С1- вона практично не використовується.
Реакції бромід-іонів Вr-
Іон Вr--аніон бромидної кислоти НВr, яка є розчином бромистого водню у воді. Подібно до НСl, НВr є сильною кислотою. Серед солей бромоводневої кислоти (бромідів) нерозчинними у воді є лише АgВr, Нg2Вr2 та РbВг2. За своїми властивостями броміди дуже близькі до хлоридів і відрізняються від них меншою розчинністю АgВr, Нg2Вr2, РbВr2, меншою величиною стандартного окисно-відновного потенціалу пари Вr2/2Вr- (E°Br2/2Br-=+1,07В проти Е°Cl2/2Cl-=+1,36В} та деякими іншими характеристиками.
Дія срібла нітрату АgNO3 Іони Аg+ осаджують з бромідних розчинів жовтуватий осад АgВr:

Осад АgВr не розчиняється в розведеній НNO3, слабо розчиняється у водному розчині аміаку і розчиняється в розчинах Na2S2O3 i KCN

Срібло бромід легко відновлюється до металічного срібла при дії на осад порошкоподібного цинку в присутності води або 2 н розчину Н2SО4.
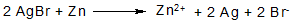
При цьому Вr--іони переходять в розчин, де і можуть бути виявлені.
Дія окисників: а) Всі окисники, які окиснюють хлорид-іони до вільного хлору (КМnО4, РbО2, МnО(ОН)2, К2Сг2О7), окиснюють також і бромід-іони до вільного брому:

б) Дія хлорної води або гіпохлориту натрію NaClO. Хлорна вода та гіпохлорит-іони СlO- виділяють з кислих розчинів бромідів вільний бром, який екстрагується органічними розчинниками (СНС13, СС14, С6Н6), забарвлюючи їх в помаранчевий колір. Надлишок хлору окиснює вільний бром з утворенням бромхлориду ВrСl жовтого кольору:

Реакції йодид-іонів І-
Йодид-іон є аніоном йодоводневої кислоти. Йодоводнева кислота представляє собою розчин йодистого водню у воді. У водному розчині йодистий водень повністю дисоціює на іони. Тому йодоводнева кислота НІ подібно до хлороводневої НС1 та бромоводневої НВr є сильною кислотою:
НІ→Н++I-
Иодид-аніони утворюють малорозчинні у воді солі з тими ж катіонами, що і хлориди і броміди, але розчинність йодидів (АgI,Нg2І2, РbІ2) значно менша. Оскільки стандартний потенціал пари І2/2І- значно менший I2/2I-=0,54 В за потенціал системи Вг2/2Вr- =1,07 B, то йодид-іони легше окиснюються окисниками.
Дія срібло нітрату AgNO3 Иодид-іони І- з іонами срібла Аg+ утворюють жовтий осад АgІ:
І-+Аg+→АgI↓
Осад АgІ слабо розчиняється в Na2S2О3 і добре розчиняється врозчині КCN:

Осад АgІ реагує також з порошком металічного цинку, який відновлює іони Аg+ до металічного срібла Аg, а І--іони переходять в розчин, де і можуть бути виявлені:

Для одержання золотистих кристалів до невеликої кількості осаду РbІ2 в пробірки додають дистильованої води і нагрівають до повного розчинення РbІ2. І потім пробірку швидко охолоджують в струмені води. При цьому виділяються красиві золотисті кристали і реакцію іноді називають реакцією "золотого дощу".

Дія окисників: а) Іони Сu2+ окиснюють йодид-іони І- до вільного йоду І2, який забарвлює розчин з осадом СuІ в бурий колір:

б) Азотиста кислота НNО2 в кислому середовищі окиснює йодид-іони до вільного йоду:

в) Хлорна вода виділяє вільний йод:

Вільний йод екстрагується органічними розчинниками, забарвлюючи їх у фіолетовий колір.
Надлишок хлорної води окиснює йод до безбарвної йодноватої кислоти.
|
|
Дата добавления: 2015-06-28; Просмотров: 5911; Нарушение авторских прав?; Мы поможем в написании вашей работы!