
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Визначення концентрації розчину натрій тіосульфату за калію біхроматом
|
|
|
|
Пряме титрування розчину Na2S2O3 розчином K2Cr2O7 неможливе, так як біхромат окиснює тіосульфат натрію до політіонових кислот. Користуються методом заміщення: до розчину калій біхромату добавляють КІ у надлишку, при цьому утворюється еквівалентна кількість I2.
K2Cr2O7+6KI+7H2SO4 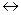 4K2SO4+Cr2(SO4)3+3I2+7H2O.
4K2SO4+Cr2(SO4)3+3I2+7H2O.
Йод, що утворився за реакцією, титрують робочим розчином натрій тіосульфату:
I2+2 Na2S2O3 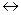 2NaI+Na2S4O6.
2NaI+Na2S4O6.
Розчин крохмалю використовують, як індикатор, для визначення точки еквівалентності.
Хід аналізу. Наважку калій біхромату, близько 0,6 г, зважують на аналітичних терезах, переносять у мірну колбу 250,0 мл, розчиняють у воді, доводять розчин водою до риски, ретельно перемішують розчин. Відбирають піпеткою 15,0 мл розчину K2Cr2O7, переносять його в колбу для титрування, добавляють 5 мл розчину H2SO4 (1:4) і приблизно 1 г сухого КІ.
Обережно ополіскують горло колби, добавляють близько 50 мл води, колбу закривають і залишають на 2-3 хвилини. Потім титрують розчином Na2S2O3, концентрацію якого визначають. Титрують до жовтого забарвлення розчину, потім добавляють близько 1 мл розчину крохмалю і продовжують титрування до зникнення синього забарвлення. Розчин матиме зеленувате забарвлення солі хрому (III).
Обчислюють концентрацію розчину Na2S2O3, виходячи із рівності кількостей моль-еквівалентів реагуючих речовин:

де Vп-об’єм піпетки;Vк-об’єм мірної колби.
C(Na2S2O3)= 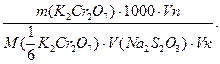
|
|
|
|
|
Дата добавления: 2015-06-28; Просмотров: 749; Нарушение авторских прав?; Мы поможем в написании вашей работы!