
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Б. реакция, 2 б. расчет, всего 4 балла
|
|
|
|
Б. реакция, 2 б. расчет, всего 3 балла
Б. реакция, 2 б. расчет, всего 3 балла
Б. реакция, 2 б. расчет, всего 3 балла
Неорганическая химия
Задача 1 (автор Жиров А. И.)
1. В реакторе 238U поглощает быстрые нейтроны и, испуская b-частицы, превращается в 239Pu:
238U + n = 239Pu + 2b
2. Определим число блоков, приходящихся на 1 т металлического урана. Объем меньших по величине блоков составляет V 1 = p r 2 h = 80,384 см3. Масса урана для такого блока составит V 1·r = 1523,27 г, или 1,523 кг.
Для больших по размеру блоков V 2 = 96,16 см3, а масса урана m 2 = 1822,28 г, или 1,822 кг. Число больших блоков на 1 т урана составит 1000: (1,822 + 1,523:9) = 502, число малых блоков равно 502: 9 = 55,8» 56. Объём алюминиевого покрытия блока составляет 2p rhl + 2p r 2 l. Для малых блоков он составит 26,12 см3 и 30,22 см3 для больших. Тогда масса алюминиевого покрытия блоков составит: 56·26,12·2,698 + 502·30,22·2,698 = 3950 + +40930 = 44 880 г, или 44,88 кг.
3. Для растворения этого алюминия (1,66 кмоль) потребуется не менее 1,66 кмоль гидроксида натрия (6,64 кг):
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2
4. При растворении алюминия в присутствии нитрат-ионов происходит восстановление нитрат-ионов вплоть до аммиака:
8Al + 3NaNO3 + 5NaOH + 18H2O = 8Na[Al(OH)4] + 3NH3
5. В избытке нитрат-ионов восстановление будет идти до нитрит-ионов (без газовыделения):
2Al + 3NaNO3 + 2NaOH + 3H2O = 2Na[Al(OH)4] + 3NaNO2
Нитрата натрия потребуется не менее 1,66: 2 · 3 · 85 = 211,7 кг.
6. При растворении металлического урана в концентрированной азотной кислоте образуется оксид азота (IV):
U + 8HNO3 = UO2(NO3)2 + 6NO2 + 4H2O
На растворение 1 т урана будет израсходовано не менее 1000: 238 · 65 · 8: 0,65 = 3,36 т концентрированной азотной кислоты (реально используется почти в три раза больше). Видимо для удаления избытка кислоты используется существенно больше, чем следует по расчетам и щелочи.
7. Для стехиометрии в реакции:
UO2(NO3)2 + 3 NaCH3COO = 2NaNO3 + Na[UO2(CH3СOO)3]¯
Требуется 1000: 238 · 3 · 82 = 1033,6 кг, или 1,3 т.
8. Уравнения реакций для плутония будут аналогичны уравнениям для урана:
Pu + 8HNO3 = PuO2(NO3)2 + 6NO2 + 4H2O
PuO2(NO3)2 + 3 NaCH3COO = 2NaNO3 + Na[PuO2(CH3СOO)3]¯
PuO22+ + 4H+ +2e = Pu4+ + 2H2O
Pu4+ + 4F– = PuF4¯
Система оценивания:
1. Образование плутония 2 балла.
2. За правильный расчет массы урана (2 балла) и
массы алюминиевого покрытия (2 балла), 4 балла.
4. За правильно записанное уравнение реакции 2 балла.
8. По 1 б. за реакцию, всего 4 балла.
Итого – 25 баллов
Задача 2 (автор Ильин М. А.)
1. Семейство элементов, состоящее из шести благородных металлов (Ru, Rh, Pd, Os, Ir, Pt), – платиновые металлы (платиноиды).
2. Единственным платиновым металлом, легко окисляющимся (в мелкораздробленном состоянии) на воздухе с образованием оксида, обладающего сильным неприятным запахом, является осмий (отсюда и произошло название этого элемента: греч. "osmё" – запах):
Os + 2O2 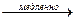 OsO4.
OsO4.
Самым «неблагородным» среди платиновых металлов является палладий – он довольно легко растворяется в концентрированной азотной кислоте:
Pd + 4HNO3 конц. ® Pd(NO3)2 + 2NO2 + 2H2O.
В царской водке среди оставшихся платиновых металлов растворяется лишь платина:
3Pt + 4HNO3 конц. + 18HCl конц. ® 3H2[PtCl6] + 4NO + 8H2O.
3. Ежегодное мировое потребление платиновых металлов составляет более 200 т. Основное использование платиновых металлов связано с их высокой каталитической активностью во многих реакциях. Приведем некоторые примеры.
- Реакции окисления:
2CO + O2  2CO2 (один из процессов каталитического дожигания выхлопных газов);
2CO2 (один из процессов каталитического дожигания выхлопных газов);
4NH3 + 5O2 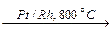 4NO + 6H2O (важнейшая стадия в производстве HNO3);
4NO + 6H2O (важнейшая стадия в производстве HNO3);
2C2H4 + O2 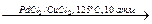 2CH3CHO («Вакер-процесс»).
2CH3CHO («Вакер-процесс»).
- Реакции гидрирования:
R-CºC-R¢ + H2 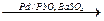 цис- R-CH=CH-R¢ (катализатор Линдлара)
цис- R-CH=CH-R¢ (катализатор Линдлара)
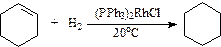 (катализатор Уилкинсона)
(катализатор Уилкинсона)
- Реакции дегидрирования (в том числе, каталитический риформинг нефти):
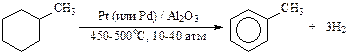 .
.
- Реакции карбонилирования:
CH3OH + CO 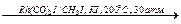 CH3COOH («Монсанто-процесс»);
CH3COOH («Монсанто-процесс»);
CH3COOH + CO 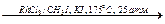 (CH3CO)2O (получение уксусного ангидрида).
(CH3CO)2O (получение уксусного ангидрида).
4. При внимательном прочтении адреса Интернет‑ресурса www.rusolimp.ru можно найти, что в его названии дважды встречается символ элемента Ru – рутения, названного от лат. "Ruthenia" – Русь (Россия). Даже если внимательное прочтение указанного написания ссылки не натолкнуло на мысль о рутении, этот элемент можно найти из количественных данных, приведенных в условии задачи. Руководствуясь данными о содержании элементов в соли А найдем ее формулу. 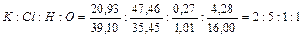 , т. е. формулу соли А можно записать в виде K2 M nCl5OH. Зная содержание металла М, можно найти его атомную массу:
, т. е. формулу соли А можно записать в виде K2 M nCl5OH. Зная содержание металла М, можно найти его атомную массу: 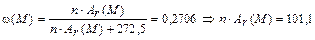 ; при n = 1 получаем единственный разумный вариант металла М – рутений (Ar = 101,1 а. е. м.).
; при n = 1 получаем единственный разумный вариант металла М – рутений (Ar = 101,1 а. е. м.).
5. Восстановление соли А в атмосфере протекает согласно уравнению реакции:
K2RuCl5OH + 2H2 ® 2KCl + Ru + 3HCl + H2O.
Пусть молекулярная масса соли А равна Ar (Ru) + 272,5, где Ar (Ru) – атомная масса рутения, полученная по данным Клауса. При восстановлении (Ar (Ru) + 272,5) г соли А образуется Ar (Ru) г металлического рутения. Используя приведенные в условии данные, найдем соответствующие значения атомной массы рутения.
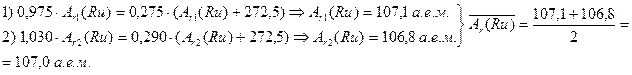
По отношению к современному значению атомной массы рутения (101,1 а. е. м.) относительная ошибка определения составляет 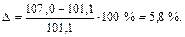
6. Найдем молекулярные формулы соединений I – IV и А. Заметим, что соединение Б содержит в своем составе 4 элемента, а соединения I – IV – по 5 элементов. Анализируя схему получения I – IV, можно предположить, что пятым элементом, входящим в их состав, является кислород.
Б –  , т. е. RuN6H18Cl2.
, т. е. RuN6H18Cl2.
I – 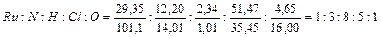 , т. е. RuN3H8Cl5O.
, т. е. RuN3H8Cl5O.
II – 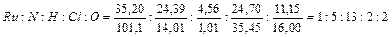 , т. е. RuN5H13Cl2O2.
, т. е. RuN5H13Cl2O2.
III – 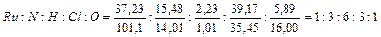 , т. е. RuN3H6Cl3O.
, т. е. RuN3H6Cl3O.
IV – 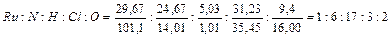 , т. е. RuN6H17Cl3O2.
, т. е. RuN6H17Cl3O2.
Воспользовавшись ранее проведенными расчетами молекулярной формулы соли А и учитывая координационное число рутения 6, запишем координационную формулу этого соединения – K2[Ru(OH)Cl5] (по современным данным, K4[Ru2OCl10] × H2O).
Поскольку Б образуется при взаимодействии «трихлорида М» с водным раствором аммиака, можно предположить, что Б – амминокомплекс рутения – [Ru(NH3)6]Cl2 (хлорид гексаамминрутения(II)).
2RuCl3 + Zn + 16NH3 водн. ® 2[Ru(NH3)6]Cl2 + [Zn(NH3)4]Cl2
Соединения I – IV являются представителями нитрозокомплексов рутения, т. е. во внутренней сфере этих соединений в качестве одного из лигандов выступает NO. Учитывая схемы получения этих соединений, можно записать их координационные формулы.
Соединение I образуется при взаимодействии солянокислого раствора RuCl3 с нитритом натрия с последующим осаждением из реакционного раствора хлоридом аммония. Руководствуясь полученной ранее брутто-формулой этого соединения, можно заметить, что в его состав входит два иона аммония (во внешней сфере), тогда во внутренней сфере помимо фрагмента (RuNO)3+ содержится еще пять координированных к рутению хлорид-ионов, т. е. I – (NH4)2[Ru(NO)Cl5] (пентахлоронитрозорутенат аммония).
1) RuCl3 + 2NaNO2 + 2HCl ® Na2[Ru(NO)Cl5] + NO2 + H2O
2) Na2[Ru(NO)Cl5] + 2NH4Cl ® (NH4)2[Ru(NO)Cl5] + 2NaCl
Для получения II раствор пентахлоронитрозорутената аммония обрабатывают карбонатом аммония при нагревании. Карбонат аммония неустойчив к нагреванию, при температурах выше 60 °С он разлагается в растворе с образованием аммиака. В состав соединения II входит пять атомов азота, один из которых приходится на координированную частицу NO+. Можно предположить, что остальные четыре атома азота входят в состав II в виде четырех координированных молекул NH3 (получаем Ru(NO)(NH3)4OHCl2). В условии оговорено, что во внешней сфере II содержатся только хлорид-ионы, тогда шестую позицию в октаэдре комплексной частицы занимает гидроксид-ион, а координационную формулу II следует записать в виде [Ru(NO)(NH3)4(OH)]Cl2.
2(NH4)2[Ru(NO)Cl5] + 5(NH4)2CO3 ® 2[Ru(NO)(NH3)4(OH)]Cl2 + 5CO2 + 6NH4Cl + 3H2O
Запишем координационную формулу соединения III. После того, как мы выделим в составе II фрагмент Ru(NO), останется фрагмент N2H6Cl3. Заметим, что «N2H6» – это две молекулы NH3, тогда с учетом координационного числа центрального атома 6, формулу II можно представить в виде [Ru(NO)(NH3)2Cl3]. Этот нейтральный комплекс образуется при термическом разложении твердого пентахлоронитрозорутената аммония, т. е. внешнесферные катионы аммония являются источником аммиака, который замещает два хлорид-иона во внутренней сфере исходного (NH4)2[Ru(NO)Cl5].
(NH4)2[Ru(NO)Cl5] 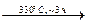 [Ru(NO)(NH3)2Cl3] + 2HCl
[Ru(NO)(NH3)2Cl3] + 2HCl
Соединение IV согласно условию представляет собой моногидрат, т. е. помимо фрагмента Ru(NO) и одной молекулы кристаллизационной воды, в составе IV остается фрагмент N5H15Cl3. Учитывая, что это соединение получено в результате взаимодействия гексаамминокомплекса рутения(II) можно предположить, что фрагмент «N5H15» – это пять молекул NH3, т. е. координационная формула IV – [Ru(NO)(NH3)5]Cl3 × H2O (моногидрат хлорида пентаамминнитрозорутения(II)).
[Ru(NH3)6]Cl2 + 2NaNO2 + 3HCl ® [Ru(NO)(NH3)5]Cl3 × H2O + 2NaCl + N2 + 2H2O
7. Поскольку в спектре ЯМР 14N раствора II ([Ru(NO)(NH3)4(OH)]Cl2) присутствует два сигнала, следовательно в II содержится два типа атомов азота. Соотношение интенсивностей сигналов нам подсказывает, что один сигнал от атома азота нитрозогруппы, а второй – от четырех эквивалентных молекул аммиака, расположенных в квадрате октаэдрического комплекса. Таким образом, II – хлорид транс‑ гидроксотетраамминнитрозорутения(II).
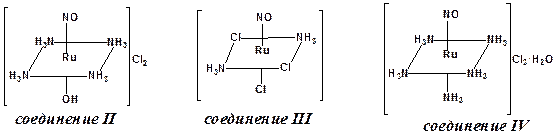
В спектре ЯМР 14N раствора IV присутствуют три сигнала: один – от атома азота нитрозогруппы, другой – от атома азота молекулы NH3, находящейся в транс- положении к нитрозогруппе, третий – от атомов азота четырех молекул NH3, находящихся в квадрате октаэдра. Соотношение интенсивностей этих сигналов – 1: 1: 4, соответственно.
Система оценивания:
1. Название семейства элементов – 1 балл.
2. Уравнения реакций с участием перечисленных металлов – 1 балл ´ 3 = 3 балла.
3. Уравнения двух различных промышленно важных реакций – 1 балл ´ 2 = 2 балла.
4. Элемент (металл М) и происхождение его названия – 1 балл ´ 2 = 2 балла.
5. Расчет атомной массы металла М и относительной погрешности – 1 балл ´ 2 = 2 балла.
6. Координационные формулы I – IV, А и Б – 1 балл ´ 6 = 6 баллов;
Уравнения реакций, приведенных на схеме – 1 балл ´ 5 = 5 баллов.
7. Структурные формулы соединений II и III – 1 балл ´ 2 = 2 балла;
Число сигналов и соотношение интенсивностей в спектре ЯМР 14N – 1 балл ´ 2 = 2 балла.
Итого – 25 баллов.
Задача 3 (авторы Никитин С. В., Емельянов В. А.)
1. Структурные формулы и названия исходных соединений:
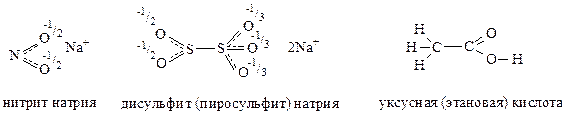
(принимать за верные также формулы без указанной делокализации связей)
Cинее окрашивание с крахмалом дает иод, образующийся в реакции:
2NaNO2 + 2KI + 4CH3COOH → I2 + 2NO + 2CH3COONa + 2CH3COOK + 2H2O.
2. Поскольку вещества В и Г являются побочными продуктами синтеза и могут образовываться в реакциях щелочного раствора перманганата калия как с NaNO2, так и с Na2S2O5, следовательно, это продукты восстановления KMnO4. Зеленый цвет раствору придают манганат-ионы (K2MnO4 – соединение В), коричневый осадок – MnO2 (соединение Г).
Уравнения реакций щелочного раствора перманганата калия с NaNO2 и с Na2S2O5:
2KMnO4 + 4KOH + NaNO2 → 2K2MnO4 + NaNO3 + 2H2O;
2KMnO4 + 3NaNO2 + H2O → 2MnO2¯ + 3NaNO3 + 2KOH;
4KMnO4 + 6KOH + Na2S2O5 → 4K2MnO4 + Na2SO4 + K2SO4 + 3H2O;
4KMnO4 + 3Na2S2O5 + 2KOH → 4MnO2¯ + 3Na2SO4 + 3K2SO4 + H2O.
3. Из данных по содержанию элементов в соединении А посчитаем соотношение N: O = 5,22/14: 41,74/16 = 1: 7. Молярная масса А в расчете на один атом азота получается 14/0,0522 = 268 г/моль. Название соли Фреми (нитрозодисульфонат калия) подсказывает нам, что в ее состав еще входят сера (скорее всего, 2 атома на одну нитрозогруппу) и калий. За вычетом массы атома азота, семи атомов кислорода и двух атомов серы у нас остается 268 – 14 – 7∙16 – 2∙32 = 78 г/моль, что почти в точности соответствует двум атомам калия. Итак, состав А K2S2O7N или (KSO3)2NO или K2NO(SO3)2, что более точно согласуется с названием.
Соль Фреми осаждается из сине-фиолетового раствора при добавлении насыщенного раствора KСl, хлора не содержит, а при растворении дает опять же сине-фиолетовый раствор. Эти факты наводят нас на мысль о том, что последняя стадия синтеза по сути есть замещение ионов Na+ в соединении Д на ионы К+. К тому же выводу можно прийти, рассчитав в соединении Д соотношение N: O = 5,93/14: 47,43/16 = 1: 7 и его молярную массу 14/0,0593 = 236. После вычета массы атома азота, семи атомов кислорода и двух атомов серы у нас остается 236 – 14 – 7·16 – 2·32 = 46 г/моль, что отвечает двум атомам натрия. То есть, состав Д (NaSO3)2NO или Na2NO(SO3)2.
Cоединения Д и Б имеют очень близкие содержания азота и кислорода, но Б еще содержит и водород. Отношение N: O: Н =5,91/14: 47,23/16: 0,422:1 = 1: 7: 1, молярная масса Б 14/0,0591 = 237 г/моль, что ровно на единицу больше, чем у Д. Таким образом, состав Б (NaSO3)2NOН или Na2(SO3)2NOН.
4. Уравнения реакций, происходящих при строгом соблюдении методики:
а) NaNO2 + Na2S2O5 + CH3COОH → (NaSO3)2NOH + CH3COОNa + H2O;
б) 3(NaSO3)2NOH + KMnO4 → 3(NaSO3)2NO·+ KOH + MnO2¯ + H2O;
в) (NaSO3)2NO·+ KCl → NaCl + (KSO3)2NO↓.
|
|
|
|
|
Дата добавления: 2015-06-28; Просмотров: 597; Нарушение авторских прав?; Мы поможем в написании вашей работы!