
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Органическая химия
|
|
|
|
5.

(принимать за верные также формулы без указанной делокализации связей)
6. Плотность по водороду, равная 14, отвечает средней молярной массе 14·2 = 28 г/моль, что слишком похоже на азот, который действительно выделяется из неустойчивого водного раствора соли Фреми:
2(KSO3)2NO·+ 2H2O → 2K2SO4 + 2Н2SO4 + N2.
Плотность 23,5 отвечает молярной массе 23,5·2 = 47 г/моль, что означает присутствие в газовой смеси довольно тяжелого газа, очевидно, содержащего серу (для SO2 64 г/моль). В этом случае в смеси должен быть и более легкий газ, причем твердым остатком, скорее всего, является устойчивый сульфат калия. Если вычесть из формулы исходного соединения фрагменты SO2 и K2SO4, остается NO, эквимолярное соотношение которого с SO2 как раз и дает (64 + 30)/2 = 47 г/моль:
(KSO3)2NO·→ K2SO4 + NO + SO2.
7. Безусловно, водный раствор соединения Б не будет окислять иодид калия, иначе мы не смогли бы проверить наличие избытка NaNO2 на первой стадии синтеза. А вот соединение А, являющееся «универсальным одноэлектронным окислителем», конечно же, будет вступать в эту реакцию, причем в ходе его одноэлектронного восстановления как раз и получается калиевая соль аниона Б:
2(KSO3)2NO·+ 2KI + H2O → 2(KSO3)2NOH + 2KOH + I2.
Система оценивания:
1. Три вещества (названия + структурные формулы) по 1б, уравнение реакции 1б 4 балла;
2. Вещества В и Г по 1б, 4 уравнения реакций по 1б 6баллов;
3. Состав соединений А, Б, Д (без строения) по 1 б, 3 уравнения реакций по 1б 3 балла;
4. Три уравнения реакций по 1б 3 балла;
5. Две структурные формулы и строение в твердой фазе по 1б 3 балла;
6. Два газовых состава при верном соответствии по 1б, 2 уравнения реакций по 1 4 балла;
7. Два верных ответа с аргументами по 1б 2 балла.
Итого – 25 баллов
Задача 4 (автор Медведев Ю. Н.).
1. Малорастворимы сульфат, тиосульфат и сульфит бария, причем сульфит и тиосульфат бария растворяется лишь при значительном подкислении (рН < 2). Тогда осадки сульфата бария могут образоваться при сливании растворов:
KHSO4 + Ba(NO3)2 = BaSO4¯ + KNO3 + HNO3
K2S2O7 + H2O + 2Ba(NO3)2 = 2BaSO4¯ + 2KNO3 + 2HNO3
K2S2O3 + BaCl2 = BaS2O3↓ + 2KCl
Т. к. при растворении в воде происходит быстрая реакция гидролиза пиросульфат-иона:
K2S2O7 + H2O = 2KHSO4
Сульфит бария будет выпадать из растворов среднего сульфита калия и метабисульфита (кислого сульфита) калия:
K2SO3 + Ba(NO3)2 = BaSO3¯ + 2KNO3
K2S2O5 + Ba(NO3)2 + (H2O) = BaSO3¯ + 2KNO3 + SO2 + (H2O)
После продолжительного стояния осадки сульфата бария будут образовываться и из раствора персульфата (пероксодисульфата) калия и пероксосульфата (соли кислоты Каро):
K2S2O8 + 2H2O = 2KHSO4 + H2O2
K2SO5 + H2O = K2SO4 + H2O2
При стоянии на воздухе дитионит, сульфит и метабисульфит будут окисляться на воздухе:
2K2S2O4 + 3O2 + 2H2O → 4KHSO4
2K2SO3 + O2 → 2K2SO4
K2S2O5 + O2 +H2O → 2KHSO4
2. Кислые соли (KHSO4, K2S2O7, K2S2O5) будут иметь кислую среду:
HSO4– + H2O ⇄ SO42– + H3O+
При растворении в воде пиросульфат превращается в гидросульфат и дает такую же кислотность раствора:
S2O72– + H2O ⇄ 2HSO4–
Для оценки рН растворов можно использовать оценочное значение констант диссоциации соответствующих кислот. Напомним, что согласно правилам Полинга, сила кислоты зависит от числа концевых атомов кислорода. При отсутствии концевых атомов кислорода кислота будет слабой и иметь константу примерно равную 10–7, например, хлорноватистая кислота. С увеличением числа концевых атомов кислорода на единицу сила кислоты возрастает на пять порядков:

Kдисс возрастает, сила кислот возрастает
Заметим, что в гидросульфат-ионе содержится два концевых атома кислорода, но электронный эффект одного из них компенсирован атомом кислорода, несущим отрицательный заряд.
Так, константа диссоциации серной кислоты по второй стадии составит 10–2: HSO4– – одноосновная кислота с одним концевым атомом кислорода. Для определения концентрации ионов водорода запишем выражение для константы, где [ H +] = x,
[ HSO 4–] = 0,1 – x:
KII = [ H +]2/[ HSO 4–] = x 2/(0,1 – x) = 10–2
x = 0,027
Полученный при растворении гидросульфата раствор будет иметь рН = –lg 0,027 = 1,57. Раствор, полученный растворением пиросульфата калия (2 M KHSO4), будет иметь меньшее значение рН: рН = –lg 0,04 = 1,4.
Соли, образованные слабыми кислотами (сернистой кислотой по второй стадии, кислота Каро по второй стадии, тиосерной по второй стадии) будут иметь щелочную среду раствора:
SO32– + H2O ⇄ HSO3– + OH–
SO52– + H2O ⇄ SO5H– + OH–
S2O32– + H2O ⇄ HS2O3– + OH–
В обоих случаях оценочное значение второй константы диссоциации составляет 10–7.
Kгидр = 10–14/10–7 = [OH]2/[HA] = 10–7; [OH] = 10–4; pOH = 4
pH = 14 – pOH = 10
В растворе метабисульфита в равновесии находятся ионы:
S2O52– + H2O ⇄ 2HSO3–
(по своему составу ион HSO3– – одноосновная кислота без концевых атомов кислорода – слабая кислота с рК» 7). Полученный раствор может иметь слабокислую среду (рН» 3,85).
При длительном стоянии водных растворов K2S2O8, K2SO5 протекает полный гидролиз аниона:
K2S2O8 + 2H2O = 2KHSO4 + H2O2
(рН такого раствора, как и в случае K2S2O7, будет несколько меньше 2).
K2SO5 + H2O = K2SO4 + H2O2
(Получается нейтральный раствор).
Как было сказано выше, при стоянии на воздухе растворы дитионита, сульфита и метабисульфита калия окисляются кислородом воздуха:
2K2S2O4 + 3O2 + 2H2O → 4KHSO4 (рН раствора меньше 2)
2K2SO3 + O2 = 2K2SO4 (нейтральный раствор)
K2S2O5 + H2O + O2 = 2KHSO4 (рН раствора меньше 2).
3. Соединения со связью S – S:
K2S2O3, K2S2O4, K2S2O5, K2S2O6, K2S4O6.
Соединения со связью O – O:
K2SO5, K2S2O8.
4. Окислителями в реакции с иоидид-ионом будут растворы персульфат-иона (до гидролиза и после гидролиза) и соль кислоты Каро:
S2O82– +2I– = 2SO42– + I2 (до гидролиза)
H2O2 + 2I– + 2H+ = I2 + 2H2O (после гидролиза)
SO52– + 2I– + 2H+ = SO42– + I2 + H2O
Восстановителями в реакциях с перманганат-ионом будут низшие соединения серы: сульфит, метабисульфит, дитионит, тиосульфат, дитионат, тетратионат и пероксид водорода, образующийся при гидролизе персульфат-иона и соли кислоты Каро:
5SO32– + 2MnO4– + 6H+ = 5SO42– +2Mn2+ + 3H2O
5S2O42– + 6MnO4– + 8H+ = 10SO42– + 6Mn2+ + 4H2O
5S2O52– + 4MnO4– + 2H+ = 10SO42– + 4Mn2+ + H2O
2MnO4– + 5H2O2 + 6H+ = 2Mn2+ + 5O2 + 8H2O
5S2O32– + 8MnO4– + 14H+ = 10SO42– + 8Mn2+ + 7H2O
5S2O62– + 2MnO4– + 2H2O = 10SO42– + 2Mn2+ + 4H+
5S4O62–+ 2MnO4– + 2H2O = 10SO42– + 10S + 2Mn2+
Система оценивания.
1. а) по 0,5 б. за 5 веществ, всего 2,5 балла.
б) по 0,5 б. за 3 вещества, 1,5 балла.
уравнения реакций 2,5 балла.
2. По 1 б. за каждую оценку рН, всего 9 баллов
3. а) по 0,5 б. за 5 веществ, 2,5 балла.
б) по 0,5 б. за 2 вещества, 1 балл.
4. а) 2 балла, если указано 2 и более реакции 2 балла
б) 4 балла, если указано 4 и более реакции 4 балла
Итого – 25 баллов
Задача 5 (автор Антонов А. А.)
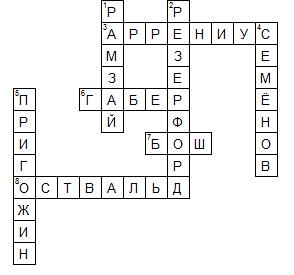
 По горизонтали:
По горизонтали:
3. Сванте Август Аррениус (швед. Svante August Arrhenius; 19 февраля 1859, имение Вейк, недалеко от Уппсалы — 2 октября 1927, Стокгольм) — выдающийся шведский физико-химик, лауреат Нобелевской премии по химии (1903).
Дополнительные вопросы:
а) H3PO2 ⇄ H2PO2– + H+
NaClO2 = Na+ + ClO2–
б) Сульфат бария является нерастворимой солью, значит, в насыщенном растворе сульфата бария будет мало носителей заряда, и раствор практически не будет проводить электрический ток. Перхлорат натрия в воде растворим, при его диссоциации образуются ионы натрия и перхлорат-ионы, которые являются носителями заряда, следовательно, этот раствор будет проводить электрический ток.
 6. Фриц Габер (нем. Fritz Haber, 9 декабря 1868, Бреслау — 29 января 1934, Базель) — немецкий химик, лауреат Нобелевской премии по химии (В 1919 году за 1918 год).
6. Фриц Габер (нем. Fritz Haber, 9 декабря 1868, Бреслау — 29 января 1934, Базель) — немецкий химик, лауреат Нобелевской премии по химии (В 1919 году за 1918 год).
Дополнительные вопросы:
а) N2 + 3H2→ 2NH3
б) Например, с использованием лития (вместо лития можно использовать магний):
6Li + N2→2Li3N
Li3N + 3H2O →3LiOH + NH3
в) Необходимый водород получают конверсией метана, либо газификацией угля:
CH4 + H2O  CO + 3H2
CO + 3H2
C + H2O 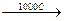 CO + H2
CO + H2
CO + H2O 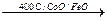 CO2 + H2
CO2 + H2
г) Габер участвовал в разработке и подготовке к использованию первого химического оружия, примененного во время Первой мировой войны. Жена Фрица Габера была категорически против работ по получению химического оружия, и 15 мая 1915 г. она застрелилась после первого применения хлора 22 апреля 1915 г.
 7. Карл Бош (нем. Carl Bosch, 27 августа 1874, Кельн — 26 апреля 1940, Гейдельберг) — немецкий химик.
7. Карл Бош (нем. Carl Bosch, 27 августа 1874, Кельн — 26 апреля 1940, Гейдельберг) — немецкий химик.
Дополнительные вопросы:
а) Нитраты (калия, натрия, аммония) являются составной частью взрывчатых веществ и пороха, а т. к. в Германии практически не было селитряных месторождений, то нитраты необходимо было получать искусственно.
б) Сейчас азот фиксируют для получения удобрений и взрывчатых веществ.
в) В Германии также нет запасов углеводородов, необходимых для получения топлива для техники. При взрывах реакции идут при высоком давлении и высокой температуре и в результате образуются углеводороды:
С + H2O → CO + H2
 nCO + (2n+m)/2H2→CnHm + nH2O
nCO + (2n+m)/2H2→CnHm + nH2O
8. Вильгельм Фридрих Оствальд (нем. Wilhelm Friedrich Ostwald, латыш. Vilhelms Ostvalds; 2 сентября 1853, Рига, Российская империя — 4 апреля 1932, Лейпциг, Германия) — физико-химик и философ-идеалист, лауреат Нобелевской премии по химии 1909 года.
Дополнительные вопросы:
а) 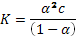 – закон разбавления Оствальда (где a – степень диссоциации, с – концентрация кислоты). Решая квадратное уравнение при концентрации 0,1 М, получаем a = 0,013. При разбавлении в 2 раза (т. е. при концентрации 0,05 М) получаем a = 0,019. Т. е. степень диссоциации увеличится в 1,5 раза.
– закон разбавления Оствальда (где a – степень диссоциации, с – концентрация кислоты). Решая квадратное уравнение при концентрации 0,1 М, получаем a = 0,013. При разбавлении в 2 раза (т. е. при концентрации 0,05 М) получаем a = 0,019. Т. е. степень диссоциации увеличится в 1,5 раза.
б) В идеальном газе предполагается отсутствие сил притяжения и отталкивания между частицами. В идеальном растворе силы межмолекулярного взаимодействия между частицамирастворителя и растворенного вещества равны. Т. е. в идеальном газе межмолекулярные взаимодействия не учитываются, а в идеальном растворе учитываются.
По вертикали:
 1. Сэр Уильям Рамзай (англ. Sir William Ramsay; 2 октября 1852, Глазго — 23 июля 1916, Хай-Уиком) — английский химик, лауреат Нобелевской премии по химии 1904 года.
1. Сэр Уильям Рамзай (англ. Sir William Ramsay; 2 октября 1852, Глазго — 23 июля 1916, Хай-Уиком) — английский химик, лауреат Нобелевской премии по химии 1904 года.
Дополнительные вопросы:
а) KBrO3 + XeF2 + 2KOH → KBrO4 + Xe + 2KF +H2O
б) Найдем молярную массу газовой смеси:
 (г/моль), далее допустим, что мольная доля криптона равна x, тогда получим уравнение 84 x + 44(1 – x) = 64, решая его, получаем, что мольная доля криптона равна 50 %. Тогда массовая доля криптона в смеси будет равна w = 0,5∙84 / 64=0,66.
(г/моль), далее допустим, что мольная доля криптона равна x, тогда получим уравнение 84 x + 44(1 – x) = 64, решая его, получаем, что мольная доля криптона равна 50 %. Тогда массовая доля криптона в смеси будет равна w = 0,5∙84 / 64=0,66.
 2. Эрнест Резерфорд (англ. Ernest Rutherford; 30 августа 1871, Спринг Грув — 19 октября 1937, Кембридж) — британский физик новозеландского происхождения. Лауреат Нобелевской премии по химии 1908 г.
2. Эрнест Резерфорд (англ. Ernest Rutherford; 30 августа 1871, Спринг Грув — 19 октября 1937, Кембридж) — британский физик новозеландского происхождения. Лауреат Нобелевской премии по химии 1908 г.
Дополнительные вопросы:
а) Уменьшение массового числа может происходить только из-за α-распадов. При каждом α-распаде массовое число уменьшается на 4. Тогда количество α-распадов в ряду – (238 – 206)/4 = 8. При каждом α-распаде количество протонов в ядре уменьшается на 2. Если не происходило ни одного b-распада, то в ядре осталось бы 92 – 8∙2 = 76 протона. Однако в ядре свинца 82 протона, значит, в ряду произошло 6 β-распадов.
Определим константу распада для урана-235 и урана-238:
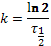 , тогда k 238=1,55 ∙ 10–10лет, k 235=9,85 ∙ 10–10лет.
, тогда k 238=1,55 ∙ 10–10лет, k 235=9,85 ∙ 10–10лет.
Далее имеем:
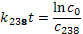

Соответственно с 0 – начальная концентрация 238Uи 235U, t – время, прошедшее с момента образования Земли.
Далее имеем:

Решая эту систему уравнений, получаем

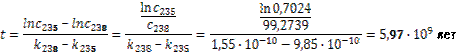
4. Николай Николаевич Семёнов (3 (15 апреля) 1896, Саратов — 25 сентября 1986, Москва) — советский физико-химик, один из основоположников химической физики, академик АН СССР (1932; член-корреспондент с 1929), единственный советский лауреат Нобелевской премии по химии (получил в 1956 году совместно с Сирилом Хиншелвудом).
 5. Илья Романович Пригожин (фр. Ilya Prigogine; 25 января 1917, Москва, Российская империя — 28 мая 2003 Остин, Техас, США) — бельгийский и американский физик и химик российского происхождения, лауреат Нобелевской премии по химии 1977 года.
5. Илья Романович Пригожин (фр. Ilya Prigogine; 25 января 1917, Москва, Российская империя — 28 мая 2003 Остин, Техас, США) — бельгийский и американский физик и химик российского происхождения, лауреат Нобелевской премии по химии 1977 года.
Система оценивания:
1. По 1 б. за каждого ученого – всего 8 баллов
2. Дополнительные вопросы:
1а. 1 б. за верную реакцию
1б. 1 б. за массовую долю криптона.
2а. по 0,5 б. за количество a- и β-распадов = 1 б.
2б. 2 б. за определение возраста Земли
3а. по 0,5 б. за каждое вещество = 1 б.
3б. по 0,5 б. за каждое вещество = 1 б.
6а. 1 б. за реакцию
6б. 1 б. за получение аммиака из неорганических соединений
6в. 1 б. за получение водорода (0,5 б. за некрупнотоннажный синтез)
6г. 1 б. за предположение о химическом оружии
7а. 1 б. за важность азота для Германии
7б. 1 б. за связывание азота в наши дни
7в. 1 б. за получение топлива
8а. 2 б. за изменение степени диссоциации
8б. 1 б. за идеальный газ и раствор.
Итого 25 балов
Задача 1 (автор Трушков И. В.)
1. Если соединение D содержит один атом азота, МD = 14/0,378 = 37. Соединение с такой молекулярной массой образоваться не может. Если D содержит два атом азота, МD = 74. Этой массе отвечает соединение состава С2Н6N2O. Тогда мы можем написать, что происходило в колбах.
Колба С.
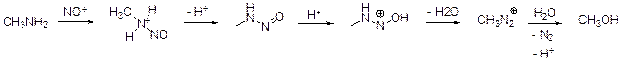
Уравнение реакции: CH3NH2 + NaNO2 + HCl = CH3OH + N2 + NaCl + H2O
Поскольку продуктами реакции являются метанол и вода, в водно-метанольном растворе их обнаружить невозможно. А присутствие ионов Na+ и Cl– не говорит о том, что прошла какая-то реакция, т. к. эти ионы находились в добавленных растворах.
Колба В. Реакция останавливается на стадии образования N -нитрозопроизводного D.
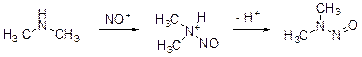
Уравнение реакции: (CH3)2NH + NaNO2 + HCl = (CH3)2NNO + NaCl + H2O
Колба А Третичные амины не реагируют с катионом нитрозония. (Его взаимодействие с неподеленной парой электронов на атоме азота амина является обратимым процессом). Однако со временем часть такого катиона отщепляет HNO. В результате получается иминиевая соль, которая гидролизуется в условиях реакции с образованием диметиламина и формальдегида (Е). Диметиламин далее превращается в D так, как это происходит в колбе B.
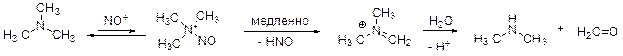
Уравнение реакции:
(CH3)3N + 2NaNO2 + 2HCl = (CH3)2NNO + CH2O + 2NaCl + HNO + H2O
2. Этиловый эфир глицина содержит 4 атома углерода. Если все эти атомы присутствуют в продукте, то М F = 48/0,421 = 114. При этом в молекуле присутствуют также 2 атома кислорода и не менее 5 атомов водорода. На остальные атомы остается 29 а. е. м. Единственный вариант – два атома азота и один атом водорода, т. е. продуктом является диазоуксусный эфир, N2CHCO2C2H5.
3. Анилин реагирует качественно аналогично метиламину, однако образующаяся соль диазония относительно устойчива ввиду высокой нестабильности фенильного катиона, который должен образоваться из нее в ходе реакции SN1. Таким образом, G – PhN2+Cl–. Со временем эта соль все же распадается, при этом в качестве нуклеофилов, взаимодействующих с фенильным катионом, могут выступать как вода, так и метанол. Продуктами будут, соответственно, фенол H, умеренно растворимый в водном метаноле и хорошо растворимый в присутствии щелочи, и анизол (PhOMe) I. Содержание углерода в I равно 77,8%. Тогда содержание углерода в J будет либо 63,5%, либо 92,3%. Второй вариант согласуется с углеводородом состава (СН)n. Очевидно, в данном случае это – бензол. Поскольку J образуется в эквимолярных количествах с Е (т. е. с формальдегидом), этот результат можно объяснить переносом гидрид-иона от спирта к фенильному катиону. Такой процесс восстановления солей диазония эффективно протекает с изопропиловым спиртом, умеренно – с этиловым спиртом и в небольшом количестве – со спиртом метиловым.
4. При добавлении щелочи к соли диазония сначала происходит образование ковалентно-связанного продукта Ph–N=N–OH, который легко депротонируется с образованием Ph–N=N–O–Na+. Это – соединение К. При подкислении оно превращается обратно в соль диазония. При добавлении к соли диазония анилина первичная атака происходит по атому азота анилина. Продуктом реакции является триазин PhNH–N=N–Ph (L), который можно выделить и хранить и который при подкислении снова образует соль диазония. С другой стороны, анилин может реагировать с солью диазония по реакции азосочетания с образованием продуктов электрофильного ароматического замещения в пара - или орто -положение. Вследствие стерических затруднений атака протекает в основном в пара -положение. Таким образом,
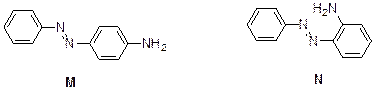
5. Первичный продукт реакции – N -нитрозо- N -метиланилин. При нагревании он перегруппировывается в 4-нитрозо- N -метиланилин, о чем свидетельствует характеристичный сигнал ароматических протонов в виде дублета дублетов.
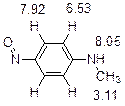
Система оценивания:
1. Объяснение процессов, протекающих в каждой колбе и уравнения реакций: 3´2 балла. Всего 6 баллов.
2. 2 балла
3. 4 структуры по 1.5 балла. Всего 6 баллов.
4. 4 структуры по 2 балла. Всего 8 баллов.
5. 3 балла (2 за структуры, 1 за отнесение)
Итого 25 баллов
Задача 2 (авторы Карлов Д. С., Трушков И. В.)
1. Даже по названию «циангидрин» можно догадаться, что А содержит цианогруппу и гидроксигруппу. Это соединение образуется в результате присоединения цианид-иона к несущему частичный положительный заряд карбонильному атому углерода с последующим протонированием атома кислорода. Гидролиз цианогруппы приводит к образованию молочной кислоты, CH3CH(OH)COOH. Нагревание А с оксидом алюминия приводит к отщеплению воды с образованием акрилонитрила В, CH2=CHCN. Полимеризация В дает широкоизвестный полимер полиакрилонитрил (ПАН).
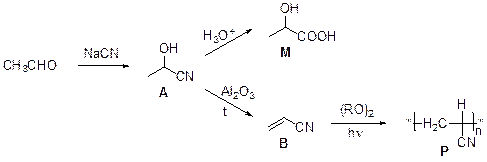
2. По элементному составу С можно определить его молекулярную формулу как (С7Н6О)n, что соответствует формуле бензальдегида. В реакции С с гидридом натрия выделяется водород вследствие наличия в С одного или нескольких атомов водорода, проявляющих достаточно высокую кислотность. Таких атомов в бензальдегиде нет. Если в С такой атом один, М С = 232. Тогда формула С – С14Н12О2. Если таких атомов два, М С = 464 и т. д. Образование из С бензальдегида при действии периодата натрия говорит о том, что С образован фрагментами типа С6H5–CH(OH)–CH(OH)–С6H5 и аналогами, где группа СН(ОН) заменена на С=О. Таким образом, С имеет формулу С6H5–C(O)–CH(OH)–С6H5. Это соединение имеет тривиальное название бензоин, а саму реакцию называют бензоиновой конденсацией.
3. Молекулярная масса D равна 29,666n, где n – число атомов углерода. Отсюда значение n должно быть кратно трем. Наиболее логично предположить, что структура D аналогична структуре циангидрина (т. е. n = 3, M D = 89), но вместо гидроксигруппы присутствует аминогруппа. Иначе говоря, D – 2-аминопропановая кислота, или аланин (одна из важнейших аминокислот). В сильнокислой среде аланин существует в полностью протонированной форме; в сильнощелочной – в депротонированной; в нейтральной – в цвиттер-ионной.
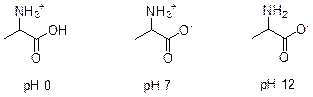
4. Первая стадия – бромирование бензола с образованием PhBr (Е). При взаимодействии Е с магнием образуется соответствующий реактив Гриньяра PhMgBr (F), реакция которого с этиленоксидом с последующей нейтрализацией дает фенэтиловый спирт G, PhCH2CH2OH. Окисление спирта дает фенилуксусный альдегид H (PhCH2CHO). Хорошо известно, что Бранд выделил из сухого остатка мочи фосфор при его прокаливании с белым песком. Впрочем, правильный ответ о соединении I можно получить, не зная этого, а используя только данные по содержанию галогена. Единственный ответ при наличии этих данных – PCl3. При взаимодействии PCl3 с этанолом теоретически возможны две реакции: 1) образование этилхлорида и фосфористой кислоты или ее хлорангидридов; 2) образование HCl и этилового эфира фосфористой кислоты. Первый вариант не согласуется с данными по содержанию Y в соединении J. Во втором случае условие выполняется, если J – диэтиловый эфир фосфористой кислоты, [HOP(OC2H5)2], таутомерной формой которого является [HP(O)(OC2H5)2]. Реакция между бензиламином, фенилуксусным альдегидом Н и диэтилфосфитом J аналогична реакции Штрекера. Она была открыта в середине 20 века М. Кабачником и, независимо от него, Э. Филдсом и носит их имена. При этом два реагента (альдегид и амин) те же, что и в реакции Штрекера, а вместо цианид иона используется диэтилфосфит. Образование циангидрина идет в результате присоединения цианид-иона к альдегиду (кетону), образование аминонитрила в реакции Штрекера можно рассматривать как присоединение цианид-иона к имину, образующемуся из альдегида и амина с отщеплением воды). Соединение К также образуется с отщеплением молекулы воды; следовательно, продукт образуется в результате присоединения диэтилфосфита к имину аналогично присоединению к имину HCN. Так как в условии сказано, что Х содержит связь углерод–фосфор, понятно, что атака J на имин идет именно атомом фосфора. Из содержания фосфора следует, что М К = 347, т. е. единственным побочным продуктом является молекула воды. При этом М Х = 201. Можно предположить, что на последней стадии происходит гидролиз эфира фосфоновой кислоты (потеря массы равна 2´М(С2Н4) = 56 а.е. м.). Тогда на предыдущей стадии происходит потеря массы, равная 90 а. е. м. Это соответствует фрагменту С7Н6, т. е. замене бензильной группы на атом водорода. Это – результат гидрогенолиза связи Bn–N. Итак,

5. Например, аденозинмонофосфат или другие нуклеотиды.

Система оценивания:
1. 3 структуры по 2 балла. Мономерное звено – 1 балл. Всего 7 баллов.
2. 2 балла
3. 3 структуры по 1 баллу. Всего 3 балла.
4. Структуры Е–J по 1 баллу. Структуры K, L, X по 2 балла. Всего 12 баллов.
5. 1 балл
Итого: 25 баллов
Задача 3 (авторы Беркович А. К., Карпушкин Е.)
1. Натуральный каучук представляет из себя полимер изопрена (2-метилбутадиена), поперечные сшивки в его структуре практически отсутствуют, а мономерные звенья соединены между собой 1,4- цис -связями:
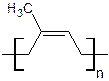
2. При вулканизации бутадиенстирольного каучука на первой стадии происходит распад молекулы пероксида на 2 радикала:

Образовавшийся радикал атакует полимерную молекулу, отрывая водородный атом в a-положении к двойной связи с образованием макрорадикала (символом R обозначены фрагменты полимерной цепи, не участвующие в реакции):

Макрорадикал, в свою очередь, атакует двойную связь в соседней молекуле с образованием поперечной сшивки.

Далее процесс продолжается по цепному механизму, аналогичному радикальной полимеризации.
3. Исходя из названия класса полимера, логично предположить, что его основная цепь построена из фрагментов –Si–O–. Тогда брутто-формулу можно переписать как (SiO(OCH3)2)n, а структура полимера выглядит так:

4. Клеточные стенки растений в основном построены из целлюлозы. Этот полимер относится к классу простых полиэфиров.
5. При повышении pH слабая полиакриловая кислота переходит в солевую форму – полиакрилат натрия. Гидратация даже контактной ионной пары (карбоксилат-натрий) существенно выше, чем у недиссоциированной карбоксильной группы, при образовании сольватно-разделенной ионной пары гидратация возрастает еще сильнее, а вместе с ней и максимальная сорбционная способность. Поэтому при повышении pH от 2–3 до 9–10 сорбционная способность материалов на основе полиакриловой кислоты увеличивается. В сильнощелочной среде сорбционная способность несколько снижается, так как ионы натрия конденсируются на цепях полиэлектролита, и доля контактных ионных пар растет, но практического значения в гигиенических приложениях этот эффект не имеет.
6. Одна из возможных схем расчета: в сутки с пищей и питьем ребенок получает 3·0,8 = 2,4 кг воды, причем 2,4·0,1 = 0,24 кг воды выделяется при дыхании. Итого 2,16 кг воды должно быть поглощено памперсами, то есть каждый подгузник должен поглощать 0,54 кг воды. Тогда масса сухого сорбента в каждом подгузнике должна составлять минимум 0,54/15 = 0,036 кг или 36 г. После поглощения жидкости масса сорбента составит 0,54+0,036 = 0,576 кг, а его влажность будет равна 0,54/0,576 = 93,75%.
7. Наличие в смеси азота указывает на то, что использовались соли аммония. Выделение углекислого газа ограничивает выбор парой карбонат аммония – гидрокарбонат аммония. Пусть мольная доля карбоната равна x, тогда массовая доля азота в смеси равна (14,0067·2· x +14,0067·(1 – x))/(96,09 x + 79,06(1 – x)) = 0,220, откуда x = 0,330, значит, карбонат и гидрокарбонат аммония находились в смеси в мольном соотношении 1:2. При разложении такой смеси солей образуется смесь аммиака, воды и углекислого газа в молярном соотношении 4:3:3. Средняя молярная масса такой смеси составляет 25,42 г/моль. Тогда из уравнения Менделеева-Клапейрона можно рассчитать массу газа. pV = mRT / M, то есть m = pVM / RT. Подставляя известные числовые данные, получим, что масса газов равна 3,67 г. При объеме мячика в 1,766 л плотность газовой смеси составит 2,08 г/л. (Эту же величину можно рассчитать иначе, приведя к давлению 2 атм плотность газовой смеси заданного состава)
8. Полиэтиленовые пакеты практически никогда не прокрашиваются в массе, потому что это приводит к неоправданному расходу красителя. Исключения – пакеты для мусора, в которые добавляется недорогой пигмент (сажа) и специальные упаковки для компьютерных деталей, в которые проводящая добавка (например, графит) вводится для снятия статического электричества и предотвращения порчи микросхем. Красители, наносимые на поверхность полиэтилена, представляют собой, как правило, сильно полярные молекулы, и такие вещества слабо удерживаются на неполярном материале полиэтилена. С целью повышения полярности поверхности и производится обработка полиэтилена кислотами-окислителями, в ходе которой могут происходить различные процессы, основными из которых являются окисление атомов углерода основной цепи до спиртовых или кетонных фрагментов, а также окисление боковых цепей с разрывом C–C связей и образованием карбоксильных групп:

Система оценивания:
1. 1 балл
2. 3 балла за 3 схемы реакций.
3. 1 балл
4. 2 ответа по 1 баллу. Всего 2 балла.
5. 2 балла за увеличение сорбционной способности при защелачивании при наличии аргументации.
6. Максимум 4 балла.
7. 2 балла за определение солей + 2 балла за расчет соотношения + 5 баллов за расчет массы и плотности. Всего 9 баллов.
8. 1 балл за объяснение, по 1 баллу за каждое из направлений. Всего 3 балла
Итого 25 балов
|
|
|
|
|
Дата добавления: 2015-06-28; Просмотров: 1464; Нарушение авторских прав?; Мы поможем в написании вашей работы!