
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Подход «снизу-вверх», т.е. получение нанометровых изделий или материалов методами сборки на атомарном уровне 1 страница
|
|
|
|
Подход «сверху-вниз», т.е. обработка вещества с последовательным уменьшением размеров до требуемых (нанометровых) размеров
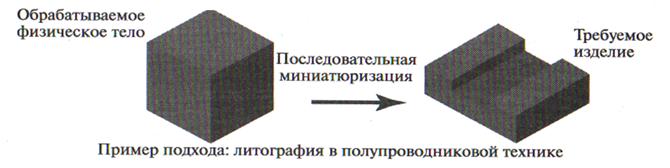
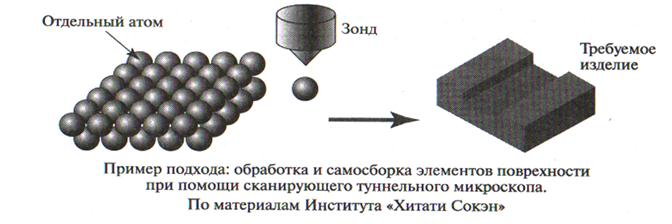
Рис.1 – Две основные технологии получения наноструктур
Согласно этим двум технологиям (рис.1), все способы получения наночастиц и наноструктур можно разделить на две большие группы:
- методы получения наночастиц путем измельчения обычного макрообразца - диспергационные методы (технология «сверху-вниз»);
- методы «выращивания» наночастиц из отдельных атомов или молекул - конденсационные методы (технология «снизу—вверх»).
В первом случае необходимо тем или иным способом раздробить крупные частицы материала до наноразмерных, затратив при этом значительное количество энергии на резкое увеличение поверхности раздела твердое тело – жидкость (или газ). Например, суммарная поверхность всех частиц, содержащихся в порошке металлического никеля, имеющих средний размер 0,1 мм, увеличивается в 1000 раз при диспергировании до размера 100 нм, а сам порошок становится пирофорным, то есть воспламеняется при соприкосновении с воздухом. Это самый простой из всех способов создания наночастиц, своего рода «мясорубка» для макротел.
Во втором случае наночастицы образуются в результате химического превращения соединения - предшественника (прекурсора) с последующим объединенем (агрегацией) молекул или атомов продукта реакции. Этот принцип основан на феномене конденсации (конденсация – это переход вещества из газообразного состояния в конденсированное (твердое или жидкое) вследствие его охлаждения).
Как нетрудно заметить, у этих двух различных способов получения ультрадисперсных частиц материала есть один общий термодинамический враг – большой избыток поверхностной свободной энергии. Этот избыток энергии является движущей силой самопроизвольного (если не предпринять соответствующих мер) укрупнения наночастиц с потерей их уникальных свойств.
Во всех методах получения наночастиц требуется мощный приток энергии от внешнего источника, поскольку эти методы приводят к получению наночастиц в неравновесном состоянии.
Как только приток энергии прекращается, система стремится вернуться к равновесию. Почему это происходит? Рассмотрим, например, конденсационный метод. Монокристалл нагревают до плавления и последующего испарения. Затем образовавшийся пар резко охлаждают. По мере охлаждения зарождаются и укрупняются наночастицы. Они начинают упорядочиваться и объединяться в агрегаты. Если предоставить такую систему самой себе, то постепенно границы между наночастицами в агрегатах исчезают и они превращаются в микрокристаллы. При длительном выдерживании микрокристаллов в паре наиболее мелкие и дефектные из них испаряются, а более крупные и совершенные продолжают расти. И так до тех пор, пока в системе не воссоздастся исходный монокристалл. Таким образом, в течение всего интервала времени от момента, когда в паре уже накопилось заметное количество наночастиц, до момента, когда большинство наночастиц достигнет размера 100 нм, система находится в наносостоянии. Затем она переходит в равновесие и появление наночастиц прекращается. И если не создать искусственные условия для их консервации, то возникшие частицы тоже могут объединиться в компактное вещество
При диспергационном способе, в условиях достаточного притока механической энергии, размер фрагментов, на которые распадается монокристалл, уменьшаются. Пока приток механической энергии велик, большинство фрагментов имеют нанометровый размер и система остается в наносостоянии. Когда же приток энергии останавливается, нанофрагменты начинают срастаться и укрупняться. Все это продолжается до тех пор, пока в системе не будет воссоздан исходный монокристалл. Чтобы предотвратить этот нежелательный эффект, в систему вводится стабилизатор, который обычно представляет собой молекулярный раствор белков, полимеров или поверхностно-активных веществ (ПАВ). На определенной стадии агрегации стабилизатор вступает в действие: его молекулы облепляют растущую наночастицу со всех сторон, что препятствует ее дальнейшему росту. Регулируя состав и концентрацию стабилизатора, можно получать наночастицы любого размера.
Большинство наносистем, получаемых промышленными методами, нестабильны, и, если не создать необходимых условий для их консервации, они будут стремиться вернуться в свое компактное состояние.
Основные методы получения наночастиц. Все методы получения условно делятся на механические, физические, химические и биологические. В основе механических методов лежит воздействие больших деформирующих нагрузок: давления, изгиба, вибрации, трения. Физические методы получения основываются на физических превращениях: испарении, конденсации, возгонке, закалке. К химическим методам относятся те, в основе которых лежит химическая реакция: электролиз, окисление-восстановление, термическое разложение. Биологические методы основаны на использовании биохимических процессов, происходящих в белковых телах.
Методы химического диспергирования. Методы синтеза с помощью химических реакций можно разделить на три группы. К первой относятся методы, в которых диспергирование происходит при химическом превращении. Во вторую включены методы, основанные на различных вариантах электрохимических реакций. К третьей группе относятся методы, в определенной степени сочетающие химические и физические процессы.
Получение наночастиц с использованием химических реакций. Широко используется метод химического осаждения. В этом случае после приготовления растворов солей металлов создают условия для осаждения гидроксидов металлов из этих растворов с помощью веществ-осадителей. В качестве последних используют щелочные растворы, например аммиак, гидроксиды натрия и калия, а также углекислый аммоний, щавелевую кислоту, оксалат аммония. Условия осаждения регулируют путем изменения кислотности (рН) среды и температуры. После высушивания осадков получают нанопорошки оксидов. Далее, путем их термообработки в восстановительной среде можно получать металлические нанопорошки с размером частиц от 10 до 150 нм. Меняя условия осаждения, можно регулировать размер частиц, а также получать порошки сферической, игольчатой, чешуйчатой и неправильной формы. Основным недостатком метода является использование больших объемов, значительное содержание примесей в порошках и большой разброс частиц по размерам.
Получение нанопорошков методом гетерофазного взаимодействия основано на замещении катионов или анионов твердой фазы ионами окружающей жидкой среды. Метод используется для получения композиционных частиц, например наночастиц одного материала, покрытых слоем другого. Так, наночастицы CdS, покрытые слоем PbS, получают при частичном замещении ионов кадмия на ионы сиинца. Метод позволяет также получать различные металлические порошки с размером частиц 10-100 нм, если осуществлять взаимодействие твердой соли металлов с раствором щелочи. Например, размер частиц нанопорошка Ni, полученного таким образом, составил 20 нм.
Наиболее востребованным и широко применяемым является золь – гель метод. Первоначально он был разработан для получения порошка железа. Золь – гель технология – это один из способов получения наночастиц, основанный на синтезе коллоидных частиц неорганических и неоргано-органических гибридных материалов.
Способ заключается в осаждении из водных растворов нерастворимых соединений в виде геля и последующем их восстановлении. Начинают процесс с того, что из однородного раствора, содержащего все необходимые ингредиенты, добавлением специального вещества получают золь – стабильное состояние наночастиц, при котором они плавают в растворе, не оседая на дно сосуда. Со временем частицы начинают слипаться, и получается пространственный каркас геля, в пустотах которого остается растворитель. Перевод золя в гель осуществляют при удалении из него части воды нагреванием или экстракцией органическим растворителем. Эффективным является распыление водяного золя в нагретую, не смешивающуюся с водой жидкость, например, керосин.
При высушивании геля образуются наночастицы и другие нанообъекты. Гель можно использовать непосредственно для получения пленок или монолитных изделий. Чаще всего из геля получают нанопорошки метллов и оксидов металлов.
Таким образом, суть золь-гель метода сводится к выделению из исходного раствора макромолекул в виде полимеризованных цепочек или трехмерных сеток, содержащих катионы. Образование гелей в растворе достигается в результате одновременного протекания двух реакций - гидролиза и поликонденсации:
гидролиз =M-OR + НОН → =М-ОН + ROH,
поликонденсация =М-ОН + RO-M → =М-О-М= + ROH,
где М - катион металла, R = СлН2т+1, п = 1,2,...
При высушивании геля образуется ксерогель (от греческого xeros — сушить, высушенный гель) — пористое тело, имеющее очень большую удельную поверхность (до 800 м2 /г) и обладающее высокой адсорбирующей способностью. Фактически при этом реализуется процесс образования полимерного защитного слоя вокруг наночастицы, что способствует сохранению ее размеров и свойств. В то же время защитный слой может препятствовать взаимодействию наночастиц, когда задачей является получение химического соединения.
Преимуществами золь – гель технологии являются: низкая температура процессов; возможность контроля состава и структуры промежуточных продуктов; высокая чистота конечного продукта; простота аппаратурного оформления и экономичность. Однако метод обладает и рядом недостатков – это многостадийность процесса; потеря части продукта в гелевом осадке; как правило, невысокая производительность.
Криохимический синтез. В связи с высокой активностью атомов и малых кластеров металлов в отсутствие стабилизаторов происходит агрегация в более крупные частицы. Этот процесс агрегации идет практически без энергии активации. Стабилизацию активных атомов почти всех элементов периодической системы удалось осуществить при низких (77 К) и сверхнизких (4 - 10 К) температурах методом матричной изоляции. Суть метода состоит в применении инертных газов (аргон и ксенон) в качестве матриц при сверхнизких температурах. Пары атомов металлов конденсируют с большим, обычно тысячекратным, избытком инертного газа на поверхность, охлаждаемую до 10-12 К. Значительное разбавление инертным газом и низкие температуры практически исключают возможность диффузии атомов металлов, и в конденсате происходит их стабилизация.
В связи с простотой и доступностью весьма популярным методом является химическое восстановление. Суть метода - получение металлических наночастиц путем их восстановления из солей металлов. Химическое восстановление проводят в жидкой фазе, водных и неводных средах. В качестве восстановителей используют химические соединения - борогидриды, гипофосфиты, формальдегид, соли щавелевой и винной кислот.
Для примера рассмотрим процесс получения частиц золота. Готовятся три раствора: а) раствор золотохлористо-водородной кислоты в воде; б) раствор карбоната натрия в воде; в) раствор гипофосфита натрия в диэтиловом эфире. Затем смесь трех растворов нагревается в течение часа до температуры 700С. В результате получаются частицы золота диаметром 2-5 нм. Недостаток метода — большое количество примесей в получаемой коллоидной системе наночастиц золота, которое можно уменьшить использованием водорода в качестве восстановителя.
Химическое восстановление зависит от подбора пары окислитель- восстановитель и их концентраций. Существенное влияние на процесс оказывают также температура, рН среды, диффузионные и сорбционные характеристики.
Наиболее часто для восстановления ионов металла в кислой, нейтральной и щелочной водной средах используют тетрагидробораты щелочных металлов (МВН4). Тетрагидроборатами щелочных металлов восстанавливается большинство катионов переходных и тяжелых металлов. Это связано с высоким окислительно-восстановительным потенциалом МВН4 (в щелочной среде это 1,24 В), в то время как стандартные окислительно-восстановительные потенциалы многих ионов металлов находятся в интервале -0,5 В 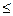 Е
Е 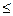 -1,0 В.
-1,0 В.
Например, сферические наночастицы серебра размером 3,3-4,8 нм можно синтезировать восстановлением азотнокислого серебра борогидридом натрия в присутствии четвертичных солей дисульфида аммония. Устойчивость частиц серебра зависит от рН среды: при рН 5-9 в водной среде частицы стабильны в течение недели. Увеличение или уменьшение рН приводит к быстрой агрегации и осаждению частиц серебра.
Получение различных наночастиц сопровождается процессами стабилизации. Для предотвращения агрегации одна активная частица не должна касаться другой. В качестве стабилизаторов широко применяются органические растворители. Они связывают поверхность растущих кристаллов, образуют комплексы с атомными частицами в растворе, контролируют их реакционную способность и диффузию к поверхности формируемой частицы.
Одним из наиболее распространенных и экономичных способов получения наночастиц является восстановление оксидов и других твердых соединений металлов. В качестве восстановителей используются газы — водород, оксид углерода, природный газ; твердые восстановители — углерод (кокс, сажа), металлы (натрий, калий), гидриды металлов. Исходным сырьем могут быть оксиды, гидроксиды, другие химические соединения металлов, руды и концентраты после соответствующей подготовки (обогащение, удаление примесей и т. п.), отходы и побочные продукты металлургического производства. Размер и форма синтезируемого порошка зависят от состава и свойств как исходного материала, так и восстановителя, а также температуры и времени восстановления. Так, взаимодействием оксидов металлов с газами (Н2, СО) и углеродом получают металлы: Fe, W, Ni, Re, Mo, Cu, Co. А для получения нанопорошков Zr, Та, Hf, Cr, Nb в качестве восстановителей используют гидриды этих металлов.
Фотохимическое и радиационнохимическое восстановление. Суть этих методов - воздействие на химическую систему высоких энергий (например, ионизирующее излучение). Подобное воздействие способствует образованию высокоактивных сильнейших восстановителей (сольватированные электроны, радикалы, возбужденные частицы), которые затем восстанавливают комплексы металлов. Фотохимический (фотолиз) и радиационно-химический (радиолиз) процессы различаются по энергии. Для фотолиза типичны энергии ниже 60 эВ, для радиолиза — 103-104 эВ. Фото - и радиационно-химическое восстановление по сравнению с химическим имеет определенные преимущества. Во-первых, оно отличается чистотой образуемых наночастиц, так как отсутствуют примеси, получающиеся при использовании химических восстановителей. Во-вторых, обеспечивается возможность синтеза наночастиц в твердых средах и при низких температурах.
Фотохимическое восстановление в растворах наиболее часто применяют для синтеза частиц благородных металлов. При получении частиц из соответствующих солей в качестве среды используют их растворы в воде, спирте и органических растворителях. В этих средах под воздействием света образуются активные частицы: Н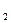 О→Н˙ + ОН˙.
О→Н˙ + ОН˙.
Реагируя со спиртами, атом водорода и радикал гидроксил дают спиртовые радикалы: Н˙ +(СН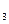 )
)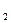 СНОН→ Н
СНОН→ Н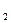 +(СН
+(СН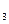 )
)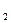 С˙ОН
С˙ОН
ОН˙ +(СН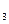 )
)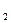 СНОН→ Н
СНОН→ Н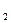 О +(СН
О +(СН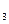 )
)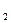 С˙ОН.
С˙ОН.
Сольватированный электрон взаимодействует, например, с ионом серебра и восстанавливает его до металла: Аg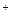 +
+ 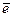 →Ag°. В начальный момент облучения образуются наночастицы серебра размером 2-3 нм. В последующие моменты возможно формирование более крупных агрегатов. Скорость агрегации зависит от природы растворителя и длины волны света. Так, при фотовосстановлении азотнокислого серебра в присутствии поликарбоновых кислот получены и сферические, и стержневые частицы серебра.
→Ag°. В начальный момент облучения образуются наночастицы серебра размером 2-3 нм. В последующие моменты возможно формирование более крупных агрегатов. Скорость агрегации зависит от природы растворителя и длины волны света. Так, при фотовосстановлении азотнокислого серебра в присутствии поликарбоновых кислот получены и сферические, и стержневые частицы серебра.
Радиационно-химическое восстановление отличается воспроизводимостью. При радиолизе, в отличие от фотолиза, распределение получаемых промежуточных частиц является более равномерным и способствует синтезу более узкодисперсных по размеру частиц. При этом вначале образуются атомы и малые кластеры металлов, которые затем превращаются в наночастицы. Для их стабилизации применяют добавки, аналогичные используемым при химическом восстановлении. Методами стационарного и импульсного радиолиза получено большое число наночастиц различных металлов, активные частицы металлов в необычных степенях окисления а также биметаллические и триметаллические наночастицы металлов. Например, радиационным восстановлением растворов солей получены наночастицы золото – ртуть (Au-Hg) и палладий – золото (Pd-Au), частицы палладия диаметром 4 нм.
Достоинствами методов восстановления являются: возможность получения порошков сплавов с содержанием компонентов от 0 до 100%; возможность использования дешевого сырья и экономичностью. А к недостаткам можно отнести ограничение применения по активности металлов к разным восстановителям и загрязнение наночастиц восстановителем.
Синтез наночастиц в матрицах (нанореакторах). В качестве матрицы (нанореактора) используют пористые материалы с упорядоченной структурой пор, например оксид кремния и цеолиты, имеющих каналы или полости. В этом случае удается получить наночастицы нитевидной, пластинчатой или сферической формы с узким распределением частиц по размерам. Цеолиты – это природные и синтетические алюмосиликаты состава MixMiiy(Alx+2ySizO2x+4y+2z)nH2O. К настоящему моменту известно более 150 типов цеолитов, из которых около 30 являются природными. Структура цеолитов (рис.2) построена из тетраэдров [SiO4]4- и [А1О4]5-, объединенных общими вершинами в трехмерный каркас, пронизанный полостями и каналами, в которых располагаются молекулы воды и катионы щелочных (Мi) и щелочноземельных (Мii) металлов. Замещение атомов алюминия каркаса на атомы других элементов, таких как В, Ga, Fe, Co, Ti, V, и обмен катионов, содержащихся в порах, позволяют направленно изменять свойства цеолитов. Синтез цеолитов основан на совместном гидролизе соединений кремния и трехзарядного металла (чаще всего алюминия) в присутствии щелочи и четвертичного амина.
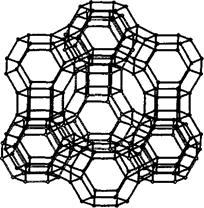
Рис. 2 - Структура цеолита
Основным методом получения наноматериалов на основе цеолитов является обмен катионов Na+, Н+ и NH+4, входящих в состав цеолитов, на катионы других металлов в водных растворах с последующим восстановлением металла водородом. Таким образом были получены частицы меди (3-7нм), и нанокомпозиты Au/NaY и Au-Fe/NaY.
Тема 5 (6 часов). Электроосаждение в нанотехнологии
Лекции 9-10-11. Общие принципы и особенности. Технологии микро- и наноэлектроники. Нанокристаллические пленки и наноструктурные покрытия. Композиционные электрохимические покрытия. Получение наноматериалов электрохимическими методами. Основные закономерности и условия катодного электроосаждения.
Как уже упоминалось, электрохимический процесс является разновидностью гетерогенного процесса, так как он протекает ни границе двух фаз: металл - раствор электролита. Основное различие между химическими и электрохимическими реакциями состоит в том, что в акте электрохимического взаимодействия непосредственный контакт между реагирующими частицами, имеющий место в химической реакции, заменен на контакт участников реакции с электродами, в результате которого происходит обмен ионами между электродом и раствором электролита. Электрохимическая реакция проводится в электролитической ячейке, состоящей из раствора электролита (ионный проводник), в который погружены два электрода (электронные проводники). Электрод, присоединенный к положительному полюсу источника напряжения (тока) называется анодом, к отрицательному полюсу - катодом. Электронные явления на поверхности электродов сопровождаются процессами массо-переноса в объеме раствора с возможным растворением или осаждением материала электродов.
Протекание обратимой окислительно-восстановительной реакции на металлических электродах порождает между ними электродвижущую силу (ЭДС), вызывающую ток во внешней электрической цепи (процессы в гальванических элементах) и, наоборот, протекание через раствор тока от внешнего источника сопровождается химическими превращениями веществ на электродах (процессы электролиза). Соответственно этому, электрохимические системы применяют на практике в двух вариантах: а) в виде гальванического элемента для создания химических ис- точников тока; б) в виде электролитической ячейки для осаждения или удаления вещества в процессе электролиза.
В качестве реагентов электрохимической реакции могут быть ионы (простые и комплексные) и молекулы органических и неорганических соединений в водных и неводных растворах, а также металлы (чистые и сплавы) и малорастворимые соединения (оксиды, сульфиды и др.). В электрохимических реакциях скорость процесса определяется силой тока, протекающей через электрод и ей пропорциональна, поэтому плотность тока в электродных реакциях служит мерой скорости протекающих на них процессов. В электролит также могут добавляться ингредиенты, изменяющие характер протекающих процессов, такие, как поверхностно-активные вещества, замедлители реакций и прочее.
Электрохимический процесс состоит из нескольких стадий. Кроме собственно электрохимической реакции, в электрохимическом процессе, как и в любом другом гетерогенном процессе, нужно учитывать стадию доставки вещества к поверхности электрода и отвода продукта реакции от поверхности электрода (если он не выделяется на поверхности электрода в виде твердого осадка). Кроме конвенции и диффузии доставка заряженных частиц (ионов) в растворе к поверхности электрода связана также с миграцией, которая характерна только для электрохимических реакций с участием заряженных частиц. Если в катодном процессе участвует катион, то под влиянием миграции скорость его движения и доставки к электроду увеличивается, если анион -уменьшается. В анодном процессе соотношения обратные: скорость катиона уменьшается, аниона - увеличивается.
Электродный процесс осложняется, если в растворе присутствуют поверхностно-активные вещества, которые, адсорбируясь на поверхности электрода, образуют адсорбционную пленку. Электродный процесс на твердых электродах может осложняться рядом дополнительных процессов. При выделении металлов на твердом электроде лимитирующей стадией может быть кристаллизация металла, связанная с построением кристаллической решетки на поверхности электрода. При анодном процессе растворения электрода может возникнуть его пассивация. При достижении определенного потенциала скорость растворения электрода резко уменьшается. Пассивация объясняется тем, что на поверхности электрода образуется плотная адсорбционная или фазовая пленки, например пленка оксида металла.
В процессе электролиза электрическая энергия расходуется на нагрев системы, перенос вещества электрическим полем и на повышение химической энергии веществ, образующихся вследствие пространственно разделенных катодных восстановительных и анодных окислительных реакций. Особое значение имеет строение двойного электрического слоя на границах электрод-электролит, для которого характерным является изменение распределения потенциала в плотной части, прилегающей к поверхности электрода, и диффузной в зависимости от вида адсорбции, температуры и состава электролита. Направление развития электродного процесса в каждом конкретном случае определяется многими факторами: химическим составом и структурой материала электрода, величиной нормального электродного потенциала в данном электролите, величиной потенциала электрохимической поляризации (отклонение потенциала от равновесного при протекании внешнего тока), направлением тока через границу электрод-электролит, температурой и др. При этом на катоде легче восстанавливаются молекулы, атомы и ионы с наиболее высоким в данных условиях потенциалом.
При практическом осуществлении электрохимических методов контролируются такие параметры процесса, как плотность тока (обычно измеряют полный ток через электролитическую ячейку), напряжение на клеммах электродов, потенциал рабочего электрода относительно стандартного электрода сравнения, кислотность электролита (рН раствора), температура электролита, длительность процесса. Рецептуры составов электролитов для различных групп процессов чрезвычайно разнообразны. В качестве основных растворителей применяются как вода, так и неводные растворители с высокой диэлектрической проницаемостью. Конкретные требования к свойствам растворителей (вязкость, температура испарения, химическая активность по отношению к другим компонентам и др.) зависят от вида процесса (удаление, нанесение и т.п.). Назначение основных компонентов состоит в поставке молекул, атомов и ионов для протекания требуемой электрохимической реакции. Вспомогательные компоненты обеспечивают электропроводность электролита (при слабой диссоциации основных компонентов), способствуют повышению скорости основных и уменьшению скорости побочных реакций, изменяют химический состав и структуру удаляемой и наносимой фаз.
Зависимость скорости электрохимических реакций как от потенциала электрода, так и от большого количества вышеперечисленных параметров делает этот многофакторный метод исключительно привлекательным для нанотехнологии в плане получения как наноразмерных пленок переменного состава, так и различных нанообъектов, делает электрохимические методы весьма мобильными, гибкими и технологичными, так как, изменяя потенциал и другие параметры, можно управлять ходом технологического процесса. На условия протекания электрохимического процесса в основном влияют геометрические факторы (форма и размер электродов, их расположение друг относительно друга и стенок электролизера) и электрохимические факторы (изменение катодного потенциала при различной плотности тока, электропроводимость, зависимость выхода по току от плотности тока, состав, плотность, вязкость и температура электролита и т.п.). Надо учитывать также природу покрываемого металла, состояние поверхности, неоднородность материала по составу и структуре, особенно в нанотехнологии, характер предварительно проводившихся с ним операций и пр.
В результате электрохимических реакций на границе электрод-раствор может происходить: 1) - удаление исходного вещества в раствор (анодное растворение); 2) - нанесение нового вещества: а) без химического взаимодействия с веществом электрода (катодное осаждение); б) с участием исходного вещества (анодное окисление); 3) - внедрение частиц вещества из электролита в материал электрода (электрохимическое легирование); 4) - выделение газовой фазы без изменения вещества электродов.
Большое достоинство электрохимических методов - их универсальность, позволяющая осуществлять интеграцию процессов нанесения и удаления. Электрохимические процессы могут протекать с изменением геометрических размеров электродов - послойно, локально и селективно, а процессы внедрения и выделения газовой фазы - без изменения исходной геометрии. Со структурных позиций электрод и нарастающая новая фаза могут быть моно-, поликристаллическими и аморфными. В случае моно- и поликристаллических электродов возможны локально-анизотропные и локально-селективные процессы их электрохимического травления (удаления). С химической позиции электрод и нарастающая фаза бывают металлами, диэлектриками и полупроводниками. Внешнее электрическое поле, прикладываемое к электродам, может быть стационарным (не изменяющимся) и нестационарным (изменяющимся сложным образом) во времени.
В электрохимических (электродных) процессах различают обратимые, квазиобратимые и необратимые процессы. Обратимыми называют процессы, в которых скорость электродного процесса очень быстрая. При более медленной электродной реакции процесс называется квазиобратимым. При еще более медленной электродной реакции, когда ее можно рассматривать как практически одностороннюю, мы имеем дело с необратимым электродным процессом. При квазиобратимом и необратимом электродных процессах доставка вещества к электроду (или от него), как правило, также тормозит электродный процесс, что приводит к изменению концентрации реагентов в растворе вблизи поверхности электрода.
|
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 9343; Нарушение авторских прав?; Мы поможем в написании вашей работы!