
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Подход «снизу-вверх», т.е. получение нанометровых изделий или материалов методами сборки на атомарном уровне 2 страница
|
|
|
|
В микротехнологии электрохимические процессы нашли применение при очистке поверхности подложек. В производстве СБИС пластины и подложки соприкасаются с различными средами, и полностью защитить их от адсорбции различного рода примесей невозможно, так же как и на долгое время получить идеально чистую поверхность без посторонних примесей. В соответствии с электрохимической теорией взаимодействие между полупроводником и травителем обусловлено тем, что на поверхности пластины при погружении ее в травитель существуют анодные и катодные микроучастки, между которыми возникают локальные токи. На анодных участках происходит окисление кремния с последующим растворением оксида и образованием кремний-фтористоводородной кислоты, на катодах происходит восстановление окислителя (азотной кислоты). В процессе травления микроаноды и микрокатоды непрерывно меняются местами. Результирующее уравнение реакции при этом имеет вид:
3Si + 4HNO3 + 18HF = 3H2SiF6 + 4NO + 8H2O
Поскольку энергия активации химической реакции зависит от неоднородности поверхности, скорость травления чувствительна к состоянию поверхности. Так как различные кристаллографические поверхности структуры кремния имеют различно значение энергии активации химической реакции, то скорость травления зависит от ориентации пластин, а также от температуры. Электрохимическое травление основано на химических превращениях, которые происходят при электролизе. Для этого полупроводниковую пластину (анод) и металлический электрод (катод) помещают в электролит, через который пропускают электрический ток. Процесс является окислительно-восстановительной реакцией, состоящей из анодного окисления (растворения) и катодного восстановления. Кинетика анодного растворения определяется концентрацией дырок, генерируемых на поверхности полупроводниковой пластины. При этом одновременно может происходить электрохимическая полировка пластины.
В технологии микро- и наноэлектроники для получения пленочных покрытий вместе с вакуумными методами применяют электрохимическое осаждение и анодное окисление. В основу метода положены реакции протекающие в водных растворах солей металлов в условиях приложенного электрического поля. В результате взаимодействия продуктов реакции с подложкой образуется пленка. При электроосаждении меди из раствора медного купороса в качестве анода используется медная пластина. С приложением к электродам разности потенциалов происходит разложение электролита на ионы. Под действием электрического тока, протекающего через раствор, находящиеся в растворе ионы металла, двигаясь к аноду, захватывают на нем электроны и, осаждаясь, превращаются в нейтральные атомы. Под действием тока ионы меди, достигая катода, отбирают два электрона, образуя нейтральные атомы, а на аноде атом меди отдает два электрона и переходит в раствор в виде положительного иона. Процесс описывается следующими уравнениями:
на катоде Cu2+ + SO42- + 2e = Cu0↓+SO42 на аноде Cu0 + SO42- = Cu2+ + SO42- + 2e
Осаждение атомов металла начинается на дефектах структуры подложки, после этого они перемещаются вдоль поверхности к изломам, образуя пленку. Таким образом, пленка развивается островками, которые разрастаются во всех направлениях, пока не сольются. Если вблизи зародыша концентрация электролита понижена (что имеет место в большинстве случаев), то условия благоприятны для роста пленки по нормали к поверхности.
Композиционные электрохимические покрытия (КЭП) представляют собой осадки металла, содержащие включения большого числа наноразмерных инертных частиц второй фазы. В зависимости от назначения КЭП в качестве второй фазы используют различные вещества и соединения. Комбинированные покрытия позволяют улучшать поверхностные свойства изделий путем совмещения свойств электрохимических покрытий со свойствами других материалов. Порошки второй фазы чаще всего размером 0,1—1 мкм и менее вводятся в электролит для электроосаждения металла и поддерживаются там во взвешенном состоянии.
Механизм электроосаждения металла в присутствии второй фазы заключается в том, что при перемешивании электролита и за счет электрофоретических явлений частицы второй фазы попадают на катод, налипают на него или задерживаются за счет электростатического притяжения. Частицы зарастают осаждающимся металлом и закрепляются в покрытии. Получаемые КЭП содержат до 10% второй фазы. Для придания изделиям защитных и специальных свойств часто используют многослойные покрытия из различных металлов либо из слоев одного металла, но с различными физико-механическими и антикоррозионными свойствами.
Электрохимическая технология позволяет выращивать и нанокристаллические пленки. Сложность процесса электрокристаллизации связана как с неоднородностью кристаллической поверхности, так и с образованием новой фазы. При образовании твердой фазы возникает кристаллизационное перенапряжение, причиной которого является замедленность вхождения атомов в упорядоченную структуру кристаллической решетки твердого металлического тела. Перенапряжение кристаллизации проявляется в чистом виде только тогда, когда все другие стадии, кроме кристаллизации, а именно, стадия перехода, диффузия и химические реакции в электролите при протекании тока, находятся в условиях, очень близких к термодинамическому равновесию. В случае, если электроосаждение происходит на идеально гладкой поверхности, кристаллизационное перенапряжение связано с образованием зародышей. Кристаллические зародыши металла состоят из небольшого числа атомов, расположенных в одной плоскости (двухмерные зародыши), либо наслоенных друг на друга (трехмерные зародыши). Количественная теория образования и тех и других зародышей в процессе электрокристаллизации металлов основана на представлениях о механизме возникновения новой фазы из паровой фазы или пересыщенного раствора. С увеличением перенапряжения уменьшается размер зародышей и увеличивается скорость их образования, что приводит к получению мелкокристаллической структуры осадков. Если рост граней кристалла при электроосаждении происходит за счет образования двухмерных зародышей на металле, ионы которого разряжаются, то необходимо определенное минимальное скопление частиц на поверхности осаждения. При изучении роста монокристаллов было обнаружено, что процесс электрокристаллизации может протекать без образования новых зародышей, если на поверхности растущего кристалла имеются дефекты кристаллической решетки и идеальная упаковка нарушена вакансиями и адсорбированными атомами. Края неукомплектованных плоскостей образуют ступени (изломы). Присоединение новой частицы к ступени не ведет к ее исчезновению, поэтому изломы иногда называют активными местами роста, так как здесь происходит присоединение большинства частиц, встраивающихся в кристаллическую решетку.
Значения кристаллизационного перенапряжения невелики и зависят от природы металла и состояния поверхности. Для многих металлов (Zn, Pb, Ag и др.), имеющих сравнительно высокие токи обмена, кристаллизационное перенапряжение составляет всего лишь несколько милливольт. Одним из важных в теории электрокристаллизации является вопрос о месте разряда ионов металла. Непосредственно восстановление гидратированных ионов металла до атомов в местах роста зародышей статистически маловероятно. Можно предположить, что ионы металла восстанавливаются в любом месте поверхности до адсорбированных атомов, которые потом по поверхности металла диффундируют к месту роста. Согласно другой концепции, ей противоположной, энергия активации перехода из гидратированного иона в растворе в незаряженный атом слишком велика и перенос не может осуществляться с заметной скоростью. В связи с этим переносимая по поверхности частица является не адсорбированным атомом (адатом), а адсорбированным ионом (адион). Миграция адиона по поверхности будет сопровождаться постоянным уменьшением гидратной оболочки и увеличением числа координационных связей с атомами металла.
Электрокристаллизация часто сопровождается образованием осадков с предпочтительной ориентацией кристаллов (текстурой). При образовании текстуры в
расположении отдельных, кристаллов наблюдается некоторая упорядоченность. Кристаллографические направления кристаллов становятся параллельными какому-то общему направлению, называемому осью текстуры. В поликристаллическом осадке может быть одновременно осуществиться несколько различных кристаллографических направлении. Чем больше кристаллов, имеющих данное направление роста, по отношению к общему числу кристаллов, тем выше степень ориентации или степень совершенства текстуры. Иногда структура растущего осадка повторяет структуру металла основы. Такое явление называется эпитаксиальным ростом.
В практических условиях процесс электроосаждения нанокристаллических осадков довольно сложный. После формирования сплошного слоя осадка дальнейший его рост можно рассматривать как осаждение па подложке из того же металла. Принято различать четыре типа поликристаллических осадков: 1) крупнокристаллические осадки, ориентированные по отношению к основе и воспроизводящие ее структуру; 2) мелкокристаллические неориентированные осадки, состоящие из беспорядочно расположенных нанокристаллов; 3) мелкокристаллические осадки столбчатой структуры, предпочтительно ориентированные в направлении электрического поля; 4) изолированные кристаллы, ориентированные в направлении электрического поля (дендриты, порошки).
Получение наноматериалов элктрохимическими методами. Основные закономерности и условия электроосаждения.
Использование электрического тока позволяет осуществить процессы, которые в обычных условиях не происходят или идут очень медленно. Метод электроосаждения заключается в пропускании постоянного тока через водные растворы солей в процессе осаждения из них металлического порошка. Ход процесса можно описать следующим образом. Катод и анод, которые, как правило, имеют форму пластины, погружают в специально подобранный электролит. Для обеспечения чистоты конечного продукта в качестве анода лучше использовать тот же металл, что и осаждаемый. Однако по технологическим причинам это не всегда возможно. По этой причине, при производстве медного порошка применяют анод из алюминия, а при получении железного порошка — из молибдена или хромоникелевого сплава. Размер частиц получаемого порошка зависит от качества и шероховатости катода. В ходе процесса электролиза около анода и катода протекают электролитические реакции, и на катоде выделяется порошок. Осадок с катода периодически удаляется, что необходимо для получения порошка требуемой зернистости и равномерного состава. Так как состав электролита около электродов непрерывно меняется, во время процесса осуществляют принудительную циркуляцию электролита в ванне. После отделения от катода порошок промывают. Для предотвращения окисления после промывки проводится сушка, как правило, под вакуумом.
Данным методом можно получить около 30 металлов (рис.1). Поскольку в ходе электролиза происходит рафинирование (очищение), получаемые продукты имеют высокую чистоту. Металлы, осаждающиеся на катоде, в зависимости от условий процесса, могут получаться в виде порошка, губки или дендритов, которые легко измельчить небольшим механическим воздействием. Электролизные порошки хорошо прессуются, что важно при производстве изделий.


Нанокристалл серебра Нанокристалл меди на
индифферентной подложке
Рис. 1 – Наночастицы металлов, полученные катодным электроосаждением
В настоящее время используется несколько разновидностей метода электролитического осаждения. Например, э лектрофлотационный способ получения металлических порошков заключается в кристаллизации металлов в двухслойной ванне при обязательном присутствии в органическом слое поверхностно-активных веществ. Получаемые порошки кобальта и железа имеют иглообразную или палочкообразную форму и используются при производстве постоянных магнитов и магнитных лаков.
В способе электролиза расплава солей процесс проводится при высоких температурах, а в качестве электролита используются соли металлов. Этим методом получают нанопорошки Fe, Ni, Cr, Ag, Th, Nb, Ti, Zr, Be. Получение нанопорошков возможно также способом жидкометаллического катода. В этом случае в качестве катода используется жидкий металл (как правило, ртуть), в котором осаждается металлический порошок. Процесс проводится в растворе какой-либо неорганической кислоты. Этим методом получают порошки Fe, Co, Zr или сплавов, например Fe-Co. Форма частиц (10-20 нм) преимущественно дендритная. Данные порошки используются главным образом для производства магнитов.
Способ электрохимического синтеза из расплава заключается в получении химических соединений в жидкой ванне при пропускании электрического тока. Реакции происходят при высоких температурах, что обеспечивает синтез высокотемпературных модификаций соединений. Основной проблемой при осаждении из расплава является исключение захвата синтезируемым порошком компонентов растворителя и побочных соединений. Электрохимическим синтезом из расплавов получены нанопорошки карбида W, боридов W и Мо. Меняя электрические параметры процесса, можно влиять на размеры получаемых частиц.
Положительными сторонами методов электроосаждения являются: возможность эффективного воздействия на свойства порошка посредством изменения параметров электролиза; рафинирование (очищение) материала в процессе его получения; высокая производительность. Но метод электролиза сравнительно дорог из-за необходимости специального оборудования, имеет высокую энергоемкость и требует подбора реагентов, диссоциирующих в растворителе.
Тема 6 (4 часа). Анодное растворение
Лекция 12-13. Анодные процессы в гальванотехнике и электрохимических нанотехнологиях. Технологии получения наночастиц, основанные на анодном растворении. Получение гидроксидов и оксидов металлов анодным растворением. Влияние условий синтеза на форму, морфологию и фазовый состав наночастиц. Преимущества электрохимического метода.
Анодные процессы широко применяют в промышленности. Анодное растворение лежит в основе размерной электрохимической обработки металлов и сплавов и их электрополировки, анодного упрочнения металлических материалов путем удаления с поверхности тонких механически деформированных слоев, растворимые аноды используются при электрохимическом рафинировании металлов и в гальванотехнике. От анодного растворения в значительной мере зависят эксплуатационные характеристики гальванических элементов и аккумуляторов, а также коррозионное поведение конструкционных металлических материалов.
Металлические аноды широко применяются в электрохимической промышленности. В зависимости от характера процесса к ним предъявляются следующие требования.
1) Анод должен растворяться количественно с образованием акваионов (или комплексных ионов) одной определенной валентности. Таким требованиям должны удовлетворять аноды при получении некоторых гальванических покрытий.
2) Растворение анодов должно быть избирательным, т.е. один из компонентов материала анода должен растворяться количественно (часто в виде определенных ионов), а другие его составляющие не должны растворяться совсем. Пример – электролитическое рафинирование меди.
3) Анод должен растворяться с образованием на поверхности прочно сцепленных твердых продуктов взаимодействия его ионов с другими ионами, присутствующими в растворе, или с анодно выделяющимся кислородом. Примеры – анодирование алюминия, воронение стали, заряжение положительного полюса свинцового аккумулятора.
4) Анод должен растворяться с одновременным выравниванием поверхности и приданием ей блеска (электрополирование металлов). Количественное растворение анода здесь не обзательно, и часть тока может расходоваться на выделение кислорода.
5) Анод совершенно не должен растворяться, и единственным электродным процессом должно быть выделение газа, чаще всего кислорода.
Если под действием внешнего тока количество растворившегося металла будет больше, чем этого следует ожидать по законам Фарадея, то на анодное растворение металла накладывается его самопроизвольное растворение, т.е. одновременно идет коррозия металла. Если анод, который в данных условиях должен быть устойчивым, в действительности растворяется за счет внешнего тока или за счет его взаимодействия с окружающей средой, это указывает на совмещение анодного растворения с коррозией металла.
Какой из рассмотренных случаев анодного поведения металлов будет реализован, зависит от природы самого металла и состава раствора, в частности от его рН. Значительную роль здесь играют также плотность тока и температура. Один и тот же металл может быть в зависимости от конкретных условий растворимым анодом или стойким. Оценку вероятного поведения каждого металла можно получить, используя диаграммы потенциал – рН (диаграммы Пурбэ). Они позволяют установить термодинамически наиболее вероятные области потенциалов, рН и концентраций металлических ионов, отвечающих различному электрохимическому поведению данного металла.
Анодное растворение металла с переходом его в раствор в виде простых гидратированных или в виде комплексных ионов во многом представляет собой обращение процесса катодного выделения металлов. Общую реакцию анодного растворения металла, если образуются простые гидратированные ионы можно записать в виде уравнения: [М] + хН2О = Мz+aq + ze.
Металлы растворяются анодно обычно при потенциалах более положительных, чем соответствующие равновесные потенциалы, т.е. их растворение сопровождается анодной поляризацией. Появление анодной поляризации можно связать при этом с замедленностью стадий или транспортировки, или разрушения твердой фазы, или ионизации, являющихся обращением соответствующих стадий катодного процесса. При катодном выделении металлов замедленность транспортировки, т.е. недостаточная начальная скорость доставки разряжающихся ионов к электроду, о потенциал в отрицательную сторону. При анодном растворении металла замедленность стадии отвода приводит к накоплению перешедших в раствор ионов вблизи электрода и, соответственно, смещает его потенциал в положительную сторону. Аналогичная картина должна наблюдаться и при замедленном протекании других стадий. В связи с этим при не слишком больших удалениях от состояния равночесия обнаруживается некоторая симметрия в протекании процессов катодного выделения металлов и их анодного растворения. Изменение анодного и катодного перенапряжения с ростом плотности тока точно так же подчиняется примерно одному и тому же закону. Подобная аналогия проявляется и в характере изменения поверхности металла в условиях его осаждения и растворения.
В общем виде электрохимическое окисление металла в растворе или расплаве электролита с образованием растворимых продуктов и отводом освобождающихся электронов во внешнюю цепь можно записать следующим образом:
М→Мn+ + nc,
где М - атом металла, n - число освобождающихся электронов. В соответствии с законами Фарадея в отсутствие других электродных реакций зависимость между скоростью окисления металла V [г/(см2 ∙с)] и плотностью анодного тока i имеет вид:
V= N0i
N0i
где F- постоянная Фарадея. Nэ -xимический эквивалент металла.
Важнейшие характеристики анодного растворения - зависимость i от электродного потенциала Е и частная производная обратной зависимости (∂E/∂i), которая называется поляризуемостью и является технической характеристикой растворяющихся анодов. Указанные зависимости могут иметь концентрационную или кинетическую (активационную) природу. Какой из случаев реализуется на практике, зависит от соотношения между i при данном Е и током обмена i0, т.е. плотностью тока при равновесном потенциале, когда она в точности равна плотности тока обратного процесса - катодного осаждения металла. При i < i0 скорость анодного растворения лимитируется скоростью отвода продуктов окисления от поверхности электрода в объем раствора; потенциал металла сохраняет равновесное значение по отношению к его ионам в приповерхностном слое раствора и выражается уравнием Нернста:
E=E0 + 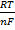 ln [Mn+],
ln [Mn+],
где Е0- стандартный электродный потенциал, [Мn+]- приповерхностная концентрация ионов металла, Т - абсолютная температура, R-газовая постоянная. Однако, оставаясь равновесным, потенциал меняется, т.к. [Мn+] у поверхности возрастает пропорционально скорости анодного растворения (т.е. плотности тока i). Соответствующая зависимость Е от i описывается уравнением:
E=ln K +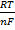 lni, или i=K exp (
lni, или i=K exp (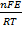 ),
),
где К - эмпирический коэффициент. Это уравнение может быть нарушено, когда будет достигнут предел растворимости соли. образуемой металлом с одним из анионов электролита, и [М ] перестанет расти. Если образующийся при этом осадок рыхлый и заметно не препятствует прохождению тока, то далее металл становится практически неполяризуемым. Такова, например, природа неполяризуемости отрицательной пластины свинцового аккумулятора.
В водных растворах электролитов поляризуемость описанного концентрационного типа характерна для переходных металлов I и II групп (Ag, Cu, Zn, Cd), которым свойственны высокие значения iо. Ее важнейшая особенность - зависимость Е не только от i, но и от интенсивности перемешивания раствора.
При i > iо растворение протекает с кинетическим контролем, т.е. лимитируется собственно электрохимической стадией - переносом заряженной частицы через границу металл - раствор, и его скорость изменяется с потенциалом Е по закону:
i=K exp (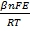 ),
),
где β - так называемый коэффициент переноса. Этот тип поляризуемости особенно характерен для переходных металлов VIII группы (Fe, Ni, Co и др.), которые отличаются низкими значениями i0.
На лимитирующую стадию, а значит, и на весь процесс может сильно влиять предшествующая ей стадия адсорбционного и химического взаимодействия поверхностных атомов металла с компонентами раствора (молекулами растворителя, анионами электролита). С учетом этой стадии механизм и скорость анодного растворения можно выразить таким образом:
M+mA→M(A)m→MAmn++ne
i=K1[Am]exp(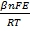 ),
),
где А - адсорбирующийся компонент раствора, m - число его молекул, участвующих в процессе, К1 - константа. В зависимости от условий адсорбция может стимулировать или ингибировать анодное растворение (т.е. может быть положительной или отрицательной). Введение в раствор или удаление из него адсорбирующихся компонентов - один из эффективных методов регулирования скорости анодного растворения в технике. Стимуляторы широко используют в технологии размерной электрохимической обработки металлов, а также для снижения поляризуемости растворяющихся анодов.
Анодное растворение, конечными продуктами которого являются многовалентные катионы или их комплексы, протекает, как правило, через ряд одноэлектронных стадий (п — 1), каждая из которых в зависимости от условий может оказаться лимитирующей. При этом промежуточные ионы металла низких степеней окисления нередко доокисляются до устойчивого состояния не только (а иногда не столько) электрохимически, но и в результате непосредственного взаимодействия с окислительной компонентой раствора (молекулы растворенного кислорода, ионы Н+), например по реакции: M++(n-1)H+→Mn++(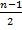 )H2
)H2
В подобных случаях итоговая скорость анодное растворение может существенно превосходить величину, рассчитанную только по току.
Нередко анодное растворение осложняется вторичными явлениями. Так, образование на поверхности растворяющегося металла фазовых или адсорбционных солевых или оксидных слоев приводит к пассивации процесса, которая проявляется в ослаблении зависимости его скорости от потенциала, в достижении предельной плотности тока растворения, а иногда и в изменении типа зависимости. В водных средах повышенной склонностью к пассивации отличаются многие переходные металлы (Mo, Cr, Ni, Fe и др.). Для них характерен критический потенциал Екр, зависящий от природы металла и рН раствора. При достижении Екр обычное увеличение скорости анодного растворения сменяется ее резким снижением, иногда до нескольких порядков величины. После этого в большом интервале значений потенциала скорость анодного растворения сохраняется постоянной, а затем снова начинает экспоненциально расти с потенциалом (рис.1). Последнее явление, известное как перепассивация, обусловлено новым анодным процессом (окислением металла до ионов высшей валентности), который лежит в основе электрохимической технологии получения высших кислородных соединений ряда металлов, например Mn, Cr. При анодном растворении сплава возможен неравномерный переход его компонентов в раствор, т.е. избирательное растворение одних компонентов и обогащение поверхностного слоя сплава другими.
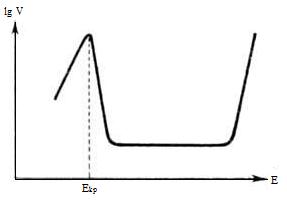
Рис.1 - Зависимость логарифма скорости анодного
растворения от электродного потенциала
Таким образом, при анодном растворении металлов могут наблюдаться различные формы зависимости между потенциалом и плотностью анодного тока (рис.2). Зависимость, показанная на рис. 2а, получается при растворении металлов из амальгам. Площадка на кривой i—Е соответствует предельной плотности тока диффузии растворяющегося металла из толщи амальгамы к ее поверхности. Аналогичные кривые получаются и при растворении твердых электродов, если на поверхности электрода образуется плохо проводящая пленка. Например, при растворении меди в хлоридных растворах на ее поверхности образуется пленка хлорида одновалентной меди. В этом случае резкий сдвиг потенциала в положительную сторону обусловлен увеличением омического сопротивления на границе электрод-раствор.
Зависимость, показанная на рис. 2б, также вначале имеет участок возрастания плотности тока, характерный для процесса активного растворения металла. Однако после достижения определенного потенциала, называемого потенциалом пассивации Еп, или потенциалом Фладе (который впервые обнаружил ниспадающую ветвь кривой), наблюдается резкое снижение тока. Этот эффект объясняется образованием на поверхности металла защитных слоев той или иной природы. Явление торможения процесса растворения металла при его анодной поляризации называется пассивностью.
Растворение пассивного металла характеризуется сравнительно низкой скоростью в широкой области потенциалов. Следующий подъем тока при более положительных потенциалах обычно связан с началом протекания другой электродной реакции. Такой реакцией может быть переход металла в раствор с образованием ионов другой валентности или реакция окисления молекул воды до кислорода (или в общем случае окисление молекул растворителя).
В области активного растворения выход атома металла из кристаллической решетки, как и при его осаждении, должен сопровождаться определенными затруднениями, приводящими к перенапряжению декристаллизации. Однако доля этого перенапряжения в общем перенапряжении почти всегда невелика. Основные кинетические закономерности анодного растворения, наблюдаемые как для твердых, так и для амальгамных электродов, определяются стадией замедленной ионизации.
Процесс растворения металла при высоких плотностях тока осложняется диффузионными затруднениями, при этом происходит повышение концентрации катионов у поверхности электрода. Иногда это повышение столь значительно, что может превысить произведение растворимости соли, которая тогда выпадает на поверхности электрода, образуя непроводящую ток пленку, и скорость процесса снижается. Это явление называется солевым пассивированием электрода.
Из принципа микрообратимости электродного процесса следует, что вблизи равновесного потенциала как в катодном, так и в анодном процессах замедленной должна быть одна и та же стадия. Поэтому, если замедленной стадией в многостадийном процессе является перенос одного из электронов в катодном процессе, то эта же стадия лимитирует скорость реакции и в анодном процессе. Следовательно, тафелевские участки поляризационных кривых должны пересекаться при равновесном потенциале. Это ограничение снимается при удалении от равновесного потенциала.
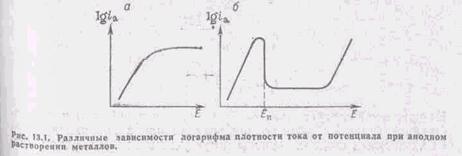
Рис. 2 – Типичные поляризационные кривые при
анодном растворении
Снижение энергии поверхностных атомов металла при адсорбции анионов приводит к изменению скорости анодного растворения. Переход атома металла в раствор с образованием иона связан с последовательными стадиями, включающими: адсорбцию аниона с постепенным ослаблением связи атома с решеткой, которая сопровождается, вероятно, частичным переносом заряда; переход в раствор в виде комплексного соединения с анионами и молекулами растворителя. Чем сильнее взаимодействие между анионом и поверхностью, т. е. чем сильнее хемосорбция, тем выше вероятность образования поверхностного комплекса. С другой стороны, чем большее число связей образует поверхностный атом с анионами, тем легче должен осуществляться его переход в раствор. Однако в связи с тем, что атом металла еще остается связанным с поверхностью, он не может присоединить такое количество лигандов, которое соответствует его максимальному координационному числу. Поэтому поверхностные комплексы и комплексы, только что перешедшие в раствор, содержат меньшее число лигандов, чем преобладающие в растворе. Последующая химическая реакция переводит промежуточный комплекс в преобладающий.
|
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 1178; Нарушение авторских прав?; Мы поможем в написании вашей работы!