
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Подход «снизу-вверх», т.е. получение нанометровых изделий или материалов методами сборки на атомарном уровне 3 страница
|
|
|
|
Особенно сильное влияние на скорость процесса ионизации таких металлов, как Fe, Ni, Co, Mn, Zn, Cd, Bi, In и Та, оказывают галогенид-ионы. Например, в реакции иоонизации индия для каждого галогенид-иона имеется определенная (критическая) концентрация, выше которой проявляется ускоряющее действие аниона. Эта концентрация тем меньше, чем сильнее адсорбируемость галогенид-иона на индии. Так, для С1- Вг- и I- критическая концентрация составляет соответстветно 5-10-1, 5-10-2 и 2ּ10-3 кмоль/м3. Увеличение концентрации аниона выше критической приводит к резкому возрастанию скорости анодного процесса. Анионы галогенов принимают непосредственное учасгие в электродной реакции или в предшествующих ей химических стадиях. Анионы могут участвовать в анодномпроцессе и в том случае, когда конечными продуктами реакции являются простые ионы металла.
Кроме того, скорость анодного процесса растворения металлов зависит от природы и концентрации поверхностно-активных веществ, находящихся в электролите. Механизм их действия аналогичен механизму при электроосаждении металлов.
Электрохимический метод синтеза наноразмерного оксида и гидроксида алюминия
В настоящее время наблюдается рост интереса к синтезу нанокристаллических оксидов металлов. Эти нанокристаллы играют важную роль при получении металлокерамических композиционных материалов в качестве укрепляющей фазы в неорганической и полимерной матрице. Оксиды металлов находят широкое применение в химической промышленности, медицине, косметике, радиоэлектронике, сельском хозяйстве и т.д. Так, оксид алюминия используется как высокоэффективный катализатор и термостойкий носитель катализаторов различных процессов основного органического синтеза, нефтепереработки и нефтехимии, высокоселективный сорбент и как компонент композиционных материалов.
Необычные свойства наноразмерных частиц оксидов металлов обусловлены как особенностями отдельных частиц, так и конгломератами, образованными этими частицами, а также характера взаимодействия между ними. Структура, дисперсность и свойства наноматериалов зависят от способа их получения. Существует множество различных методов получения наноразмерных оксидов металлов. Наиболее хорошо изученными и массово применяемыми для получения наночастиц оксидов металлов являются традиционное химическое осаждение и электрохимические методы. Способ получения гидроксидов металлов, основанный на процессах анодного растворения в коаксиальном электрохимическом реакторе является на сегодняшний день одним из наиболее перспективных.
Использование электрохимических методов позволяет осуществлять процессы, которые в обычных условиях не происходят или идут очень медленно. Меняя электрические параметры процесса, можно влиять на размеры и физико-химические свойства получаемых частиц. Известно также, что при проведении процесса в водной среде возможно получение дисперсных систем характеризуемых заданной формой и морфологией наночастиц, узким диапазоном их размеров и постоянным химическим составом.
Было изучение влияния условий получения на форму, морфологию и фазовый состав наночастиц гидроксидов и оксидов алюминия, полученных электрохимическим и химическим способами. Объектом исследования являлись 11 образцов, режимы получения которых указаны в таблице 1.
Таблица 1 – Режимы получения гидроксидов алюминия
| №обр | Способ получения | Условия получения | n(H2O), моль/г | |||
| CNaCl, моль/л | j, А/м2 | характеристика условий осаждения | t, мин | |||
| Электрохимический | 0,1 | 166,7 | — | 0,0383 | ||
| Электрохимический | 0,2 | 166,7 | — | 0,0175 | ||
| Электрохимический | 0,5 | 166,7 | — | 0,0211 | ||
| Электрохимический | 0,1 | 83,3 | — | 0,0183 | ||
| Электрохимический | 0,2 | 83,3 | — | 0,0192 | ||
| Электрохимический | 0,5 | 83,3 | — | 0,0211 | ||
| Химический | — | — | AlCl3 1,0 моль/л + NaOH 3,0 моль/л | — | 0,0208 | |
| Химический | — | — | Al2(SO4)3 0,2 моль/л + NaOH 3,0 моль/л | — | 0,0285 | |
| Химический | — | — | Al(NO3)3 0,5 моль/л + NaOH 3,0 моль/л | — | 0,0174 | |
| Химический | — | — | Al(NO3)3 0,5 моль/л + NН4OH 10,0 моль/л | — | 0,0431 | |
| Комбинированный | — | 166,7 | Al(NO3)3 0,5 моль/л + NaOH 3,0 моль/л | 0,0267 |
Исследования гидроксидов и оксидов алюминия с помощью просвечивающей электронной микроскопии выявили, что размеры полученных частиц зависят от режимов получения. Так, например, образец №1 (j = 166,7 А/м2, CNaCl=0,1 моль/л) в основном представлен совокупностью мелких частичек различного габитуса: штриховые, тонкопластинчатые, треугольные, прямоугольные, изометричные. Средний размер частиц – в пределах 50 нм, частицы склонны образовывать отдельные «агрегаты» произвольной формы, размер которых находится в широких пределах – от 100 до 1000 нм и более. Толщина отдельных частиц ≤ 1мкм, т.е. они прозрачны для электронного луча; скопления частиц (агрегаты, или конгломераты) выглядят темными или весьма темными (толщина > 1мкм). Увеличение концентрации электролита до CNaCl=0,5 моль/л в образце №3 способствовало появлению большего количества агрегатов из мелких частичек по сравнению с образцом №1. Уменьшение плотности тока до 83,3 А/м2 при малой концентрации электролита CNaCl=0,1 моль/л привело к образованию в образце №4 наряду с наночастицами агрегатов (конгломератов) с более выразительной огранкой, размером ≥150-200 нм. Увеличение концентрации агрегатов в сравнении с предыдущими образцами характерно для образца №6, синтезированного при небольшой плотности тока j =83,3 А/м2, но концентрация раствора электролита при этом составляла CNaCl=0,5 моль/л. В общем можно отметить, что при синтезе гидроксидов алюминия увеличение плотности тока и концентрации раствора электролита приводит к росту микроагрегатов, образованных наночастицами.
Образец №7 характеризуется разнообразием форм и размеров частиц субмикронного и микронного диапазонов (штриховые, удлиненнопластинчатые, брусковидные и зернистые в незначительном количестве). Для образца №8 видны агрегаты произвольной формы, образованные частицами трех видов: округлыми и слегка ограненными, размером 20-30нм; штриховыми (игольчатыми), размером 10×120нм; и единичными, удлиненно-пластинчатыми, непрозрачными, образующими пакет из тонких смещенных пластинок, размером 0,2×0,6мкм. Три формы и диапазоны размеров частиц были обнаружены в образце №9: тонкозернистые, 7-10нм; каплевидные, темные, от 10 до 50нм и чешуйчатые, от 0,3 до 1мкм. Для образца №10 наблюдаются пластинчатая форма, образующая пакеты из смещенных относительно друг друга пластинок размером 80×500 нм и более крупных формирований 0,2×3,5 мкм, а также частицами с размытыми контурами размерами от 50 до 250 нм. Образец №11 состоит из частиц различных форм и размеров, среди которых можно выделить штриховые (игольчатые) прозрачные, средним размером 10×70 нм, образующие спутанные скопления; тонкозернистые 10-20 нм и четко ограненные прозрачные частицы кристаллического габитуса ~0,3×0,75 мкм.
Оксид алюминия, полученный из образца №11, состоит из мелких частиц расположенных хаотично. Средние размеры отдельных частиц лежат в пределах 50 нм, форма близка к слабо ограненной, гексагональной. Образец оксида №3 кроме мелких частиц (~50 нм), обнаруживает присутствие более крупных, непрозрачных индивидов (до 500 нм) и существенно более крупных темных агрегатов (до 5-10 мкм). В образце №4 на фоне «стандартных» частичек (~50 нм) расположены темные образования неопределенных форм – от изометричных с расплывчатыми контурами (~0,5 мкм) до вытянутых (~1,5-5 мкм). В оксиде алюминия полученного из образца №6 на фоне беспорядочно сгруппированных мелких (~50 нм) частиц наблюдаются темные ограненные частицы размером ≥300 нм.
Агрегаты из частиц размером ~70×100 нм и скопления частиц пластинчатого вида размером 200×400 нм были обнаружены в оксиде алюминия полученного из образца №7. Образец № 8 оксида алюминия представлен аморфными образованиями, в которых встречаются частицы имеющие пирамидальную форму значительно более крупного размера, нежели в образцах описанных ранее (пакет псевдоромбической формы образованный пластинками с размерами ~350×400 нм и объекты псевдотрубчатого строения шириной 0,25 мкм и длиной ~1,5 мкм).
Четыре формы частиц с различными размерами и прозрачностью были зафиксированы для образца №9: темные зернистые частицы размером 10-30 нм; пластинчатые прозрачные, часто имеющие квазипрямоугольную форму, размеры которых варьируются в диапазоне от ~50×100 до 100×150 нм; псевдотрубчатые структуры из полусвернутых трубок шириной (диаметром 5-10 нм и длиной ~200 нм и тонкозернистые, светлые частицы с размером зерен до 10 нм.
Оксид алюминия №10 представлен изометрически тонкими частицами размером до 50 нм расположенными в виде своеобразных цепочек произвольной формы, образующими в ряде случаев темные конгломераты размером до 500 нм, а также полупрозрачные и темные частицы пластинчатого вида размером 400-600 нм не имеющие определенной формы.
Изображения, характерные для наночастиц гидроксидов и оксидов алюминия, полученные с помощью просвечивающей электронной микроскопии представлены на рис.1
а)
б)
Рисунок 1 – Результаты анализов просвечивающей электронной микроскопии при определении размеров частиц образца №1: а – гидроксид алюминия (увеличение 105000); б – оксид алюминия (увеличение 106000)
Можно отметить, что при синтезе гидроксидов алюминия увеличение плотности тока и концентрации раствора электролита приводит к росту микроагрегатов, образованных наночастицами.
Фазовые превращения гидроксидов в оксиды осуществляются при их термической обработке. В то же время, структурные характеристики оксидов преимущественно определяются условиями их синтеза и зависят от химической природы исходных гидроксидов.
Наночастицы гидроксида, получаемые в результате анодного растворения алюминия, имеют различную форму и разброс размеров, определяемый режимом электролиза. Отмечено, что увеличение плотности тока и концентрации раствора электролита приводит к росту микроагрегатов, образованных наночастицами гидроксида алюминия. Аналогичные тенденции сохраняются и для оксидов алюминия, полученных из соответствующих гидроксидов.
Тема 7 (4 часа). Формирование наноструктур на основе анодного оксида
Лекции 14-15. Темплатный синтез пористых структур. Материалы с естественным наноструктурированием. Пористый кремний. Самоорганизация при анодном окислении алюминия, титана, гафния с образованием упорядоченной мезопористой структуры. Структура анодного оксида алюминия. Формирование наноструктур на основе пористого оксида алюминия и их свойства. Пористый анодный оксид алюминия в качестве темплата (матрицы) для синтеза упорядоченных наноструктур различного состава.
Самоорганизация с образованием супрамолекулярных соединений
Эволюция физико-химической системы на пути от атомарного пара к твердому телу зависит от ее состава. Если система состоит из атомов одного итого же элемента, то сначала образуются двухатомные молекулы с ковалентной связью, затем ассоциаты и кластеры, содержащие большее число атомов, далее — наночастицы, нередко стабилизируемые в инертной матрице в форме нанокомпозитов. Конечным продуктом сборки является кристалл с ковалентной (алмаз), молекулярной (иод) или металлической (щелочные и щелочноземельные металлы) связью, который при любой температуре, отличной от абсолютного нуля, испытывает разупорядочение с образованием (в простейшем случае) точечных дефектов типа вакансий или атомов, внедренных в междоузлия кристаллической решетки. Таким образом, эволюция, конечным продуктом которой является элементарный кристалл, может быть представлена следующей схемой:
→ атомарный пар → молекулы → ассоциаты → кластеры →
→ наночастицы и нанокомпозиты → реальный кристалл с точечными дефектами → совершенный кристалл.
Для более сложной в химическом отношении системы взаимодействие разнородных атомов приводит к образованию молекул с преимущественно ковалентной или смешанной ковалентно-ионной связью, степень ионности которой возрастает по мере увеличения разности электроотрицательностей элементов, образующих молекулы. Следующей стадией взаимодействия является образование так называемых супрамолекулярных соединений и супрамолекулярных материалов с межмолекулярной нековалентной связью. В качестве движущей силы процесса образования супермолекул обычно рассматривают стремление системы к минимуму энергии Гиббса, доминирующей составляющей которой является энтальпия образования супермолекул из индивидуальных молекул или молекул и ионов.
Термин самосборка имеет более широкое содержание. Он включает любые виды спонтанного связывания компонентов с использованием как ковалентного, так и нековалентного взаимодействий. Самоорганизация, по одному из определений,
- включает взаимодействие систем, способных к спонтанному возникновению порядка в пространстве и/или во времени;
- включает пространственный (структурный) и временной (динамический) порядок, как в равновесных, так и в неравновесных диссипативных структурах;
- затрагивает только нековалентный, супрамолекулярный уровень;
- приводит к образованию полимолекулярных ансамблей за счет специфически взаимодействующих актов распознавания молекулярными компонентами друг друга.
Чем выше степень и размерность пространственной организации фрагментов, тем с большим основанием их можно рассматривать как организованные (молекулярные слои, мембраны, мицеллы, коллоиды, жидкие кристаллы, молекулярные кристаллы). Таким образом, самоорганизация включает взаимодействие между частями и интеграцию этих взаимодействий, обусловливающие коллективное поведение системы (наблюдаемое, например, при фазовых переходах или при возникновении пространственных и временных волн).
Важную роль в образовании супермолекул играет предыстория, или топохимическая память, равно как и темплатный эффект, осуществляемый центральным ионом или молекулой по отношению к другим фрагментам образующихся супермолекул. В результате самосборки последних возможно создание новых функциональных материалов.
Самоорганизация в наносистемах. Уменьшение размера частиц в дисперсной системе до нанометровых величин сопровождается изменением объемных свойств последней, включая параметры (а иногда и тип) кристаллической решетки, температуру плавления, теплопроводность, электропроводность и т.д. Подобное изменение размера частиц меняет характер взаимодействия их друг с другом, в результате которого создаются разнообразные наноструктуры с уникальными оптическими, магнитными, каталитическими и реакционными свойствами. Эти изменения и эффекты проявляются тем сильнее, чем ближе размер частиц к атомарному.
Вместе с тем многие свойства материалов (в том числе магнитные, оптические, электрические) являются следствием коллективных взаимодействий в твердом теле и не могут сохраняться при переходе от объемного материала к наночастице. В этом случае свойства веществ не могут быть объяснены только увеличением их удельной поверхности и ростом числа поверхностных атомов без учета квантоворазмерных эффектов.
Благодаря наличию у наночастиц и наноструктур уникальных физико-химических свойств большой интерес представляет создание функциональных наноматериалов на их основе. В последнее время особое внимание уделяется магнитным и полупроводниковым наноматериалам. Это связано с огромной практической значимостью этих классов материалов для развития информационных технологий. Так, суперпарамагнитные материалы на основе нанокристаллов переходных металлов (например, Fe, Co, Ni) применяют в устройствах памяти со сверхвысокой плотностью записи информации. Наноматериалы на основе полупроводников (например, типа AII BVI и AIVBVI) обладают уникальными оптическими свойствами и являются перспективными материалами для активных элементов лазеров с перестраиваемой длиной волны, элементов нелинейной оптики и устройств наноэлектроники.
Темплатные структуры
В результате эволюции любых физико-химических систем, находящихся в неравновесных условиях, возможно образование разнообразных структур и нанокомпозитов.
Так, пористые структуры с диапазоном размеров пор от 10 нм до 10 мкм формируются в результате темплатного синтеза. Схема такого синтеза представлена на рис.1. Вокруг частиц темплата или шаблона в результате самоорганизации структурных единиц будущей матрицы образуется непрерывный каркас, так что последующее удаление темплата оставляет полости, в точности копирующие размеры и форму частиц шаблона. В качестве последнего чаще всего используют полистирольные или кремнеземные шарики, которые удаляют после образования каркаса: полистирольные шарики выжигают на воздухе или растворяют в толуоле, а кремнеземные вытравливают плавиковой кислотой.
Рис. 1 - Схема темплатного синтеза пористых структур.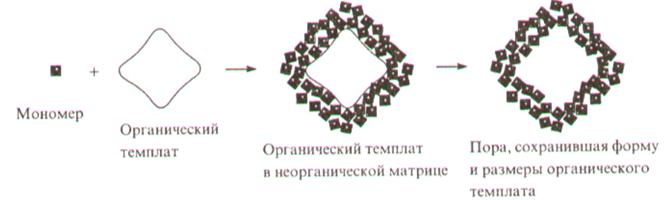
На рис. 2 представлены типичные примеры темплатных пористых структур. Темплатный синтез оказался привлекательным для получения мезопористых, металлических, металлооксидных, халькогенидных, полимерных и кремнеземных материалов, но наибольший интерес такой синтез представляет для формирования фотонных кристаллов — пространственно-периодических структур, состоящих из фрагментов с различной диэлектрической проницаемостью. Важнейшей особенностью фотонных кристаллов является наличие фотонной полосы запрещенных энергий, которая исключает прохождение через кристалл фотонов с определенной длиной волны. Фотонные кристаллы являются аналогами полупроводниковых кристаллов с той разницей, что позволяют манипулировать не электронами, а фотонами, открывая тем самым путь к развитию фотоники.
 |
Рис.2 - Типичные примеры темплатных пористых структур в полимерных материалах на основе полиуретана (а-с) и в керамике на основе SiO2 (d), SnO2 (e) и Тi O2 (f')
В отличие от полупроводниковых кристаллов, в которых периодическая атомная структура формируется самопроизвольно, фотонные кристаллы получают искусственно, реализуя, как правило, те или иные приемы темплатного синтеза. Постоянная «решетки» фотонного кристалла, соизмеримая с длиной волны света (порядка одного микрометра), на три с лишним порядка превосходит постоянные решеток обычных кристаллов, но и она почти в 100 раз меньше диаметра волоса человека. Метод темплатного синтеза фотонных кристаллов кремния, иллюстрирует рис. 3. Метод основан на самоорганизации коллоидных сферических частиц кремнезема, выступающих в качестве упорядоченного шаблона. Процесс начинается с того, что на поверхности вертикально расположенной кремниевой пластинки путем испарения растворителя при наличии температурного градиента осуществляют упорядоченную самоорганизацию частиц кремнезема за счет сил поверхностного натяжения, причем температурный градиент позволяет минимизировать нежелательные процессы седиментации (рис. 3а). Промежутки между сферическими частицами кремнезема однородно заполняют кремнием, используя процессы химического осаждения из паровой фазы (рис. 3b). Затем кремнезем вытравливают плавиковой кислотой, остается фотонный кристалл — пространственно-периодическая структура, состоящая из пористого кремниевого каркаса, примыкающего к кремниевому чипу (рис. 3с). Таким образом, процессы самоорганизации играют ключевую роль в формировании темплатных структур, в том числе фотонных кристаллов.
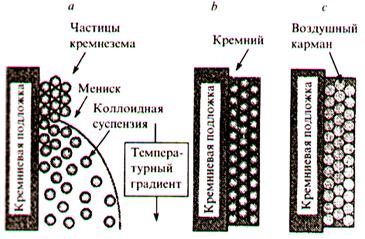 |
Рис. 3 - Схема темплатного синтеза фотонных кристаллов кремния.
Формирование наноструктур на основе пористого оксида алюминия
Пленки пористого оксида алюминия, полученные анодным окислением, интенсивно изучаются в связи с возможностью их использования в качестве темплатов при формировании наноструктурированных композитов. В структуре таких пленок имеется система упорядоченных пор с плотнейшей гексагональной упаковкой, которые располагаются перпендикулярно поверхности подложки. Их диаметр и расстояние между соседними порами можно варьировать в широких пределах.
Технология анодирования алюминия и использования оксидных пленок в качестве защитных и декоративных покрытий имеет долгую историю. Первый патент по использованию анодных покрытий для защиты алюминия и его сплавов от коррозии появился в 1923 году. Совсем недавно анодированный оксид алюминия вновь привлек внимание исследователей, что связано с открытием в 1995 году пленок оксида алюминия с самоупорядоченной пористой структурой с помощью двухстадийного анодного окисления. Данное открытие совершило прорыв в технологии получения пористых структур с очень узким распределением пор по размерам и высокими значениями геометрической анизотропии. Уникальная пористая структура, параметры (диаметр, длина и расстояние между соседними порами) которой возможно варьировать в процессе синтеза позволяет использовать пленки пористого оксида алюминия в качестве неорганических мембран, темплатирующего материала для синтеза нанонитей или нанотрубок с контролируемым диаметром и высокой геометрической анизотропией, а также 2D фотонных кристаллов.
В настоящее время наибольшее применение пленки пористого оксида алюминия нашли в качестве матриц для синтеза упорядоченных массивов анизотропных наноструктур различного состава. Интерес к таким структурам связан с возможностью изучения на их примере как фундаментальных задач (процессы самоорганизации и магнетизм в пространственно-упорядоченных наносистемах), так и решения широкого круга прикладных вопросов, касающихся создания высокоэффективных гетерогенных катализаторов, а также получения магнитных нанокомпозитов для устройств хранения информации со сверхвысокой плотностью записи.
Сферические частицы малого размера обычно являются пара- или суперпарамагнетиками, и обладают практически нулевой коэрцитивной силой при комнатной температуре. Невозможность закрепления магнитного момента суперпарамагнитных частиц в определенном направлении не позволяет использовать наноматериалы с размерами частиц менее 5-10 нм для хранения информации. Данная проблема носит название "суперпарамагнитного предела", а общепризнанным ее решением является использование анизотропных наночастиц, что позволяет резко улучшить функциональные свойства наноматериалов (например, увеличить коэрцитивную силу). Изменение анизотропии формы магнитных наноструктур позволяет осуществлять преимущественную ориентацию магнитного момента параллельно продольной оси частицы, что существенно улучшает ее магнитные свойства. Действительно, уже сейчас в продаже появились устройства с перпендикулярной записью, в основу которых легли исследования магнитных свойств анизотропных (нитевидных) магнитных частиц.
С другой стороны, синтез анизотропных металлических наноструктур интересен с точки зрения создания материалов с громадным фактором шероховатости и удельной площади поверхности, что особенно важно при создании каталитически активных материалов. С помощью электрокристаллизации Pt, PtRu или Pd могут быть получены высокоэффективные катализаторы окисления, например метанола или CO. Однако вследствие плохих адгезионных свойств электролитических осадков Pt и Pd не удается получить покрытий с требуемой механической прочностью и площадью каталитически активной поверхности (толщина покрытий обычно не превышает 1-5 мкм). Использование пленок Al2O3 в качестве матрицы позволяет совместить гибкость электрохимического метода получения металлических катализаторов, позволяющего управлять свойствами электролитических осадков, с идеей стабилизации (закрепления) наночастиц в инертной матрице Al2O3.
Процессы анодного окисления алюминия и его сплавов в кислотных электролитах уже давно привлекают внимание исследователей благодаря их широкому использованию в производстве. Получение упорядоченного пористого оксида алюминия с любым размером кристаллической ячейки возможно, если приложенное напряжение и уровень рН электролита удовлетворяют правилу 10%-ной пористости. В настоящее время важнейшим фактором формирования упорядоченной пористой структуры считают разность плотностей оксида алюминия и металлического алюминия. Так как плотность оксида (~3900 кг · м-3) значительно превышает плотность чистого алюминия (2698 кг · м-3), а электрохимическое окисление происходит лишь в тонком слое на границе оксидная пленка/металл, то увеличение плотности приводит к формированию упорядоченной пористой структуры.
Известно получение высокоупорядоченной пористой структуры оксида алюминия методом двухстадийного окисления. Сначала в результате анодного окисления высокочистого алюминия в 0.3 М растворе щавелевой кислоты при постоянном напряжении 40 В и температуре 0°С в течение 160 ч получали оксид алюминия с высокоупорядоченной пористой структурой на нижней границе пленки. Последующее селективное растворение пленки в смеси 85%-ной НзРO4 (35 мл·л-1) и СrОз (20 г·л-1) при температуре 80°С приводило к образованию алюминия с высокой упорядоченностью пор на поверхности. Второе анодное окисление алюминия с такой шероховатой поверхностью приводило к оксиду с высокоупорядоченной структурой нанопор. Такой оксид алюминия может быть использован в качестве нанореактора.
Пленки оксида алюминия на поверхности металла
При стандартных условиях (а также на воздухе) поверхность металлического алюминия самопроизвольно окисляется, что объясняется большим отрицательным изменением свободной энергии Гиббса:
2Al(тв) + 3/2O2 (г)→Al2O3(аморф); ΔG0298 = -1308 кДж/моль (1)
Процесс окисления проходит также при смачивании поверхности водой:
2Al(тв) + 3H2O(ж)→Al2O3(аморф) + 3Н2(г); ΔG0298 = -597 кДж/моль (2)
Образующийся на поверхности металла плотный оксидный слой имеет небольшую толщину (порядка 5-20 нм) и предохраняет металл от дальнейшего окисления.
Альтернативным методом получения оксидной пленки является электрохимическое окисление (анодирование) алюминия в водных растворах электролитов. При этом удается получить более толстый слой Al2O3. Рост оксида происходит на аноде:
А1(тв) + (3+n)/2 H2 O(ж) - 3e = 1/2Al2 О3 * (H2 О) п (тв) + 3H+, где n=0+3 (3)
а ионы водорода восстанавливаются на катоде:
Н+ +е- = 1/2н2(г)↑ (4)
Реакция, протекающая на аноде (Al), зависит от потенциала электрода, температуры и pH среды, который, в свою очередь определяется используемым электролитом.
Вследствие большого разнообразия полиморфных и гидратных форм оксида алюминия анодный Al2O3 имеет переменный состав. Экспериментальные данные свидетельствуют о том, что анодный Al2O3 представляет собой рентгеноаморфное твердое вещество, состоящее из гидратированного оксида алюминия Al2O3-(H2O)n, где n = 0 + 3, развитая внутренняя поверхность которого адсорбирует анионы и катионы использованного электролита.
В зависимости от условий синтеза, в частности, от используемого электролита, могут образовываться два типа анодных плёнок (рис. 1). Барьерный тип пленок может быть получен в не растворяющих оксид электролитах (5 < pH < 7), например, в растворах борной
|
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 2388; Нарушение авторских прав?; Мы поможем в написании вашей работы!