
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Подход «снизу-вверх», т.е. получение нанометровых изделий или материалов методами сборки на атомарном уровне 4 страница
|
|
|
|
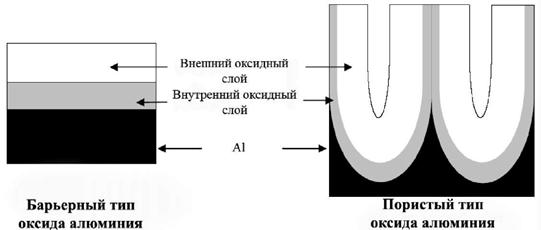 Рис. 1. Схематическое изображение пленок оксида алюминия.
Рис. 1. Схематическое изображение пленок оксида алюминия.
|
| кислоты. Пленки пористого типа образуются в слабо растворяющих электролитах, таких как серная, фосфорная и щавелевая кислоты. |
Оба типа оксидных пленок алюминия состоят из двух частей: внутреннего и внешнего слоя (рис. 1). Внутренний слой представляет собой чистый оксид алюминия, в то время как внешний содержит примеси различных ионов.
Экспериментально доказано, что толщина оксидного слоя барьерного типа фактически полностью определяется величиной приложенного напряжения, и лишь слабо зависит от используемого электролита и температуры. Максимальная толщина пленки оксида алюминия барьерного типа, достигнутая при напряжении 500 - 700 В, составляет ~1 мкм. Выше определенной напряженности электрического поля наблюдается пробой диэлектрической пленки.
В случае образования пленок пористого типа возможно получить более толстые оксидные пленки, чем покрытия барьерного типа, их толщина зависит от времени анодирования. Наиболее важными параметрами, влияющими на толщину пористой пленки, являются температура, время электролиза, плотность тока и используемый электролит. Например, при низких температурах (0 < T < 5 °С, т.н. «жесткие» условия анодирования) образуются толстые и плотные пленки, в то время как при высокой температуре (60 < T < 75 °С, «мягкие» условия анодирования) - тонкие и неплотные оксидные покрытия, не защищающие алюминий от дальнейшего окисления. При повышении температуры плотность тока возрастает, однако это не приводит к значительному увеличению скорости роста пленки, так как скорость растворения оксида на границе раздела оксид/электролит
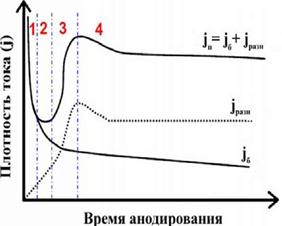 Рис. 2. Кинетика изменения плотности тока при постоянном потенциале на начальном этапе процесса анодирования [д3].
Рис. 2. Кинетика изменения плотности тока при постоянном потенциале на начальном этапе процесса анодирования [д3].
|
| также увеличивается. При слишком высокой температуре скорость растворения оксида становится больше, чем скорость его образования, что в итоге приводит к сглаживанию неровностей поверхности алюминия (т.н. электрохимическая полировка). На рис. 2 представлена зависимость плотности тока от времени при постоянном напряжении, соответствующая процессу образования барьерного и пористого типов оксида алюминия. |
В случае образования пленки барьерного типа плотность тока jб экспоненциально уменьшается с течением времени:
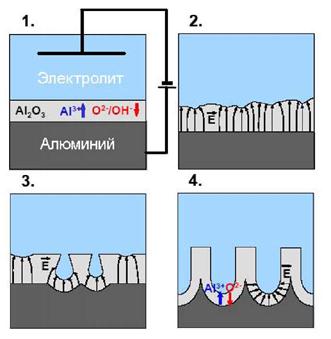 Рис. 3. Механизм формирования пористой оксидной пленки. 1. Образование пленки оксида барьерного типа. 2. Неравномерное распределение напряженности электрического поля по поверхности оксидной пленки.
3. Растворение оксида за счет локализации силовых линий и/или локального разогрева.
4. Установившийся режим роста пор.
Рис. 3. Механизм формирования пористой оксидной пленки. 1. Образование пленки оксида барьерного типа. 2. Неравномерное распределение напряженности электрического поля по поверхности оксидной пленки.
3. Растворение оксида за счет локализации силовых линий и/или локального разогрева.
4. Установившийся режим роста пор.
|
j = joexp(βE) (5)
где j0 и β - константы, зависящие от температуры и химической природы
E=U/d
материала, а E = U/d напряженность
электрического поля. Лимитирующей стадией формирования оксидной пленки является транспорт ионов через оксидный слой: увеличение толщины оксидного покрытия барьерного типа приводит к уменьшению E и прекращению роста пленки.
При образовании пленки пористого типа на первом этапе плотность тока jп быстро уменьшается (в области 1 jп и jб ведут себя идентично), проходит через минимум (область 2), увеличивается до максимального значения (область 3), и
выходит на стационарный режим в области 4. Плотность тока jп можно представить как сумму jб и гипотетической плотности тока jразн (jразн = jбп - jб), соответствующей току образования пор. При этом jб определяется используемым электролитом и величиной приложенного напряжения, в то время как зависит от электролита, напряжения и температуры.
Механизм образования пор схематически представлен на рис. 3. Можно выделить 4 этапа формирования пористой структуры, соответствующие четырем стадиям, обозначенным на рис. 2. В начале окисления поверхность алюминия покрывается пленкой непроводящего оксида алюминия (Ω = = 1010 - 1012 Ом*см) барьерного типа (стадия 1 на рис. 2 и 3); при этом напряженность электрического поля оказывается неравномерна по всей поверхности образца (стадия 2 на рис. 2 и 3), а локализация силовых линий на точках поверхности, максимально близких к проводящей подложке алюминия, приводит к усиленному растворению формирующегося оксида в этих местах за счет увеличения напряженности электрического поля и/или локального разогрева (стадия 3 на рис. 2 и 3).
Однако ввиду конкуренции соседних точек растворения оксида не все зародившиеся поры в дальнейшем продолжают свой рост, что приводит к некоторому уменьшению плотности тока (стадия 4 на рис. 2). В конечном итоге j приходит к равновесию, соответствующему равномерному росту пор. Часто наблюдаемое на практике медленное уменьшение плотности тока в процессе установившегося роста пор связано с ограниченной диффузией ионов электролита в каналах пористой пленки.
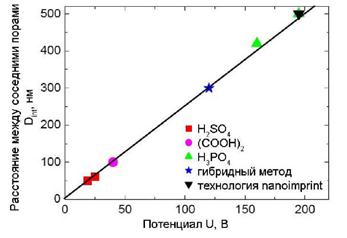 Рис. 4. Зависимость расстояния между соседними порами от потенциала анодирования.
Рис. 4. Зависимость расстояния между соседними порами от потенциала анодирования.
|
Самоорганизация пористой структуры оксида алюминия
В процессе длительного анодного окисления происходит самоупорядочение пор, движущей силой которого считается механическое напряжение, вызванное силами отталкивания между соседними порами, которое будет обсуждаться детально ниже.
Исследования процесса анодного окисления алюминия показали, что упорядоченная структура пор формируется
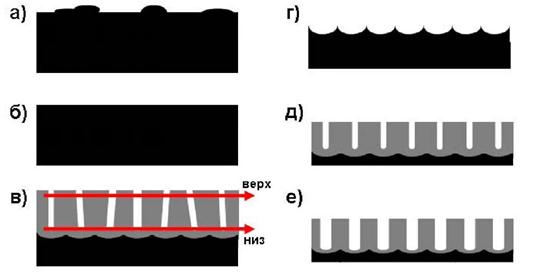 Рис. 5. Двухстадийная методика получения оксида алюминия с высокоупорядоченной
структурой пор.
Рис. 5. Двухстадийная методика получения оксида алюминия с высокоупорядоченной
структурой пор.
|
лишь при определенных условиях. Например, оксид алюминия с расстоянием между порами равным 50, 65, 100, 420 и 500 нм образуется при напряжении 19 и 25 В в серной кислоте, при 40 В - в щавелевой, при 160 и 195 В - в фосфорной (рис. 4).
Расстояние между соседними порами Dint пропорционально напряжению с коэффициентом пропорциональности к, где 2.5 < к (нм/В) < 2.8:
Dint = kU. (6)
Схема получения оксида алюминия с высокоупорядоченной структурой пор приведена на рис. 5. На первой стадии поверхность высокочистого Al (не менее 99,99 %) очищают с помощью ацетона, а также путем травления в смеси кислот HF/HNO3/HCI. Затем алюминиевую подложку подвергают отжигу в течение 3 часов при 500 °С для роста зерен металлического алюминия (рис. 5, а)). Размер зерен Al после рекристаллизационного отжига может составлять более 5 мм. Увеличение размера зерен в исходной пластинке алюминия приводит к увеличению размеров областей упорядочения (доменов) в пористой пленке. Для уменьшения шероховатости поверхности алюминия обычно проводят механическую или электрохимическую полировку в смеси, содержащей 1/4 HCIO4 + 3/4 C2H5OH. Полировка, также как и большой размер зерен, способствует получению упорядоченной пористой структуры оксида алюминия с большим размером доменов. После предварительной подготовки поверхности проводится первое анодное окисление алюминия.
 Рис. 6. Данные сканирующей электронной микроскопии пористой пленки после первого анодного окисления при 195 В в 0,1 М H3PO4: а) поверхность оксидной пленки; б) нижняя часть мембраны (микрофотография получена после селективного растворения алюминия).
Рис. 6. Данные сканирующей электронной микроскопии пористой пленки после первого анодного окисления при 195 В в 0,1 М H3PO4: а) поверхность оксидной пленки; б) нижняя часть мембраны (микрофотография получена после селективного растворения алюминия).
|
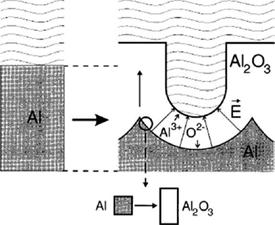 Рис. 7. Объемное расширение алюминия при анодном окислении. Пунктиром обозначена толщина Al до окисления [3].
Рис. 7. Объемное расширение алюминия при анодном окислении. Пунктиром обозначена толщина Al до окисления [3].
|
| необходимости поры можно равномерно расширить химическим травлением, например, в 0.5 - 1М фосфорной кислоте. Модель механических напряжений В настоящее время основной теорией, объясняющей образование гексагонально упорядоченной структуры пор при длительном анодировании алюминия, является модель механических напряжений (рис. 7). Основными положениями, рассматриваемыми в данной теории, являются следующие: |
На начальной стадии процесса образующиеся поры малоупорядочены (рис. 5, в) и 6, а)). Однако в результате сил отталкивания между соседними порами в ходе длительного первого окисления происходит самоупорядочение пористой структуры. В результате этого на границе раздела оксид/металл образуется периодическая структура с плотнейшей гексагональной упаковкой пор в AI2O3 (рис. 5, в) и 6, б)). После первого анодного окисления пленку AI2O3 растворяют в смеси CrO3/H3PO4, не затрагивая слоя Al, чтобы получить реплику нижней части оксидной пленки, имеющей упорядоченную структуру. В результате последующего (второго) анодного окисления при тех же условиях, что и при первом окислении, удается получить пленку оксида алюминия с высокой степенью упорядочения пор. При
Окисление происходит на границе раздела металл/оксид главным образом за счет миграции кислородсодержащих ионов (O2- или OH-) из электролита.
1. Растворение (уменьшение толщины) оксидного слоя происходит в основном ввиду гидратации формирующегося оксида алюминия.
2. В случае роста оксидной пленки барьерного типа (без образования пор) все ионы Al3+ достигают границы раздела оксид/электролит и вносят вклад в рост оксида. Напротив, при образовании пористого оксида алюминия часть ионов Al3+, диффундирующих через оксидный слой, переходит в раствор, не внося вклад в рост оксидной пленки.
3. В результате равновесия между растворением оксида на границе раздела оксид/электролит и образованием оксида на границе металл/оксид происходит рост пор перпендикулярно поверхности алюминия.
4. Окисление металлического алюминия до оксида приводит к увеличению объема элементарной ячейки (в расчете на один атом Al) приблизительно в два раза.
5. Объемное расширение при образовании оксида на границе раздела оксид/металл приводит к возникновению сжимающих напряжений в плоскости пленки, которые и являются движущей силой упорядочения пор. Расширение в вертикальном направлении способствует росту стенок пор вверх.
Согласно исследованиям, степень объемного расширения материала
зависит от напряжения анодирования и влияет на взаимное расположение пор, то есть определяет образование самоупорядоченной или хаотичной структуры. В случае максимальных значений ξmax ~ 2 поры не образуются (почти весь алюминий при окислении вносит вклад в рост оксидной пленки). Напротив, при малых механических напряжениях (ξ < 1, что эквивалентно тому, что большая часть ионов алюминия перешла в раствор электролита) сила, способствующая упорядочению, оказывается слишком мала, вследствие чего образуется разупорядоченная пористая структура. Экспериментальные данные показывают, что оптимальными условиями формирования самоупорядоченной пористой структуры оксида алюминия является ~ 1,2. Даже незначительное отклонение от этого эмпирически найденного значения приводит к резкому уменьшению размеров областей с упорядоченным расположением пор.
Правило 10% пористости

|

|

|
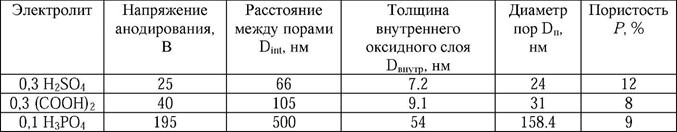
Рис. 8. Просвечивающая электронная микроскопия пленок пористого оксида алюминия с самоупорядоченной структурой, полученных при а) 25 В в 0,3М H2SO4, б) 40 В в 0,3М (COOH)2, в) 195 В в 0,1М H3PO4 [2].
Таблица 1. Структурные параметры пленок оксида алюминия с высокоупорядоченной
структурой пор.
 Пористость (P) пленок оксида алюминия с гексагональным расположением пор можно рассчитать исходя из геометрических соображений по формуле:
Пористость (P) пленок оксида алюминия с гексагональным расположением пор можно рассчитать исходя из геометрических соображений по формуле:
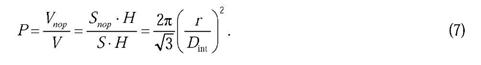
|
Структура пористого оксида алюминия была детально изучена с помощью просвечивающей электронной микроскопии. На рис. 8 приведены микрофотографии высокоупорядоченной пористой структуры оксида алюминия, полученного окислением алюминия в H2SO4, (COOH)2 и H3PO4, соответственно. На всех фотографиях отчетливо видно, что стенки между порами состоят из темного внутреннего слоя и более светлого внешнего. Данный контраст объясняют различием в химическом составе слоев: внешний слой оксида загрязнен посторонними ионами, в то время как внутренний слой представляет собой плотный слой чистого оксида алюминия. Математическая обработка полученных изображений свидетельствует, что отношение радиуса пор г к расстоянию между центрами соседних пор Dint является постоянной величиной (см. табл. 1).
Нетрудно заметить, что из экспериментально наблюдаемого постоянства отношения (r/Dint) в пленках оксида алюминия с упорядоченной структурой следует постоянство пористости. Для часто используемых пар напряжение-электролит эта величина составляет около 10% (см. табл. 1). Следует отметить, что несколько большая пористость пленок, полученных в H2SO4 (P > 10%), связана с химическим травлением пор в кислоте в процессе синтеза. Для сравнения: пористость в условиях образования неупорядоченной структуры оказывается значительно большей или много меньшей, чем 10%.
Как уже отмечалось, Dint линейно зависит от используемого напряжения. Тогда с учетом (7), выражение (6) может быть переписано в следующем виде:

|
где в оптимальных условиях образования самоупорядоченной пористой структуры можно считать P = 10%. Таким образом, при заданном радиусе пор, зависящем от pH используемого электролита, процессу самоупорядоченного роста пор соответствует определенное напряжение анодирования. Следует отметить, что часто используемые электролиты для окисления алюминия (H2SO4, (COOH)2 и H3PO4) обеспечивают различные значения pH, а, следовательно, и режимы окисления для получения высокоупорядоченной пористой структуры оксида алюминия должны быть различными (см. выражение (8)).
Варьируя концентрацию электролита и, соответственно, pH раствора, можно влиять на параметры пористости пленок AI2O3. Например, увеличение концентрации электролита в 10 раз приводит к 20%-ому уменьшению расстояния между порами (Djnt): для серной кислоты увеличение ее концентрации с 0,3М до 2М приводит к уменьшению Djnt с 65 до 50 нм. Подобные соотношения наблюдаются и в случае H3PO4.
*
Электроосаждение металлов в пористых пленках Al2O3
Важным преимуществом использования пленок пористого AI2O3 для получения нитевидных наночастиц металлов является возможность применения электроосаждения, основными достоинствами которого являются:
- простота реализации и возможность получения широкого спектра материалов;
- возможность контроля количества внедренного вещества на основе закона Фарадея;
- возможность контролируемого создания сильно анизотропных наноструктур с учетом вариации режимов осаждения, формы и концентрации пор;
- полнота заполнения пор внедряемым материалом, чего не удается достичь при использовании методов пропитки пор с последующей химической модификацией.
Контроль за образованием мезопор осуществляется путем предварительной подготовки исходной поверхности алюминия. С этой целью на поверхность алюминия наносятся периодические механические дефекты (прессованием алюминия с шаблоном из карбида кремния, имеющего заданную периодичность поверхности на мезоуровне). Пресс-форму готовят с использованием методов литографии и сухого травления. Такой подход позволяет получить хорошо упорядоченную (по глубине) структуру пор (область упорядочения — 1 мм).
Другой способ предварительной подготовки поверхности заключается в использовании иглы атомно-силового микроскопа (АСМ) для нанесения дефектов на поверхность алюминия. С применением алмазного наконечника удалось создать на поверхности Аl периодические углубления с заданными глубиной и геометрическим расположением. Данный метод позволяет варьировать структуру мезопор в широких пределах. В частности, с его помощью был получен тонкий слой оксида алюминия с тетрагональной упаковкой пор. (С увеличением толщины оксидного покрытия пористая структура стремится к организации гексагональной упаковки пор с расстоянием между центрами пор ~90 нм.) Изучено влияние расстояния между соседними дефектами на организацию пористой структуры. Показана возможность варьирования упаковки пор в области расстояний между соседними порами от 65 до ~ 100 нм при постоянном напряжении анодирования 40 В. Найдено, что достаточно даже малого механического напряжения (~5 x 10-5 Н) для контролируемого образования мезопор данным методом.
Оксид алюминия с упорядоченной структурой мезопор был использован для получения различных наноматериалов. Пленки пористого оксида алюминия применяются как маски при травлении соответствующих материалов, в качестве темплата при изготовлении полимерного «отпечатка», а также в качестве пористых матриц для внедрения функциональных материалов методами электрохимического, золь-гель- и CVD-осаждения.
В качестве примера первого процесса приведем ионное или плазменное травление полупроводниковых материалов. В этом случае пористая структура оксида алюминия переносится на подложку с достаточно высокой репродуктив-ностью. Близким процессом является изготовление «отпечатка» пористой структуры на металлических подложках путем полимеризации полиметилметакрилата в порах оксида алюминия с последующим растворением оксида алюминия и напылением металла (в этом случае пористый оксид алюминия играет роль темплата). Введение функциональных компонентов в мезопоры оксидной матрицы алюминия методами электрохимического, золь-гель- или CVD-осаждения —наиболее распространенный способ получения нанокомпозитов.
Исследования магнитных материалов на основе пористого оксида алюминия были начаты четверть века назад. Их главной целью было создание магнитных материалов, характеризующихся сверхвысокой плотностью записи. Плотность записи на современных носителях информации достигает 80 Гб·дюйм-2, и тенденция роста емкости носителей информации сохраняется уже на протяжении четырех десятилетий. В настоящее время изучается возможность создания материалов с плотностью записи, превышающей 1 Tб·дюйм-2.
Можно было предположить, что магнитные нанонити, внедренные в пористую матрицу оксида алюминия, будут удовлетворять требованиям, предъявляемым к современным носителям информации. Простота формирования структур, обладающих высокой геометрической анизотропией в направлении, перпендикулярном плоскости подложки, делает пористый оксид алюминия весьма перспективным для создания магнитных материалов.
Наиболее эффективными методами синтеза металлов в матрице пористого оксида алюминия являются импульсное и электроосаждение при переменном токе (при осаждении постоянным током возникают пробои двойного электрического слоя, что приводит к образованию крупных частиц на поверхности оксида алюминия). При использовании метода электроосаждения функциональных материалов в поры оксида алюминия исследователи сталкиваются с серьезной проблемой, связанной с существованием барьерного слоя Аl2О3 между подложкой из алюминия и нижней границей поры. Поэтому были разработаны различные методы удаления барьерного слоя. Наиболее эффективным признан метод уменьшения толщины барьерного слоя путем последовательного снижения анодного потенциала. Еще одна проблема состоит в том, что образование наночастиц происходит на границе раздела пористой структуры и подложки, а диффузия ионов раствора к этой границе затруднена, в связи с этим важную роль в процессе электроосаждения играет время между последующими импульсами осаждения.
Магнитные нанонити Со диаметром от 10 до 60 нм с расстоянием между соседними нитями от 60 до 120 нм (рис. 9а) были получены с использованием матрицы пористого оксида алюминия, синтезированного анодным окислением в щавелевой или серной кислоте. Исследование поперечного сечения массива нанонитей методом ПЭМВР показало, что нити состоят из частично агрегированных наночастиц кобальта (рис. 9).
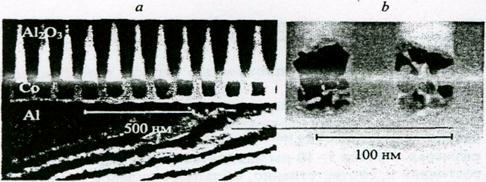
Рис. 9 - Поперечное сечение массива магнитных частиц кобальта в матрице пористого оксида алюминия (а, б - различное увеличение).
Большим преимуществом использования оксидной матрицы алюминия в качестве нанореактора является возможность получения ферромагнитных нитей различной длины за счет варьирования продолжительности электроосаждения. Основными факторами, обусловливающими магнитные характеристики ферромагнитных частиц в нанометровом диапазоне, являются размер и анизотропия формы наночастиц. Уменьшение диаметра нанонитей до 9 нм не приводит к появлению суперпарамагнетизма. Расчеты показывают, что для достижения плотности записи информации порядка 1 Тб•дюйм-2 расстояние между соседними нанонитями не должно превышать 25 нм.
Оптические наноструктурированные материалы на основе пористого оксида алюминия вызывают огромный интерес еще и в связи с тем, что проявляют высокую интенсивность люминесценции. Хотя размеры пор в мезопористом оксиде алюминия превышают характеристический размер, необходимый для проявления эффекта размерного квантования, тем не менее он обладает хорошими люминесцентными свойствами, не свойственными объемным материалам. В первую очередь, сам пористый оксид алюминия обладает люминесценцией в голубой области спектра с максимумом интенсивности при 460 нм. Наличие такой полосы испускания связано с возникновением ионизованных кислородных вакансий (F+-центров) в сильно дефектной пористой структуре. Интенсивность эмиссии можно еще больше увеличить отжигом пленки при повышенной температуре.
Высокие интенсивности испускания наблюдали при заполнении структуры мезопористого оксида алюминия оксидом цинка. Наночастицы ZnO в матрице синтезировали гидролизом Zn(OBu)2 в водной среде. Максимум интенсивности люминесценции наночастиц оксида цинка в матрице (485 нм) приблизительно совпадает с максимумом излучения чистого наноструктурированного ZnO, однако интенсивность эмиссии наночастиц ZnO, внедренных в матрицу пористого оксида алюминия, почти в 20 раз выше, что, по-видимому, обусловлено увеличением числа ионизованных кислородных вакансий в наночастицах ZnO, находящихся внутри пор оксида алюминия.
Известны работы по получению оптически активных нанонитей CdS (электроосаждение) и Bi2Te3; оксида титана, допированного тербием или эрбием (золь-гель-метод); наночастиц GaN (золь-гель-метод), красителей родамин 6G, 8-гидроксихинолината алюминия в матрице пористого оксида алюминия. Предложено использовать пористый оксид алюминия для изготовления электролюминесцентных материалов, причем катодом служила подложка алюминия, анодом — слой проводящего стекла (ITO) (оптически активный компонент располагался в порах). Все эти исследования свидетельствуют о перспективности применения наноструктур на основе пленок пористого оксида алюминия в качестве электролюминесцентных материалов.
Еще одно применение пористого оксида алюминия связано с получением двумерных фотонных кристаллов. Известно, что формирование фотонной запрещенной зоны возможно только при наличии высокоупорядоченной пористой структуры на достаточно больших участках. В связи с этим в последние годы развивается технология предтекстурирования алюминия с последующим анодным окислением. Этот подход позволил получить двумерные фотонные кристаллы с фотонной запрещенной зоной в видимой области спектра.
Пористый оксид алюминия можно использовать для создания полевых эмиттеров на основе углеродных нанотрубок. Для этого проводят электрохимическое осаждение наночастиц металлического кобальта в порах оксида алюминия (частицы кобальта являются катализаторами роста углеродных нанотрубок или нанотрубок нитрида углерода).
Пленки пористого оксида алюминия перспективны и как мембранные материалы. Транспорт ионов лития и других одно-, двух- и трехвалентных катионов зависит от диаметра пор, рН среды и ионной силы раствора, а также от гидравлической проницаемости мембран. Хорошо известно, что проводимость пористого оксида алюминия весьма существенно зависит от влажности. В связи с этим была предпринята попытка использовать ячейку, состоящую из образца пористого оксида алюминия, сжатого между металлическими электродами, в качестве сенсора на влажность. Оказалось, что в диапазоне от 50 до 100млн-1 наблюдается практически линейная зависимость емкости элемента от влажности воздуха, т.е. такие сенсоры обладают высокой чувствительностью к влажности.
Из рассмотренных выше примеров следует, что пористый оксид алюминия очень перспективен в плане создания на его основе наноматериалов для магнитных устройств хранения информации, электронных устройств, сенсоров и биомембран. В настоящее время ведется разработка методов синтеза пористого оксида алюминия с диаметром пор ≤5 нм для изучения эффектов размерного квантования, а также методов получения пористых мембран на твердых полупроводниковых подложках, обладающих высокой механической стабильностью.
Тема 8 (2 часа). Нанотехнологии в электрохимической энергетике
Лекция 16. Химические источники тока. Гальванические и топливные элементы. Электрические аккумуляторы.
Для проведения электролиза необходим внешний источник электрического потенциала, позволяющий осуществлять окислительную и восстановительную реакции на двух электродах. В отличие от этого для создания гальванического элемента выбирают такие электроды и электролитические вещества, которые обладают электрохимической энергией, достаточной для самопроизвольного протекания окислительного и восстановительного процессов.
Энергию, выделяющуюся в любой самопроизвольной окислительно-восстановительной реакции, можно непосредственно использовать для выполнения электрической работы. Это и осуществлено в гальваническом элементе, представляющем собой устройство, в котором перенос электронов происходит по внешнему пути, а не непосредственно между реагентами.
Одна из таких самопроизвольных реакций происходит, если кусочек цинка поместить в раствор, содержащий ионы меди. При протекании этой реакции окраска раствора, характерная для ионов меди Cu2+(водн), исчезает, и на поверхности цинка начинает осаждаться металлическая медь. 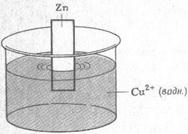
а б в
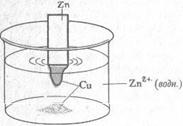
Рисунок 1 - окислительно-восстановительная реакция между цинком и медью: а- полоску цинка помещают в раствор, окраска которого обусловлена присутствием ионов меди; б- перенос электронов от цинка к ионам меди приводит к растворению металлического цинка и осаждению металлической меди из раствора, в результате чего окраска раствора ослабевает; в- после полного завершения реакции в растворе образуется избыток ионов цинка, и раствор становится полностью прозрачным
Одновременно происходит растворение цинка. Данные превращения показаны на рисунке 1, и описываются они уравнением
Zn(тв.) + Cu2+(водн) → Zn2+(водн) + Cu(тв.) (1)
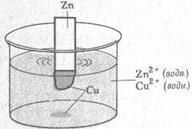
На рисунке 2 показан гальванический элемент, в котором используется окислительно-восстановительная реакция между Zn и Cu2+, которая описывается уравнением (1)
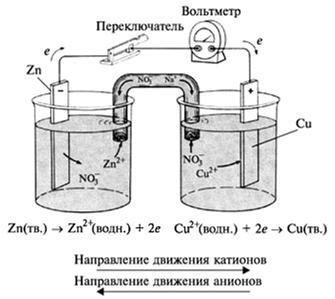
Рис. 2 - действующий гальванический элемент, в котором для замыкания электрической цепи используется солевой мостик.
Важно убедиться, что на обоих рисунках речь идет об одной и той же химической реакции. Главное различие заключается в том, что на рис.1 металлический цинк и Cu2+(водн.) не находятся в непосредственном контакте друг с другом. Следовательно, Cu2+ может восстанавливаться только в результате перетекания электронов по проволоке, соединяющей цинк и медь (т.е. по внешней цепи).
Во время работы гальванического элемента (рис.2) окисление цинка приводит к появлению дополнительных ионов Zn2+ в анодном отделении элемента. Если не существует способа нейтрализации их положительного заряда, дальнейшее окисление приостанавливается. Подобно этому, восстановление ионов меди вызывает появление избыточного отрицательного заряда в растворе в катодном отделении. Принцип электронейтральности соблюдается благодаря миграции ионов через «солевой мостик». Он представляет собой U-образную трубку, содержащую раствор какого-либо электролита, например NaNO3(водн), ионы которого не реагируют с другими ионами в гальваническом элементе, а так же с материалами, из которых изготовлены электроды. Концы трубки закрывают стекловатой или гелем, пропитанным электролитом, чтобы при перевертывании трубки, электролит не вылился из нее. При протекании на электродах процессов окисления и восстановления ионы из солевого мостика проникают в анодное и катодное отделения гальванического элемента, чтобы нейтрализовать образующиеся там заряды. Анионы мигрируют по направлению к аноду, а катионы – по направлению к катоду. В принципе, по внешней цепи, не протекает никакого тока до тех пор, пока ионы не получат возможность мигрировать через раствор из одного электродного отделения в другое и тем самым замыкать электрическую цепь.
|
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 2424; Нарушение авторских прав?; Мы поможем в написании вашей работы!