
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Степень и константа диссоциации
|
|
|
|
Диссоциация полярной молекулы в полярном растворителе.
Механизм диссоциации веществ с различным типом связи.
Для веществ с ионным типом связи:
Для количественной характеристики соотношения диссоциированных и недиссоциированных молекул электролита при данных условиях пользуются понятием степени электролитической диссоциации (ионизации). Степень электролитической диссоциации a равна отношению числа молекул, распавшихся на ионы, к общему числу молекул растворенного вещества. Величина a показывает долю молекул электролита, распавшихся на ионы.
a = N/N 100% (или в долях)
Если a = 2%, то это означает, что из 100 растворенных молекул 2 распалось на ионы.
По степени диссоциации в не очень разбавленных растворах электролиты разделяют на сильные, слабые и средней силы. Принято считать сильными электролитами те, для которых a > 30%, слабыми - если a < 3% и средней силы - если 3%< a <30%, причем все указанные значения a относятся к децимолярному раствору (0,1 М). Более строгое разделение электролитов на сильные и слабые основано на значениях констант диссоциации.
К сильным электролитам в водных растворах относятся почти все соли, многие неорганические кислоты (НNОз, H2SО4, НСlО4, НС1, HBr, HI и др.) и гидроксиды щелочных и щелочноземельных металлов (Ca, Sr, Ba).
Диссоциация - обратимый процесс (исключение составляют растворы очень сильных электролитов), поэтому для диссоциации веществ в растворе вводят константу равновесия - константа диссоциации или ионизации (см. вопрос 6 этой лекции).
Связь между степенью и константой диссоциации показывает закон разбавления Оствальда (1888 г.)
При растворении слабого электролита КА в растворе установится равновесие
КА Û К+ + А-
Тогда К = [K+] [A-]/[KA]
Если принять, что исходная молярная концентрация равна с, а степень диссоциации a, то [K+] = [A-] = сa, а [KA] = (1- a) с. Подставляя в выражение получим
К = сa . сa /(1- a)с = сa2/1- a
Если a < 1, то a» 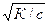
|
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 675; Нарушение авторских прав?; Мы поможем в написании вашей работы!