
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Анодная реакция растворения металлов
|
|
|
|
Или
Fе(OH) ads + Fе(H2O) d+ads ® Fе(OH)2 + Fе + H+ + (1- d)e, (I.6 г)
где Fe-поверхностный атом металла, способный переходить в раствор в результате реакций (I.6 в) или (I.6 г), (H2O) d+ads - молекула воды в ПКПЗ, которая потеряла часть заряда электрона d (0£ d £1) и деформирована в результате смещения части заряда электрона от одного из атомов водорода к атому кислорода.
Кинетические параметры процесса растворения те же, что и в случае механизмов Бокриса или Хойслера
4.5. Общая характеристика электрохимического коррозионного процесса
 |
В простейшем случае коррозии металлов с образованием их растворимых продуктов (т.е. ионов Меn+) коррозионные процессы принято называть процессами растворения металлов. Образование ионов металла из его атомов, например, в кислом растворе электролита можно представить совокупностью реакций в которой электроны освобождаются, и в которой электроны, освободившиеся в реакции (4.IV), присоединяются к ионам водорода. В результате на металле одновременно протекают две реакции — анодная (4.IV) и катодная (4.V).
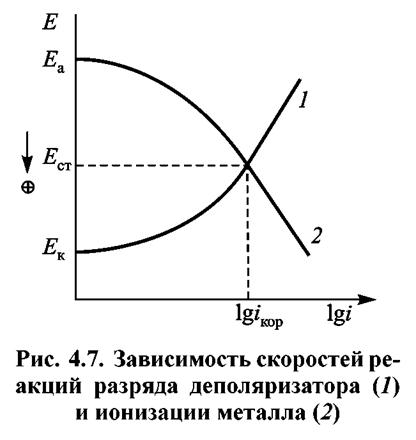 |
Перенос электронов осуществляется на поверхности металла, а перемещение ионов — в электролите. Явления, которые при этом происходят, изображены на рис. 4.7.
При протекании электрохимического процесса анодный и катодный потенциалы Еа и Ек выравниваются и принимают значение потенциала ЕСТ. Этот потенциал называют потенциалом свободной коррозии.
При ЕСТ соблюдается равенство катодного и анодного токов, т.е.
ia = iк = iкор
где iкор — скорость коррозии или саморастворения металла.
Электрохимическая коррозия при восстановлении иона водорода: термодинамика, механизм, кинетика.
На рис. 4.8 приведены поляризационные катодная (СВА) и анодная (CDE) кривые выделения Н2 и растворения металла.
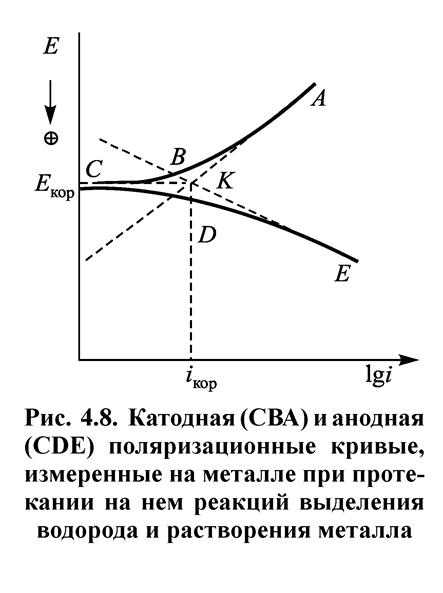 |
Для определения тока коррозии следует проэкстраполировать линейные участки кривых СВА и CDE до пересечения их друг с другом в точке К. Соответствующие этой точке потенциал Екор и плотность тока i кор называются потенциалом коррозии и скоростью коррозии.
Потенциал коррозии часто называют также стационарным или коррозионным потенциалом. Иногда применяют термин потенциал свободной коррозии. Прямые АК и КЕ выражают зависимость от потенциала истинных скоростей парциальных процессов выделения водорода и растворения металла.
При катодной поляризации скорость выделения водорода возрастает, а скорость растворения металла уменьшается. Таким образом, при помощи катодной поляризации можно защитить металл от коррозии. Это явление называется протект-эффектом и используется при защите металлических конструкций. Оно может быть осуществлено или при помощи соединения защищаемого металла с другим металлом, имеющим более отрицательное значение равновесного потенциала, или при помощи внешней катодной поляризации.
Предложенное описание коррозионных процессов справедливо лишь в том случае, если поверхность металла равнодоступна как для анодной, так и для катодной реакций. Для металла с идеально однородной поверхностью (например, для жидкого металла) выполнение такого условия не подлежит сомнению.
Для обычных твердых (даже очень чистых) металлов из-за неизбежной неоднородности их поверхности выполнение указанного условия неочевидно. Это явилось причиной появления на первых этапах развития учения об электрохимической коррозии металлов представлений, получивших название теории микроэлементов. Теория предполагала, что катодное восстановление окислителя (например, выделение водорода) может происходить только на некоторых участках поверхности корродирующего металла, а растворение металла возможно на других участках, так что существует пространственное разделение катодной и анодной реакций, позволяющее рассматривать коррозионный процесс как функционирование большого числа «короткозамкнутых гальванических элементов».
Теория микроэлементов, оказав в целом положительное влияние на развитие науки о коррозии, не позволяла проводить количественную оценку процессов общей коррозии. Академиком Я.М. Колотыркиным было показано, что коррозионное поведение твердых металлов в растворах электролитов можно объяснить, не прибегая к представлениям о локальных элементах. Напротив, следует принять, что поверхность металла равнодоступна и для катодной, и для анодной реакций, составляющих коррозионный процесс. Это, в частности, было экспериментально подтверждено следующим опытом.
На примере растворения в H2SO4 никеля было показано, что реакция разряда ионов НзО+ не влияет на скорость растворения металла (рис. 4.9). Анодная поляризационная кривая 3 на этом рисунке при потенциалах вблизи потенциала коррозии отклоняется от тафелевой прямой вследствие снижения анодного тока в результате протекания катодной реакции выделения водорода (2 на рис. 4.9) с соизмеримой скоростью. Внесение поправки на эту реакцию путем алгебраического суммирования внешнего анодного тока и скорости выделения водорода (найденной газометрически и выраженной в единицах плотности тока) приводит к получению линейного отрезка поляризационной кривой (4 на рис. 4.9), проходящего через точки анодной поляризационной кривой, лежащие при достаточно положительных потенциалах. Приведенные данные показывают, что кинетика анодного растворения металла остается одной и той же как в присутствии, так и в отсутствие параллельно протекающего процесса выделения водорода.
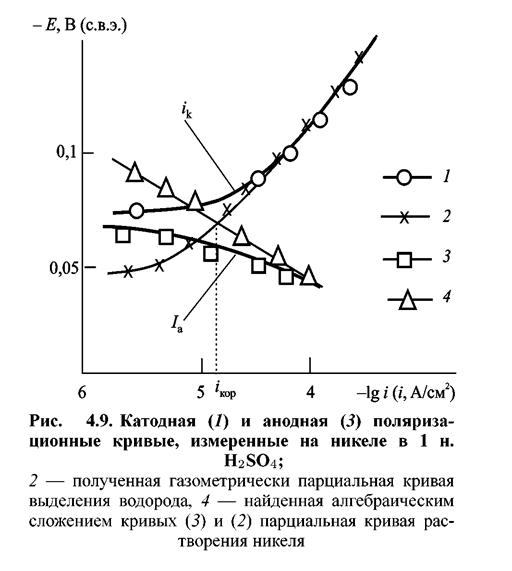
Описанные работы составили основу современной теории растворения металлов. Из них вытекала правомерность приложения к коррозионным процессам, протекающим на твердых металлах, количественных законов электрохимической кинетики.
Таким образом, можно считать, что даже на неоднородных металлах катодные и анодные реакции, составляющие в совокупности процесс коррозии, не являются пространственно разделенными; при коррозии имеет место статическое распределение во времени и в пространстве этих двух процессов.
В этом случае анализ электрохимических коррозионных процессов состоит в изучении физико-химических закономерностей отдельно катодных и анодных реакций и условий их совместного осуществления.
Коррозию металлов, при которой катодная реакция осуществляется с выделением водорода, называют коррозией металлов с водородной деполяризацией.
Коррозия металлов с водородной деполяризацией имеет место:
• при высокой активности ионов Н+, т.е. в растворах кислот, например, кислотное растворение железа, цинка и других металлов;
• при достаточно отрицательных значениях потенциала ионизации металла, например, коррозия магния в воде или растворах солей.
На практике с такими явлениями сталкиваются при хранении и перевозке кислот, при кислотном травлении металлов, при получении кислот на стадии абсорбции.
Термодинамически протекание коррозии с выделением водорода возможно, если Еа < Еk.

Значения равновесного потенциала водородного электрода в зависимости от рН для парциального давления водорода РH2 =0,1 МПа и РH2 = 5 · 10-8 МПа (последнее отвечает парциальному давлению Н2 в атмосфере) представлены в табл. 4.5.
Катодный процесс выделения водорода состоит из стадий:
• массопереноса гидратированных ионов водорода к поверхности металла;
•электрохимической стадии разряда Н3О+ и образования Н2;
• отвода Н2 от поверхности металла.
 |
В щелочных растворах концентрация ионов Н3О+ крайне мала и выделение водорода происходит за счет восстановления молекул воды:
В большинстве случаев коррозия металлов происходит в растворах с высокой концентрацией Н3О+ и поэтому концентрационная поляризация по Н3О+ не наблюдается.
Главными причинами катодной поляризации является замедленная стадия электрохимического разряда или концентрационная поляризация по молекулярному водороду, связанная с отводом газообразного продукта.
Кинетика и механизм выделения Н2 являются большим и самостоятельным вопросом, в изучение и развитие которого значительный вклад внесли работы ученых научной школы академика А.Н. Фрумкина. Эти работы широко освещаются в учебниках по электрохимии. Мы приведем только краткие, основные сведения.
В широком интервале плотностей тока скорость реакции выделения Н2 описывается уравнением Тафеля. При плотностях тока меньших, чем 10-4-10-5 А/см2, зависимость изменения потенциала от плотности тока является линейной.
Для многих металлов наклон b в координатах Ε — lgi равен 118 мВ, что отвечает механизму замедленной стадии разряда с переносом одного электрона, хотя не исключены и другие механизмы.
Константа а в уравнении Тафеля (4.22) зависит от материала катода или материала инородных катодных включений в составе сплавов и численно определяется как величина перенапряжения при плотности тока, равной 1 А/см2. Наиболее высокое перенапряжение наблюдается на свинце, ртути, кадмии, цинке.
Поляризация вследствие замедленной диффузии молекулярного водорода носит название газовой концентрационной поляризации. Она сопровождает процесс водородной деполяризации, начиная с самых низких плотностей катодного тока.
В большинстве случаев поляризационная кривая выделения Н2 имеет вид, изображенный на рис. 4.6 (участки АВ и ВС).
На некоторых металлах выделение Н2 сопровождается процессом наводороживания. При образовании водорода адсорбированный атом водорода Надс поглощается металлом и диффундирует в его объем. Атомы Надс скапливаются внутри плоскостей и вакансий кристаллической решетки и там рекомбинируются в молекулы Н2. Давление внутри металла увеличивается и происходит разрыв сплошности металла.
Таким образом, коррозия металлов с водородной деполяризацией характеризуется:
• большой зависимостью скорости коррозии металла от рН раствора;
• большой зависимостью коррозионной стойкости сплавов от их природы и содержания в них катодных примесей;
• увеличением скорости коррозии во времени, что связано с ростом посторонних примесей на поверхности металла в результате его растворения;
•возможностью появления водородной хрупкости металлов.
Электрохимическая коррозия при восстановлении кислорода: термодинамика, механизм, кинетика.
Процессы коррозии металлов, у которых катодная реакция осуществляется с участием растворенного в электролите кислорода, называются коррозией с кислородной деполяризацией.
С кислородной деполяризацией корродируют металлы, находящиеся в атмосфере или соприкасающиеся с водой и растворами солей. Это могут быть обшивка судов в речной или морской воде, оборудование охладительных систем химических заводов, магистральные трубопроводы и т.д. Коррозия металлов с кислородной деполяризацией является самым распространенным коррозионным процессом.
Таблица 4.6
Равновесный потенциал кислородного электрода при 25 °С в зависимости от рН среды
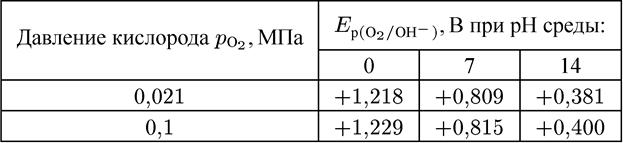
В таблице 4.6 приведены зависимости значений равновесного потенциала кислородного электрода от рН. Зависимости представлены для значений давления кислорода 0,1 и 0,021 МПа (парциальное давление О2 в атмосфере).
Значения E р(о2/он-) очень положительны, поэтому этот процесс наблюдается во многих случаях.
Катодный процесс восстановления О2 включает следующие последовательные стадии:
• растворение кислорода воздуха в электролите;
• перенос растворенного кислорода в объеме электролита к поверхности металла;
• ионизация кислорода;
• массоперенос ионов ОН- от металла в глубь электролита.
В большинстве случаев наиболее медленными стадиями катодного процесса являются в спокойных электролитах диффузия кислорода, а при перемешивании раствора — ионизация кислорода.
В перемешиваемом электролите наблюдается тафелевская зависимость между Ε и lgi.
Величина а зависит от материала катода. Для ряда металлов (Fe, Си, Аи, Pt) постоянная b равна 0,1-0,13В. Это свидетельствует о том, что причиной перенапряжения кислорода является замедленность стадии ассимиляции первого электрона (п = 1).
Однако процесс разряда кислорода осложняется концентрационной поляризацией. Она возникает вследствие затруднения транспортировки кислорода к катоду. Следствием этого, как было разобрано ранее (см. 4.4.1), является появление предельного диффузионного тока, не зависящего от потенциала.
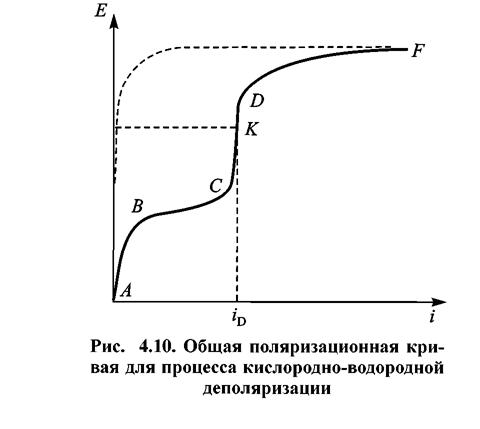
В действительности рост потенциала не может продолжаться безгранично. При достаточном смещении потенциала в сторону отрицательных значений начнется процесс выделения водорода, который будет наложен на кислородную деполяризацию. Таким образом, общий вид поляризационной кривой в координатах Ε —i представлен на рис. 4.10. Участок ABC отвечает восстановлению О2. Отрезок CKD = iD — предельный диффузионный ток. Отрезок СК характеризует восстановление О2 на предельном диффузионном токе. Участок KDF отвечает совместному процессу ионизации О2 и выделения Н2. Пунктиром обозначена парциальная кривая выделения Н2.
Пассивность металлов: явление пассивности, анодная поляризационная кривая для пассивирующихся металлов, влияние различных факторов на пассивируемость металлов. Нарушение пассивности.
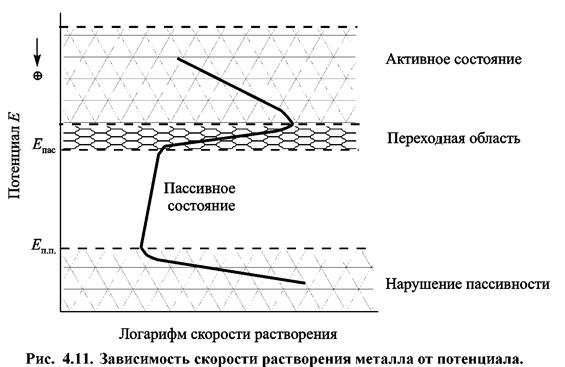 |
На рис. 4.11 представлен общий вид поляризационной кривой анодного растворения металла. Можно различить несколько участков — активное растворение, пассивация и нарушение пассивности.
В условиях активного растворения скорость процесса при сдвиге потенциала Ε в положительном направлении закономерно возрастает. По достижении же некоторого определенного потенциала скорость растворения резко снижается. Потенциал, при котором это происходит, называют потенциалом пассивации (Eпас)· В этой области вопреки уравнению электрохимической кинетики скорость растворения металла снижается при сдвиге потенциала в положительную сторону, что может быть вызвано образованием фазовых или адсорбционных оксидных пленок.
При смещении Ε от потенциала Епас в положительном направлении скорость растворения металла, как правило, практически не изменяется. Металл в этом интервале потенциалов пассивен. Следует отметить, что хотя величина тока полной пассивации может быть ничтожна мала, она никогда не достигает нулевого значения.
По достижении определенного потенциала (Епп на рис. 4.11) снова имеет место рост скорости растворения металла при сдвиге Ε в положительную сторону: происходит нарушение пассивного состояния металла, которое принято называть его активацией или перепассивацией. Скорость растворения вновь растет с увеличением положительного значения потенциала. При этом отличие от области активного состояния состоит в том, что металл растворяется с образованием ионов высшей степени окисления. Так, железо в активной области переходит в раствор в виде двухзарядных ионов, а в области
перепассивации — в виде трехзарядных ионов.
Переходная область соответствует неустойчивому пассивному состоянию металла
|
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 3831; Нарушение авторских прав?; Мы поможем в написании вашей работы!