
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Закономерности растворения металлов в активном состоянии
|
|
|
|
Растворение металлов в области активного состояния характеризуется линейной зависимостью между потенциалом Ε и логарифмом плотности тока.
При рассмотрении механизма анодной реакции растворения металлов возникает вопрос: связан ли переход металла из кристаллической решетки в раствор с одновременным (в одном акте) отщеплением всех n валентных электронов, участвующих в реакции (4.IV), или такое отщепление осуществляется через ряд последовательных, например, одноэлектронных стадий:
Me = Меn+ + nе (4.IV)
Me = Ме+ + е (4.VI)
Ме+ = Ме2+ + е (4.VII)
……………………………………………………
Me(n-i)+ = Men+ + e (4.VIII)
К настоящему времени однозначно установлено, что в подавляющем большинстве случаев процессы растворения металлов многостадийны.
Тогда возникает вопрос о том, какая из стадий определяет суммарную скорость. Ответ на этот вопрос можно проиллюстрировать на примере двухстадийного процесса растворения металла Me, протекающего с образованием ионов Ме2+ (т.е. при n = 2). Такой процесс можно представить в виде схемы:
В этом случае возможны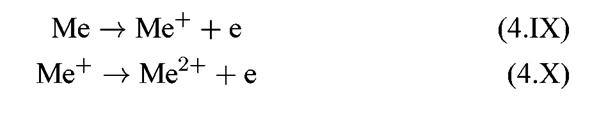
два варианта:
1. Стадия (4.IX) протекает заметно медленнее следующей за ней стадии (4.Х) и поэтому лимитирует суммарную скорость процесса. Из тафелевой зависимости для первой стадии
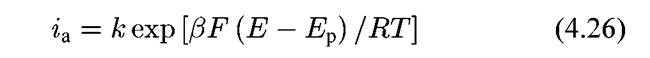
коэффициент b будет определяться уравнением b = 2,3RT/ β F (где β = 0,5) и окажется, таким образом, равным 118мВ
2. Лимитирующей является стадия (4.Х). В этом случае образующиеся в стадии (4.IX) ионы Ме+ будут накапливаться у поверхности металла до тех пор, пока не будет достигнута их концентрация, обеспечивающая возможность протекания обратного процесса (восстановления Ме+ до металла). Тогда на металле установится равновесие

Соответствующий этому равновесию потенциал будет определяться уравнением:
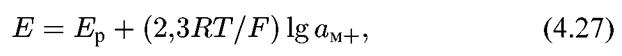
где Ер — равновесный потенциал реакции (4.ΧΙ).
Если подставить Ε из уравнения {А.21) в уравнение (4.20),
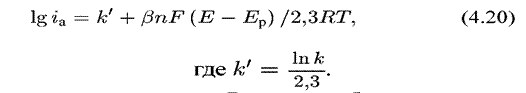 |
то после преобразований получим уравнение:где К' — константа.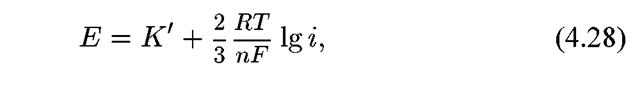 При n = 1, получим:
При n = 1, получим:
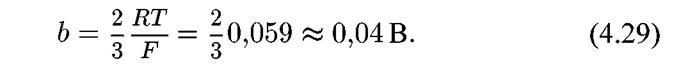
Такой «нестандартный» наклон прямолинейной зависимости lg ia от Ε может служить одним из признаков электрохимической реакции растворения металла до двухзарядных ионов Ме2+ по двухстадийному механизму с замедленной стадией отщепления второго электрона.
|
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 808; Нарушение авторских прав?; Мы поможем в написании вашей работы!