
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Расчет рН слабых и сильных кислот и оснований
|
|
|
|
Соотношения между концентрациями ионов водорода и рН
| РН | Реакция раствора | |
| Сильно кислая | ||
| 10-1 | ||
| 10-2 | ||
| 10-3 | ||
| 10-4 | Слабо кислая | |
| 10-5 | ||
| 10-6 | ||
| 10-7 | Нейтральная | |
| 10-8 | Слабо щелочная | |
| 10-9 | ||
| 10-10 | ||
| 10-11 | Сильно щелочная | |
| 10-12 | ||
| 10-13 | ||
| 10-14 |
Водородный показатель имеет большое значение для понимания большинства процессов, протекающих в жидкой фазе, так как ионы Н+ и ОН– непосредственно участвуют во многих из этих процессов. Величина рН может служить критерием силы кислоты или основания. В ряду кислот при их одинаковой молярной концентрации более сильной будет та, у которой концентрация ионов Н+ выше (рН ниже). Так, рН 0,1 М растворов уксусной и соляной кислот будут 2,87 и 1,088, соответственно. Для оснований подобная зависимость имеет обратный характер.
При расчете рН слабых электролитов обычно принимают, что аН+ ~= [Н+]. В этом случае
рН=-lg[Н+]..
Концентрацию ионов водорода в растворе слабых кислот определяют по уравнению Оствальда
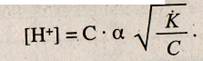
Аналогично определяют концентрацию ионов гидроксида в растворах слабых оснований

Значение рН в этом случае находят по уравнению
рН = 14 - рОН.
Для измерения рН растворов используются индикаторы и специальные приборы — рН-метры; рН-метры позволяют определить рН в диапазоне от 0 до 14 с точностью до 0,001 единицы рН.
Индикаторами называются вещества, имеющие определенную окраску в зависимости от рН среды. Чаще всего применяют, индикаторы перечисленные в табл. 7. Существует универсальный индикатор, который представляет собой смесь нескольких. Он позволяет измерить рН индикаторов в более широком диапазоне, так как его окраска изменяется от красной (рН < 3,4) через оранжевую (рН 3,4 — 4,7), желтую (рН 4,7-6,2), зеленую (рН 6,2-7,2), голубую (рН 7,2-8,5) до фиолетовой (рН > 8,5).
Таблица 7
|
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 998; Нарушение авторских прав?; Мы поможем в написании вашей работы!