
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Примеры буферных растворов
|
|
|
|
| Состав буферной смеси | Название буфера | рН при соотношении компонентов 1:1 |
| НСООН + НСООNa | Формиатный | 3,8 |
| СН3СООН + СН3СООNа | Ацетатный | 4,7 |
| NН4ОН + NН4Сl | Аммонийный | 9,2 |
| NaН2Р04 + Na2НР04 | Фосфатный | 5,6 |
Буферные растворы играют большую роль в биологии, так как активность многих ферментов и гормонов сильно зависит от рН среды, а постоянство катионов [Н+1 обеспечивает согласованную работу жизненно важных органов. Буферными свойствами обладает, например, смесь растворов слабых кислот и их солей, образованных сильными основаниями. В частности, ацетатный буферный раствор: СН3СООН + СН3СО(Жа. Рассмотрим, как «работает» такой раствор.
Диссоциацию компонентов буферного раствора можно представить:
СН3СООН ~ СН3СОО- + Н+;
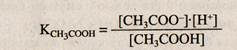
|
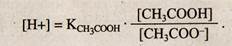
|
СН3СОONа ~ СН3СОО- + Nа+;
При введении в раствор хорошо диссоциирующего СН3СОONа диссоциация кислоты, в соответствии с принципом Ле-Шателье, подавляется. В результате этого концентрация недиссоциированных молекул [СН3СООН] становится примерно равной концентрации кислоты, а концентрация ионов [СН3СОО~] — общей концентрации соли, тогда
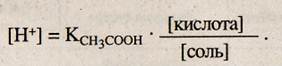
Так как КСНзСООН = 1,8 • 10-5 и постоянна, то
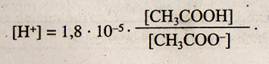
Перейдем от концентрации ионов водорода к рН, обозначив — lg Кд = рКк_та, тогда
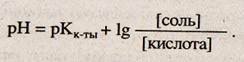
При постоянстве [СН3СООН] = [СН3СОО-]рН = 4,74.
Если же буферный раствор получают сливанием различных объемов компонентов с различной концентрацией, то формула для вычисления рН кислотных буферов выглядит следующим образом:
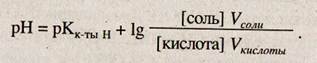
Аналогичным образом можно вывести формулу для расчета pH основного буфера на примере аммонийного буферного раствора.
Способность буферных смесей поддерживать постоянство рН связано с тем, что с добавлением кислоты реагирует один компонент смеси, а с щелочами — другой, вследствие чего происходит связывание ионов Н+ или ОН~. Например, когда к ацетатному буферному раствору прибавляют немного КаОН, гидроксид-ионы (ОН~) соединяются с катионами иодорода (Н+) уксусной кислоты и дают недиссоциирующую воду
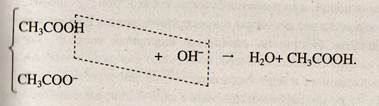
Концентрация ионов Н+ восстанавливается за счет смещения равновесия диссоциации кислоты вправо по принципу Ле-Шателье. В целом рН мало меняется.
Если к ацетатному буферному раствору прибавить не^| много сильной кислоты, процесс идет другим путем:
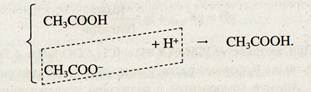
Здесь катионы Н+ сильной кислоты НСl связываются с анионами СН3СОО– соли в молекулы слабодиссоциирующей уксусной кислоты СН3СООН. Диссоциация СН3СООН подавляется ацетат-ионами СН3СОО–. В результате этого сильная кислота заменяется слабой СН3СООН и концентрация [Н+]
мало меняется.
При проведении анализа следует помнить, что способность буферных растворов поддерживать постоянство значения рН неодинакова и небезгранична, она зависит от качественного состава буферного раствора и концентрации его компонентов. Сила сопротивления таких растворов действию кислот и оснований характеризуется буферной емкостью. Предельное количество кислоты или основания определенной концентрации (моль/л), которое можно добавить к 1 л буферного раствора, чтобы значение его рН изменилось на единицу, и называется буферной емкостью.
Буферные растворы широко применяются в химическом анализе. Например, ацетатный буферный раствор, кроме указанного выше примера, применяют для разделения ионов, осаждаемых в виде гидроксидов и оксиацетатов (Сr3+, Аl3+, Ре3+), от ионов, не осаждаемых в виде.указанных соединений. Аммонийный буферный раствор применяют при осаждении карбонатов бария, стронция, кальция и отделения их от ионов магния; а также при выделении гидроксидов алюминия, хрома, железа. Формиатный буферный раствор применяют для отделения ZnS в присутствии катионов кобальта, никеля, марганца. Фосфатный буферный раствор используют при проведении многих реакций окисления-восстановления.
|
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 5532; Нарушение авторских прав?; Мы поможем в написании вашей работы!