
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Газовая хроматография
|
|
|
|
Хроматографию можно определить как процесс, основанный на многократном повторении актов сорбции и десорбции вещества при перемещении его в потоке подвижной фазы вдоль неподвижного сорбента.
Хроматографический метод анализа разработан русским ботаником М.С.Цветом в 1903 г.
Общие положения
Решение
| Дано: D= 1,25 l= 20мм х= 928 V= 500мл С=? | Для решения необходимо применить объединенный закон Бугера-Ламберта-Бера: D= хСl
Отсюда С = 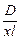 (моль/л)
l = 20 мм = 2 см
С = (моль/л)
l = 20 мм = 2 см
С = 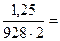  6,73∙10-4 моль/л
Ответ: а) 6,73∙10-4 моль/л
Ответ: а)
|
2. Как связана оптическая плотность (D) с коэффициентом пропускания (Т)?
а) D=Т
б) 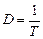
| Решение Оптическая плотность является величиной обратной пропусканию Ответ: б) |
3. Вычислить коэффициент пропускания, если оптическая плотность исследуемого раствора равна 1,25.
| а) 80% б) 8% | D =  Т = Т = 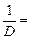 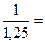 0,8
В процентах: 0,8∙100 = 80%
Ответ: а) 0,8
В процентах: 0,8∙100 = 80%
Ответ: а)
|
Литература
1. Основы аналитической химии. Практическое руководство (под ред. Ю.А. Золотова). М.: Высшая школа, 2006, 460 с.
2. Коренман Я.И. Практикум по аналитической химии. М.: Колос, 2005, 237с.
3. Коренман Я.И., Суханов П.Т. Задачник по аналитической химии. Воронеж: ВГТА, 2004, 339 с.
4. Цитович И.Е. Курс аналитической химии. - М.: Высшая школа, 1994, 495 с.
5. Васильев В.П. Аналитическая химия. Физико-химические методы анализа. - М.: высшая школа, 1989, Т. 2, 384 с.
6. Логинов Н.Я., Воскресенский А.Г., Солодкин И.С. Аналитическая химия. - М.: Просвещение, 1979,479 с.
7. Ляликов Ю.С. Физико-химические методы. -М.: Химия, 1973, 536 с.
8. Крешков А.П. Основы аналитической химии. - М.: Химия, 1970, 471 с.
9. Бончев П.Р. Введение в аналитическую химию. - Л.: Химия, 1978,496 с.
10. Ляликов Ю.С., Булатов М.И. и др. Сборник задач по физико-химическим методам анализа. - М.: Химия, 1972, 220 с.
Глава 7. Хроматография
Адсорбция вещества – основа хроматографии
Вещество подвижной фазы непрерывно вступает в контакт с новыми участками сорбента и частью сорбируется, а сорбированное вещество контактирует со свежими порциями подвижной фазы и частично десорбируется.
При постоянной температуре адсорбция увеличивается с ростом концентрации растворов или давления газа. Зависимость количества поглощенного вещества от концентрации раствора или давления газа при постоянной температуре называется изотермой адсорбции. Типичная изотерма адсорбции приведена на рис.12. Математически эта зависимость может быть выражена уравнением Лэнгмюра:
n = n∞  (5)
(5)
где n – количество адсорбированного вещества при равновесии; /
n∞ ‑ максимальное количество вещества, которое может быть адсорбировано на данном адсорбенте;
b – постоянная;
с – концентрация.
По Лэнгмюру на поверхности твердого тела имеется некоторое число мест с минимальной энергией, расположенных через определенные интервалы по всей поверхности. Их число равно n∞. На этих местах могут адсорбироваться молекулы из раствора или газа. В области небольших концентраций изотерма линейна. Действительно, при bc << 1 знаменатель (5) становится равным единице и уравнение (5) переходит в:
n=n∞bc=Гс (6)
Это уравнение линейной адсорбции. Оно соответствует уравнению Генри (Г – коэффициент Генри). Область линейной адсорбции иногда называют также областью Генри.
Однако известны случаи, когда зависимость количества адсорбированного вещества от концентрации раствора или давления газа существенного отличается от изображенной на рис.12.
Рис.12. Изотерма адсорбции

| Изотерма адсорбции может быть, например, вогнутой или S-образной. Это может быть вызвано образованием на поверхности адсорбента не моно-, а полимолекулярного слоя, что не предусматривается теорией Лэнгмюра, а также тем, что поверхность реальных твердых тел неоднородна, и другими причинами. Несмотря на некоторые существенные ограничения, применимость уравнений (5) и (6) в теории хроматографических процессов остается довольно широкой. |
При адсорбции двух или нескольких веществ уравнение (5) для i -го компонента принимает вид:
n = n∞ 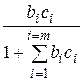
Таким образом, количество адсорбированного вещества будет определяться не только его концентрацией, но и сродством к адсорбенту. При адсорбции нескольких веществ проявление сродства особенно заметно, так как возможно вытеснение одних сорбированных веществ другими, обладающими бόльшим сродством, хотя имеющими, может быть, и меньшую концентрацию.
Классификация методов хроматографии
Различные методы хроматографии можно классифицировать по агрегатному состоянию фаз, способу их относительного перемещения, аппаратурному оформлению процесса и т.д. По агрегатному состоянию фаз хроматографические методы обычно классифицируют следующим образом (табл.7).
Таблица 7
Классификация хроматографических методов по агрегатному состоянию фаз
| Неподвижная фаза | Подвижная фаза | |
| газообразная | жидкая | |
| Твердая | Газо-адсорбционная хроматография | Жидкостно-адсорбционная колоночная, тонкослойная, ионообменная, осадочная |
| Жидкая | Распределительная газо-жидкостная хроматография | Распределительная жидкостно-жидкостная хроматография |
По способу относительного перемещения фаз различают фронтальную проявительную, или элюэнтную, и вытеснительную хроматографию.
Фронтальный метод. Это простейший по методике вариант хроматографии. Он состоит в том, что через колонку с адсорбентом непрерывно пропускают анализируемую смесь, например, компонентов А и В в растворителе Solv. В растворе, вытекающем из колонки, определяют концентрацию каждого компонента и строят график в координатах концентрация вещества – объем раствора, прошедшего через колонку. Эту зависимость обычно и называют хроматограммой или выходной кривой (рис.13).
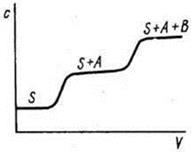 Рис.13. Выходная кривая фронтального анализа
Рис.13. Выходная кривая фронтального анализа
| 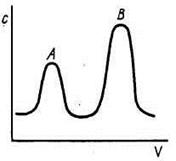 Рис.14. Выходная кривая проявительного анализа
Рис.14. Выходная кривая проявительного анализа
|
Вследствие сорбции веществ А и В сначала из колонки будет вытекать растворитель Solv, затем растворитель и менее сорбирующийся компонент А, а затем и компонент В и, таким образом, через некоторое время состав раствора при прохождении через колонку меняться не будет. Фронтальный метод используется сравнительно редко. Он применяется, например, для очистки раствора от примесей, если они сорбируются существенно лучше, чем основной компонент, или для выделения из смеси наиболее слабо сорбирующегося вещества.
Проявительный (элюэнтный) метод. При работе по этому методу в колонку вводят порцию анализируемой смеси, содержащей компоненты А и В в растворителе Solv, и колонку непрерывно промывают газом-носителем или растворителем Solv. При этом компоненты анализируемой смеси разделяются на зоны: хорошо сорбирующееся вещество В занимает верхнюю часть колонки, а менее сорбирующийся компонент А будет занимать нижнюю часть. Типичная выходная кривая изображена на рис.14.
В газе или растворе, вытекающем из колонки, сначала появляется компонент А, далее – чистый растворитель, а затем компонент В. Чем больше концентрация компонента, тем выше пик и больше его площадь, что составляет основу количественного хроматографического анализа. Проявительный метод дает возможность разделять сложные смеси, он наиболее часто применяется в практике. Недостатком метода является уменьшение концентрации выходящих растворов за счет разбавления растворителем (газом-носителем).
Вытеснительный метод. В этом методе анализируемую смесь компонентов А и В в растворителе Solv вводят в колонку и промывают раствором вещества D (вытеснитель), которое сорбируется лучше, чем любой из компонентов анализируемой смеси.
Концентрация раствора при хроматографировании не уменьшается в отличие от проявительного метода. Существенным недостатком вытеснительного метода является частое наложение зоны одного вещества на зону другого, поскольку зоны компонентов в этом методе не разделены зоной растворителя.
Хроматографический пик и элюционные характеристики
В хроматографии чаще всего используют методику проявительного (элюэнтного) анализа, при которой газ или раствор, выходящий из колонки, анализируется непрерывно. Типичная выходная кривая (хроматограмма) проявительного анализа приведена на рис.14. Рассмотрим ее более подробно (рис.15).
Если точка А' соответствует вводу анализируемой пробы, А – появлению на выходе какого-то несорбирующегося компонента, а В – появлению анализируемого вещества, то линию А'АВ и ее продолжение ВF называют нулевой линией. Кривую ВDF называют хроматографическим пиком и характеризуют высотой, шириной и ллощадью. С удовлетворительной точностью контур пика описывается уравнением Гаусса:
с = сmaxe 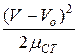 , (7)
, (7)
где V – объем подвижной фазы;
V0 – объем подвижной фазы, соответствующий сmax;
μст – стандартное отклонение, равное полуширине пика при 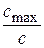 = е1/2.
= е1/2.
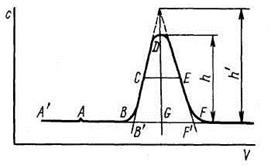
Рис.15. Кривая проявительного анализа (хроматографический пик)
Высотой пика считают либо величину h, либо h' (см. рис.15). Последняя равна расстоянию от нулевой линии до точки пересечения касательных к кривой в точках перегиба. Шириной пика называют расстояние между точками контура на половине его высоты (СЕ = μ0,5) или на какой-то другой отметке по высоте, либо расстояние между точками перегиба (μn) или между точками пересечения нулевой линии с касательными к кривой в точках перегиба (В'F'=μк=ω). Соотношения между этими величинами хорошо известны:
μ0,5 = 2,36μст; μn = 0,850μ0,5 = 2μст;
μк = 1,700μ0,5 = ω = 4μст. (8)
Важной хроматографической характеристикой системы является время удерживания или пропорциональный ему удерживаемый объем. На рис.15 приведенному удерживаемому объему соответствует отрезок AG, а общий удерживаемый объем характеризуется отрезком А'G.
Если длину отрезка А'G обозначить l, то время удерживания tr будет равно:
tr = l/U,
где U – скорость движения ленты самописца.
Удерживаемый объем Vr пропорционален времени удерживания tr:
Vr = trω,
где ω – объемная скорость газа-носителя.
Приведенный удерживаемый объем V'r, соответствующий отрезку АG, определяется соотношением:
V'r = Vr – V0,
где V0 ‑ пропорционален отрезку АА', длина которого l0.
Величина V0 характеризует удерживаемый объем несорбирующего газа, или мертвый обмен колонки.
Приведенному удерживаемому объему соответствует приведенное время удерживания t'r:
t'r = tr – t0,
где t0, пропорциональное величине l0, характеризует время удерживания несорбирующегося газа.
Произведение приведенного удерживаемого объема V'r на коэффициент сжимаемости j называют эффективным удерживаемым объемом Vэфф:
Vэфф = V'rj.
Коэффициент сжимаемости:
j = 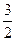
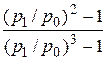 ,
,
где р1 и р0 – соответственно давление на входе в колонку и на выходе из нее.
Важной характеристикой является абсолютный удельный удерживаемый объем Vm, рассчитываемый по формуле:
Vm = 
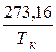 , (9)
, (9)
где m – масса адсорбента; Тк – температура колонки.
Величина Vm не зависит от геометрических параметров колонки и может быть использована для качественной характеристики системы адсорбент – адсорбированный газ. Однако на эту величину заметное влияние оказывают случайные факторы. В значительно меньшей степени они влияют на относительный удерживаемый объем, равный отношению абсолютно удельного удерживаемого объема исследуемого вещества Vm,i к соответствующему объему вещества, принятого за стандарт, Vm.ст:
Vотн = 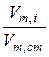 . (10)
. (10)
Значения относительных удерживаемых объемов приводится в справочных таблицах.
Полнота разделения двух компонентов количественно может быть выражена критерием разделения К:
К = 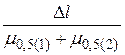 =
= 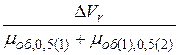 , (11)
, (11)
где ∆l или ∆Vr – расстояние между максимумами пиков разделяемых элементов;
μ0,5 – полуширина хроматографического пика первого (1) и второго (2) компонентов на половине высоты, а нижний индекс «об» указывает на объемные единицы измерения.
При К = 1 разделение бывает достаточно полным.
Если допустить, что ширина хроматографического пика обоих компонентов примерно одинакова, т.е. μ1≈μ2, уравнение (11) принимает вид:
К= 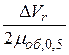 .
.
При взаимном перекрывании пиков определение ширины зоны каждого пика становится невозможным (рис.16). В таких случаях рассматривают степень разделения Ψ:
Ψ = (h2-hmin)/h2, (12)
где h2 – высота пика вещества, имеющего меньшую концентрацию;
hmin – высота минимума.
Значение тех или иных элюционных характеристик меняется в зависимости от цели анализа. В качественном анализе основное внимание уделяется определению характеристик удерживания и устранению искажений этих величин за счет второго компонента. В количественном анализе важно, чтобы четкость разделения обеспечивала достаточную точность определения площади или высоты хроматографического пика.
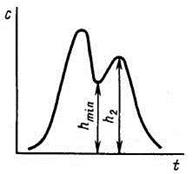
Рис.16. Определение степени разделения Ψ
Основные узлы приборов для хроматографического анализа
Отечественная промышленность и зарубежные фирмы выпускают большое количество хроматографов самых различных типов. Однако сложные хроматографические установки требуются не всегда. Для проведения хроматографического разделения методами бумажной, тонкослойной и некоторыми другими видами хроматографии используются простые установки, которые могут быть собраны в любой химической лаборатории. Независимо от сложности устройства основными узлами хроматографической установки являются дозатор (система ввода пробы), хроматографическая колонка и детектор. Кроме того, в установке имеются устройства для подачи газа-носителя или растворителя, для преобразования импульса детектора в соответствующий сигнал и некоторые другие.
Дозатор предназначен для точного количественного отбора пробы и введения в ее в хроматографическую колонку. Одним из основных требований к дозатору является воспроизводимость размера пробы и постоянство условий ее введения в колонку. Кроме того, введение пробы не должно вызывать резкого изменения условий работы колонки и других узлов хроматографической установки, а внутренняя поверхность дозатора не должна обладать каталитической или адсорбционной активностью по отношению к пробе.
Газообразные и жидкие пробы обычно вводят с помощью специальных шприцев, прокалывая в месте ввода пробы каучуковую мембрану. Применяются газовые шприцы для газообразных проб и микрошприцы для жидких. Микрошприцы позволяют вводить в хроматограф пробы объемом от долей до десятков микролитров. Нередко в лабораторной практике в качестве дозатора применяется медицинский шприц.
Твердые пробы вводятся в хроматограф или после перевода их в раствор, или непосредственным испарением пробы в нагретом дозаторе, куда она вводится с помощью игольного ушка. Известны и другие устройства.
В хроматографической колонке происходит разделение компонентов. Колонки весьма различны по форме, размерам и конструкционным материалам. Применяются прямые, спиральные и другие колонки длиной от 1÷2 м (и менее) и до нескольких десятков метров. Внутренний диаметр колонок составляет обычно несколько миллиметров. В зависимости от свойств анализируемой системы в качестве конструкционных материалов для колонок чаще всего используют сталь, латунь, медь, стекло и др. Материал колонки должен обладать определенной химической инертностью по отношению к компонентам пробы, например, медные колонки будут непригодны при разделении ацетиленсодержащих смесей.
Адсорбент, наполняющий колонку, должен обладать рядом свойств: необходимой селективностью, достаточной механической прочностью, химической инертностью к компонентам смеси и быть доступным. Практически в качестве адсорбентов используются оксид алюминия, силикагели, активированные угли, пористые полимеры на основе стирола, дивинилбензола и т.д. и синтетические цеолиты. Широко используют модифицированные адсорбенты, которые получают обработкой исходных адсорбентов растворами кислот, щелочей, неорганических солей и т.д. Выбор адсорбента зависит от агрегатного состояния фаз, методики хроматографирования и других факторов.
Большое влияние на сорбируемость газа оказывает температура, поэтому хроматографические колонки, как правило, термостатируются, используя обогрев жидкостью или парами кипящей жидкости, воздушное термостатирование или какой-либо другой прием. Обычно термостатирование производится при температурах, значительно превышающих комнатные, однако в некоторых случаях создаются температуры ниже 0о С при разделении низкокипящих газов. В бумажной, тонкослойной и некоторых других видах хроматографии функцию колонки выполняет хроматографическая бумага, тонкий слой сорбента на подложке и т.д.
Детектор предназначен для обнаружения изменений в составе газа, прошедшего через колонку. Показания детектора обычно преобразуются в электрический сигнал и передаются фиксирующему или записывающему прибору, например на ленту электронного потенциометра. Основными характеристиками детектора являются чувствительность, пределы детектирования, инерционность и диапазон линейной зависимости между концентрацией и величиной сигнала. Детекторы подразделяются на дифференциальные, которые отражают мгновенное изменение концентрации, и интегральные, суммирующие изменения концентрации за некоторый отрезок времени.
В интегральных детекторах анализируемый газ на выходе из колонки поглощается каким-либо раствором, а затем анализируется или поглощающий раствор или оставшийся непоглощенный газ. Если носителем является диоксид углерода, то после колонки газ барботируется через раствор щелочи и измеряется объем газа, не поглощенного этой жидкостью. Достоинствами интегральных детекторов являются их простота и широкая область линейной зависимости показаний детектора от количества вещества. К недостаткам относятся значительная инерционность и низкая чувствительность, в связи с чем, такие детекторы в настоящее время применяются редко.
К группе дифференциальных относятся детекторы по теплопроводности (катарометр), по плотности, по электрической проводимости, пламенный, пламенно-ионизационный (ПИД) и другие ионизационные детекторы, термохимический, пламенно-фотометрический и т.д. Детектор выбирают в зависимости от свойств изучаемой системы, агрегатного состояния фаз и других особенностей.
Подвижной фазой в газовой хроматографии является газ или пар. В зависимости от состояния неподвижной фазы газовая хроматография подразделяется на газо-адсорбционную, когда неподвижной фазой является твердый адсорбент, и газо-жидкостную, когда неподвижной фазой является жидкость, а точнее пленка жидкости на поверхности частиц твердого сорбента.
Как уже отмечалось, в качестве дозаторов в газовой хроматографии используются шприцы и микрошприцы.
|
|
|
|
|
Дата добавления: 2017-01-14; Просмотров: 556; Нарушение авторских прав?; Мы поможем в написании вашей работы!