
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Другий вид роботи — прогресивна зачіска 1 страница
|
|
|
|
Захист
Хід роботи
Захист
Хід роботи
Захист
Хід роботи
Захист
Хід роботи
Захист
Хід роботи
Захист
Хід роботи
Захист
Хід роботи
Захист
Хід роботи
Захист
Хід роботи
Захист
Хід роботи
Захист
Хід роботи
Захист
Хід роботи
Захист
Хід роботи
Захист
Хід роботи
Захист
Хід роботи
Захист
Хід роботи
Захист
Хід роботи
Захист
Хід роботи
Захист
Хід роботи
Захист
Хід роботи
Захист
Хід роботи
1. Приготування стандартизованого розчину гідроксиду калію або натрію.
Гідрооксид калію або натрію – речовина гігроскопічна вбирає з повітря діоксиду вуглецю, отже, не відповідний вимогам, пред’явленим до речовини. Готовиться методом приблизної наважки.
Розрахунок еквівалентної маси КОН (NaOH): ______________________
________________________________________________________
Розрахунок наважки гідроксиду калію (натрію) робимо за формулою:
q =  , г
, г
де Секв – еквівалентна молярна концентрація, моль·екв/дм3 (дорівнює 0,1);
q – наважка речовини, г;
Е – еквівалентна маса, г/моль;
V – об’єм, см3 (дорівнює 500).
________________________________________________________________________________________________________________
На т/х терезах зважуємо суха чиста фарфорова чашка, масу уточнюємо на аналітичних терезах. До зваженої фарфорової чашки додаємо розраховану наважку лугу та зважуємо на т/х терезах, уточнюємо масу на аналітичних терезах. Результати заносять у таблицю.
| № | Зважуємий предмет | Маса на т/х терезах, гр | Маса на аналітичних терезах, гр |
| Порожня фарфорова чашка | |||
| Наважка лугу | |||
| Чашка з наважкою |
При роботі з лугом потрібно дотримуватися правил безпеки. Луги потрібно брати сухими шпателями, обережно, не розсипаючи на стіл, терези та чашка повинні бути сухими. Зважену кількість речовини обережно через воронку переносимо в ємкість на 500 см3 розчиняючи у дистильованій воді, розчин перемішати, обережно закрити кришкою, оформити етикеткою, покласти в відведене місце.
2. Приготування стандартного розчину щавлевої кислоти.
Для приготування стандартного розчину щавлевої кислоти користуємося сухою щавлевою кислотою.
Складаємо рівняння реакції
Н2С2О4 + КОН = К2С2О4 + 2Н2О
Розрахунок еквівалентної маси щавлевої кислоти: ___________________
________________________________________________________
Розрахунок наважки щавлевої кислоти робимо за формулою:
q =  , г
, г
де Секв – еквівалентна молярна концентрація, моль·екв/дм3 (дорівнює 0,1);
q – наважка речовини, г;
Е – еквівалентна маса, г/моль;
V – об’єм, см3 (дорівнює 100).
________________________________________________________________________________________________________________
На т/х терезах зважуємо суха чиста фарфорова чашка, масу уточнюємо на аналітичних терезах. До зваженої фарфорової чашки додаємо розраховану наважку щавлевої кислоти та зважуємо на т/х терезах, уточнюємо масу на аналітичних терезах. Результати заносять у таблицю.
| № | Зважуємий предмет | Маса на т/х терезах, гр | Маса на аналітичних терезах, гр |
| Порожня фарфорова чашка | |||
| Наважка С2Н2О4 | |||
| Чашка з наважкою |
3. Визначення еквівалентної молярної концентрації розчину гідроксиду калію або натрію по стандартному розчину щавлевої кислоти.
По величині точної наважки щавлевої кислоти ведемо розрахунок точної еквівалентної молярної концентрації оксалатної кислоти
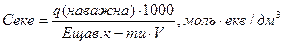
де q – наважка речовини, г;
Е – еквівалентна маса, г/моль;
V – об’єм, см3 (дорівнює 100).
________________________________________________________________________________________________________________
Обираємо індикатор: у випадку титрування слабої кислоти розчинником сильного гідрооксиду момент еквівалентних настань при рН більше 7, у лужному середовищі при такому значенні рН змінює забарвлення індикатора фенолфталеїну, який і обираємо у цьому випадку титрування.
Для визначення еквівалентної молярної концентрації розчину гідрооксиду натрію або калію, промиваємо бюретку розчином, обережно заповнюють її до нульового ділення по нижньому меніску, перевірив заповнення капіляру, виймають із бюретки мікроворонку. Піпеткою шляхом висмоктування рідини вище мітки набираємо розчин щавлевої кислоти, потім, прикрив отвір піпетки вказівним пальцем правої руки, доводимо рівень розчину кислоти у піпетці до відмітки по нижньому меніску, переносимо виміряний піпеткою об’єм кислоти у колбу для титрування, додаємо 2-3 краплини фенолфталеїну і титруємо розчином гідрооксиду калію або натрію до появи блідо-рожевого забарвлення, після кожного титрування рівень гідрооксиду калію або натрію доводимо до нульового ділення. Титруємо 3 правильних рази.
Результати титрування заносимо у таблицю (результати записуємо тільки тоді, якщо розходження між титруваннями не більше, чим 0,2 см3.)
| Щавлева кислота | Гідрооксид натрію або калію |
| Секв = V = об’єм піпетки, см3 | V1 =
V2 =
V3 =
 = =
 =
Т = =
Т =  = =
|
Контрольні питання:
1. Які способи фіксування моменту еквіваленту у кислотно-основному титруванні?
2. Які вимоги до вихідних речовинах у титрометричному аналізі?
3. Якою характеристикою індикаторів керуються при його обранні?
4. Який фізичний титр робочого розчину по визначені речовини?
5. Які причини можливих помилок, отриманих по результатам титрування?
6. Які стандартні розчини та індикатори використовують при титруванні у кислотно-основному титрування?
7. Як готують стандартні розчини кислот?
8. Як готують стандартизовані розчини лугів?
________________________________________________________________________________________________________________
Оцінка викладача: ________________________________________________________
Лабораторна робота № 9
Тема: «Визначення еквівалентності молярної концентрації розчину сильної кислоти з використанням стандартизованого розчину гідрооксиду калію.»
Мета: закріпити навики кислотно-основного титрування, засвоїти методику виконування контрольних визначень титрометричного аналізу і розрахунків пов’язаних з ним.
Прилади та реактиви: стандартизований розчин гідрооксиду калію або натрію, мірна колба ємкістю на 100 см3, індикатор – фенолфталеїн, бюретка, воронки, пінетка, колби для титрування, розчин кислоти соляної або сірчаної.
Концентровані кислоти у методі кислотно-основного титрування проводяться методом прямого титрування: до точного об’єму розчину кислоти додаємо еквівалентний об’єм розчину гідроксиду калію або натрію до початку моменту закінчення реакції.
Досліджуваний розчин соляної або сірчаної кислоти отримують у мірній колбі: ємкістю 100 см3, потім розводять дистильованою водою до кільцевої метки по нижньому меніску. Після вирівняння концентрації потрібно піпеткою відібрати точний об’єм розведеного розчину соляної або сірчаної кислоти у колбу для титрування. У цю колбу додають 2-3 краплі фенолфталеїну. Бюретка заповнюємо розчином гідрооксиду калію або натрію, точна еквівалентна концентрація якого вже виявила у попередній роботі, після цього можна приступати до титрування, обережно до появи блідо-рожевого забарвлення, яке не зникаючий протягом 1 хвилини. По бюретці відмічають точний об’єм гідрооксиду калію або натрію, який пішов на титрування. Титрування, як правило проводять 3 правильних рази, отримані результати заносять у таблицю:
| КОН (NaOH) | НСІ (H2SO4) |
Секв = з роботи № 8
V1 =
V2 =
V3 =
 = =
| Vзаг. = 100 см3
V = об’єм піпетки, см3
 =
Е НСІ =
q = =
Е НСІ =
q =  = =
|
Контрольні питання:
1. Які існують способи приготування титрантів у методі кислотно-основного титрування?
2. Які розчини методи являються стандартними? Чому?
3. Титрування до стандартних речовин?
4. Методика приготування розчину кислот методом розбавлення.
5. Поясніть причину вибору метил оранжевого у випадку титрування тетраборату натрію і розчину соляної або сірчаної кислоти.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Оцінка викладача: _______________________________________________________
Лабораторна робота № 10
Тема: «Приготування стандартизованого розчину сильної кислоти.
Приготування стандартного розчину тетраборату натрію.
Виявлення еквівалентної молярної концентрації розчину сильної кислоти
з використанням стандартного розчину тетраборату натрію.»
Мета: засвоїти приготування розчину сильних кислот методом розведення, закріпити навики приготування стандартних розчинів, вибір індикатору, титрування і розрахунки пов’язані з ним.
Прилади та реактиви: циліндр з розчином кислоти (соляної або сірчаної), ареометр, суха бура (тетраборат натрію), т/х та аналітичні терези і різноваги до них, фарфорова чашка, плитка, мірні колби на 100 см3, воронки, колби для титрування, циліндри, титрувальні установки, індикатор - метилоранж, дистильована вода.
1. Приготування стандартизованого розчину сильної кислоти.
Кислоту, яку потрібно розбавити, наливають у циліндр, опускають у нього ареометр для виміру щільності розчину кислоти.
Визначив густину по таблиці довідника (для соляної кислоти дорівнює 1,19; для сірчаної кислоти дорівнює 1,814), знайдемо титр розчину.
Розрахунок титру:  , г/моль
, г/моль
де ρ – густина розчину, г/см3;
а – масова частка (для НСІ = 38%; для Н2SO4 = 90%), %.
________________________________________________________________________________________________________________
Розрахунок еквівалентної маси кислоти: _________________________
____________________________________________________
Розрахунок еквівалентної молярної концентрації концентрованої кислоти:
Секв. конц. =  , моль·екв/дм3
, моль·екв/дм3
де Т – титр, г/см3;
Е – еквівалентна маса кислоти, г/моль.
________________________________________________________________________________________________________________
Виявив еквівалентну молекулярну концентрацію розчину кислоти, яку потрібно розвести. Можна по формулі закону еквіваленту визначити об’єм цієї кислоти, який необхідний для приготування 500 см3 розчину кислоти з еквівалентною молекулярною концентрацією 0,1 моль·екв/дм3.
 , см3
, см3
________________________________________________________________________________________________________________
Розрахований об’єм відміряємо циліндром, переносимо у чисту склянку і розводимо дистильованою водою по мітку (приблизно), так як точну концентрацію цього розчину ми виявляємо шляхом титрування.
2. Приготування стандартного розчину тетраборату натрію.
Розчин готуємо у мірній колбі ємкістю 100 см3.
Розрахунок еквівалентної маси тетраборату натрію: _________________
________________________________________________________________________________________________________________
Розрахунок наважки тетраборату натрію робимо за формулою:
q =  , г
, г
де Секв – еквівалентна молярна концентрація, моль·екв/дм3 (дорівнює 0,1);
q – наважка речовини, г;
Е – еквівалентна маса, г/моль;
V – об’єм, см3 (дорівнює 100).
________________________________________________________________________________________________________________
Розрахована наважка важиться на т/х та аналітичних терезах, переносимо її через воронку у мірну колбу заданого об’єму, після повного розчинення у гарячій дистильованій воді і холодною водою доводимо об’єм розчину до мітки за допомогою піпетки, після чого вирівнюємо концентрацію.
Усі результати записуємо у таблицю
| № | Зважуємий предмет | Маса на т/х терезах, гр | Маса на аналітичних терезах, гр |
| Порожня фарфорова чашка | |||
| Наважка тетраборату натрію | |||
| Чашка з наважкою |
По величині точної наважки бури ведемо розрахунок точної еквівалентної молярної концентрації

де q – наважка речовини, г;
Е – еквівалентна маса, г/моль;
V – об’єм, см3 (дорівнює 100).
________________________________________________________________________________________________________________
3. Визначення еквівалентної молярної концентрації розчину кислоти з використанням стандартного розчину тетраборату натрію.
Тетраборат натрію – це сіль слабкої кислоти та сильного гідроксиду, піддається гідролізу внаслідок якого має слабо лужне середовище, а титрувати потрібно сильною кислотою, тому момент еквівалентності пройде у кислому середовищі. При рН менше 7 змінює своє забарвлення метилоранжів, тому він і буде індикатором у даному випадку титрування.
Бюретку заповнюємо розчином кислоти, точку еквівалентності якої потрібно визначити. Пам’ятайте, що бюретку треба заповнювати через мікроворонку, яку потрібно зразу ж вийняти, треба перевірити заповнювання капіляру, на рівні очей довести рівень розчину в бюретці до нульового ділення по нижньому меніску.
В колбу для титрування пінеткою виміряємо точний об’єм розчину тетраборату натрію, додати 1-2 краплини індикатору метилоранжу і титруємо розчином сильної кислоти з бюретки до змінення забарвлення з жовтого на блідо рожеве.
Титрування проводимо 3 правильних рази.
Результати записуємо у таблицю і виконуємо необхідні розрахунки
| Na2B4O7 · 10H2O | НСІ (H2SO4) |
| Секв = V = об’єм піпетки, см3 | V1 =
V2 =
V3 =
 = =
 =
Т = =
Т =  =
К = =
К =  = =
|
Контрольні питання:
1. Вибір індикаторів у методі кислотно-основного титрування.
2. Розрахункові формули для визначення еквівалентної молярної концентрації стандартизованого розчину.
3. Гідроліз солей.
________________________________________________________________________________________________________________
Оцінка викладача: ________________________________________________________
Лабораторна робота № 11
Тема: «Виявлення вмісту лугу у досліджуємому розчині.»
Мета: засвоїти методику визначення вмісту лугу і вміти розраховувати кількість лугу у досліджуємому розчині.
Прилади та реактиви: стандартизований розчин сильної кислоти, мірна колба ємкістю на 100 см3, індикатор – метилоранж, бюретка, воронки, пінетка, колби для титрування, розчин лугу.
Контрольне виявлення методу кислотно-основного титрування, проводиться методом прямого титрування.
У даному випадку титрування потрібно проводити від кислоти до гідрооксиду калію або натрію. Для цього бюретку заповнюємо розчином кислоти, точна концентрація якого вже відома у лабораторній роботі № 10.
Досліджуємий розчин лугу отримуємо у мірній колбі об’ємом 100 см3, розводимо дистильованою водою до мітки і вирівнюємо концентрацію.
У колбу для титрування відміряємо точний об’єм розчину лугу піпеткою, додаємо 1-2 краплини метилоранжу і титруємо розчином кислоти до змінення жовтого забарвлення на блідо-рожеве. Титрування проводимо 3 правильних рази. Результати заносять у таблицю і виконують необхідні розрахунки.
| НСІ (H2SO4) | NaОH (КОН) |
Ceкв = з роботи № 10
V1 =
V2 =
V3 =
 = =
| Vзаг. = 100 см3
V = об’єм піпетки, см3
 =
Е лугу =
q = =
Е лугу =
q =  = =
|
Контрольні питання:
1. Метод прямого титрування, його характеристика.
2. Метод нейтралізації, його характеристика.
3. Рівняння реакції, яке лежить в основі даної лабораторної роботи.
________________________________________________________________________________________________________________
Оцінка викладача: ________________________________________________________
Лабораторна робота № 12
Тема: «Виявлення усувної твердості води.»
Мета: навчитися контролювати якість сировини харчової промисловості.
Прилади та реактиви: титрувальні установки, досліджуєма вода, розчин кислоти з відомою еквівалентною молярною концентрацією, індикатор метилоранж, мірні колби об’ємом 100 см3, піпетки.
Твердість зумовлюється наявністю у воді солей кальцію або магнію.
Твердість буває двох видів: карбонатна (усувна). Вона зумовлюється наявністю у воді гідрокарбонатів кальцію або магнію. А також не карбонатна (постійна). Вона зумовлюється наявністю у воді хлоридів і сульфатів кальцію або магнію. Карбонатна твердість усувається кип’ятінням, а не карбонатна тільки хімічним або фізико-хімічним шляхами.
Cа(HCO3)2 → CaCO3 + H2O + CO2
Карбонатна твердість виявляється шляхом титрування розчином кислоти з відомою еквівалентною молярною концентрацією (з лабораторної роботи № 10) у присутності метилоранжу.
Ca(HCO3)2 + 2HCl → CaCl2 + 2H2O + 2CO2
В колбу для титрування мірною колбою, ємкістю 100 см3 відміряємо воду, яка потребує аналізу, додаємо 2-3 краплини метилоранжу і титруємо з бюретки розчином сірчаної або соляної кислоти до змінення забарвлення індикатору з блідо-жовтого на блідо-рожеве. Титруємо 3 правильних рази.
Записуємо результат титрування у таблицю.
| НСІ (H2SO4) | Н2О |
Ceкв = з роботи № 10
V1 =
V2 =
V3 =
 = =
| Vзаг. = 100 см3

|
Контрольні питання:
1. Що таке жорсткість?
2. Які види хлористі вам відомі?
3. Як виявляється і усувається карбонатна жорсткість?
4. Якими солями обумовлюється карбонатна жорсткість і як вона усувається?
________________________________________________________________________________________________________________
Оцінка викладача: ________________________________________________________
Лабораторна робота № 13
Тема: «Визначення еквівалентної молярної концентрації розчину перманганату калію з використанням стандартного розчину щавлевої кислоти.»
Мета: закріпити навики розрахунку величини наважок, зважування і розчинення їх, освоїти методику перманганатометричного титрування і розрахунків пов’язаних з ним.
Прилади та реактиви: терези т/х і різноваги до них, плітки електричні, мірні колби на 100 см3, склянки, титрувальні установки, воронки, суха щавлева кислота, сухий перманганат калію, розчин сірчаної кислоти, циліндри.
Рівняння окисно-відновної реакції:
2KMnO4 + 5H2C2O4 + 8H2SO4 → H2SO4 + 2MnSO4 +10CO2 + 8H20
C2O42- - 2e → 2CO2 │5
MnO4- + 8H+ 5e → Mn2+ + 4H2O │2
Розчин перманганату калію є стандартизованим, тому що не відповідає вимогам, які пред’являються до вихідних речовин. Розчин готується методом приблизної наважки, так як він змінює свою концентрацію при зберіганні.
Розрахунок еквівалентної маси перманганату калію: _________________
________________________________________________________
Розрахунок наважки перманганату калію робимо за формулою:
q =  , г
, г
де Секв – еквівалентна молярна концентрація, моль·екв/дм3 (дорівнює 0,025);
q – наважка речовини, г;
Е – еквівалентна маса, г/моль;
V – об’єм, см3 (дорівнює 500).
________________________________________________________________________________________________________________
Розчин щавлевої кислоти є стандартним, тому готують його методом точної наважки.
Розрахунок еквівалентної маси щавлевої кислоти: ___________________
________________________________________________________
Розрахунок наважки щавлевої кислоти робимо за формулою:
q =  , г
, г
де Секв – еквівалентна молярна концентрація, моль·екв/дм3 (дорівнює 0,025);
q – наважка речовини, г;
Е – еквівалентна маса, г/моль;
V – об’єм, см3 (дорівнює 100).
________________________________________________________________________________________________________________
По величині наважки розраховуємо еквівалентну молярну концентрацію щавлевої кислоти:

де q – наважка речовини, г;
Е – еквівалентна маса, г/моль;
V – об’єм, см3 (дорівнює 100).
________________________________________________________________________________________________________________
Для виявлення еквівалентної молярної концентрації розчину перманганату калію, розчином перманганату калію заповнюють бюретку, нульове ділення встановлюємо по верхньому меніску.
У колбу для титрування піпеткою відміряємо точний об’єм розчину щавлевої кислоти і додаємо такий же об’єм розчину сірчаної або соляної кислоти, яку відміряємо циліндром. Відновну суміш нагріваємо на плитці до температури 89-900С (не доводити до кипіння, так як щавлева кислота при кипінні розкладається).
Гаряча відновна суміш титрується розчином перманганату калію дуже швидко, але по краплям. Це означає, що кожну краплину перманганату калію потрібно додати після обезбарвлення, тому, що можливо, що дана окисно-відновна реакція піде по іншому шляху. У цієї реакції сульфату марганцю одночасно є каталізатором. Момент еквівалентності настає у момент забарвлення реагуючої суміші у блідо-рожевий колір. Титрування проводять 3 правильних рази.
Результати заносять у таблицю.
| H2C2O4 · 2H2O | KMnO4 |
| Ceкв = V = об’єм піпетки, см3 | V1 =
V2 =
V3 =
 = =
 = =
|
Виявлена шляхом титрування еквівалентна молярна концентрація розчину KMnO4 використовується у 2 наступних роботах.
Контрольні питання:
1. Сутність оксидиметрії? Виявлення еквівалентів-окислювачів та відновників?
2. Особливості виявлення еквівалентів-окислювачів та відновників?
3. Принцип класифікації оксидиметрії?
4. Особливості перманганатометрії.
5. Окислювальна особливість перманганату калію у різних середовищах.
6. Особливості титрування перманганату калію по щавлевій кислоті.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Оцінка викладача: ________________________________________________________
Лабораторна робота № 14
Тема: «Визначення вмісту заліза у розчині солі Мора.»
Мета: засвоїти визначення відновників у методі перманганатометрії та розрахунки пов’язані з ним.
Прилади та реактиви: титрувальні установки, мірні колби на 100 см3 з розчином для дослідження, циліндри, розчин перманганату калію з визначеною еквівалентною молярною концентрацією, розчин сірчаної кислоти, дистильована вода.
|
|
|
|
|
Дата добавления: 2017-01-14; Просмотров: 166; Нарушение авторских прав?; Мы поможем в написании вашей работы!