
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Другий вид роботи — прогресивна зачіска 2 страница
|
|
|
|
Розчин солі Мора – це розчин солі (NH4)2 · Fe(SO4)2 · 6H2O.
Відновники у методі пермаганатометрії визначаються методом прямого титрування. Це означає, що до точного об’єму невідомого відновника додають еквівалентний об’єм відомого окислювача.
10FeSO4 + 2KMnO4 + 8H2SO4 = 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
2Fe2+ - 2e = 2Fe3+ │5
MnO4- + 8H+ + 5e = Mn2+ │2
Отриманий розчин, який досліджуємо розчиняємо дистильованою водою до мітки і вирівнюємо концентрацію.
У колбу для титрування піпеткою відміряємо точний об’єм досліджуємого розчину і додаємо циліндром такий же об’єм розчину сірчаної або соляної кислоти. Відновник титрують розчином перманганату калію при нормальних умовах до з’явлення блідо-рожевого забарвлення. Титрування проводять 3 правильних рази. Результати титрування заносять у таблицю.
| KMnO4 | FeSO4 |
Ceкв = з роботи № 13
V1 =
V2 =
V3 =
 = =
| Vзаг. = 100 см3
V = об’єм піпетки, см3
 =
Е =
Е 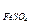 =
Е заліза =
q = =
Е заліза =
q = 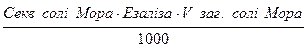 = =
|
Контрольні питання:
1. В чому сутність титрометричного аналізу?
2. Визначення відновників методом перманганатометрії.
3. Подвійні солі, їх характеристика.
4. Розрахункові формули.
________________________________________________________________________________________________________________
Оцінка викладача: ________________________________________________________
Лабораторна робота № 15
Тема: «Визначення еквівалентної молярної концентрації розчину дихромату калію з використанням стандартного розчину перманганату калію.»
Мета: засвоїти визначення відновників у методі перманганатометрії методом зворотного титрування та розрахунки пов’язані з ним.
Прилади та реактиви: титрувальні установки, мірні колби на 100 см3, циліндри, розчин перманганату калію з визначеною еквівалентною молярною концентрацією, розчин сірчаної кислоти, дистильована вода.
В основі даної лабораторної роботи лежать окисно-відновні реакції:
K2Cr2O7 + 6FeSO4 + 7H2SO4 = K2SO4 + Fe2 (SO4)3 + Cr2 (SO4)3 + 7H2O
Cr2O72- + 14H+ + 6e = 2Cr3+ +7H2O │1
2Fe2+ - 2e = 2Fe3+ │3
Розрахунок еквівалентної маси дихромату калію: ___________________
________________________________________________________
10FeSO4 + 2KMnO4 + 8H2SO4 = 5Fe (SO4)3 + K2SO4 + 2MnSO4 + 8H2O
2Fe2+ - 2e = 2Fe3+ │5
MnO4- + 8H+ + 5e = Mn2+ + 4H2O │2
Бюретку заповнюємо розчином перманганату калію, у колбу для титрування піпеткою відмірюється точний об’єм розчину дихромату калію, додаємо до нього подвійний об’єм розчину солі Мора (2 піпетки) з відомою еквівалентною молярною концентрацією та розчин сірчаної або соляної кислоти такий же об’єм відмірений циліндром. Реакційна суміш змінює своє забарвлення внаслідок того, що в розчині замість іонів Cr2O72- з’являються іони Cr3+, цю суміш титрують розчином перманганату калію до появлення рожево-сірого забарвлення (комір каменя олександріт). Титрування проводять 3-4 рази:
| K2Cr2O7 | FeSO4 | KMnO4 |
| V = об’єм піпетки, см3 | Vзаг. = об’єм піпетки, см3 Секв = 0,025 моль·екв/дм3 | Секв = з роботи № 13
V1 =
V2 =
V3 =
 = =
|
1. Розрахунок об’єму солі Мора, який взаємодіє з перманганатом калію за рівнянням:
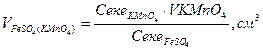
________________________________________________________________________________________________________________________________________________________________________
2. Знаючи загальний об’єм солі Мора і об’єм солі Мора по перманганату калію, по різниці визначаємо об’єм сульфату заліза по дихромату калію.
V 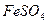 /(
/(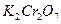 ) = VFeSO4(заг) – VFeSO4 /(KMnO4), см3
) = VFeSO4(заг) – VFeSO4 /(KMnO4), см3
________________________________________________________________________________________________________________
3. Розрахунок еквівалентної молярної концентрації розчину дихромату калію за рівнянням:
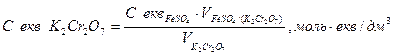
________________________________________________________________________________________________________________________________________________________________________
Контрольні питання:
1. Сутність титрометричного аналізу.
2. Які речовини титрують прямим, а які зворотнім титрування.
3. Галузі використання перманганатометрії.
4. Які речовини утворюються при доданні розчину солі Мора до розчину дихромату калію.
________________________________________________________________________________________________________________
Оцінка викладача: ________________________________________________________
Лабораторна робота № 16
Тема: «Приготування стандартизованого розчину тіосульфату натрію. Приготування стандартного розчину дихромату кальцію. Визначення еквівалентної молярної концентрації розчину тіосульфату натрію з використанням стандартного розчин.»
Мета: закріпити навики, пов’язані з приготуванням титрантів. Засвоїти методику йодометричного титрування.
Прилади та реактиви: терези та різноваги до них (т/х та аналітичні), мірні колбі, воронки, чашки фарфорові, дихромат калію, дистильована вода, розчини сірчаної кислоти, йодид калію, скла, розчин крохмалю (свіже приготовлений).
Метод йодометрії має ряд особливостей: йод леткий і тому усі йодометричні виміри проводять на холоді у нейтральному або кислому середовищі. Індикатором у йодометрії є крохмаль, який на відміну від інших індикаторів, вводять у розчин у кінці титрування, тому, що якщо ввести розчин крохмалю з початку титрування, йод адсорбується крохмалем і титрування буде не вірним.
Стандартним розчином йод не може бути, так як не відповідає вимогам вихідної речовини.
Розчин йоду, у даному випадку, може бути і розчином окислювача і розчином відновника. У тому випадку коли йод виступає у ролі окислювача, у ролі відновника виступає розчин тіосульфату натрію, але цей розчин не може бути стандартним, а лише стандартизованим, тому, що при зберіганні реагує з діоксидом вуглецю і водою, при цьому змінює свою молярну концентрацію. Обидва титранти йодометричного аналізу є стандартизованими, тому на допомогу приходить метод титрування по заміннику.
Сутність методу по заміннику заключається у тому, що відомі окислювачі із розчину йодиду калію (йод-відновник) у кислому середовищі витискує еквівалентну кількість йоду, яка потім відтитровується еквівалентним об’ємом тіосульфату натрію, тому що 2 речовини еквівалентні між собою.
1. Приготування стандартизованого розчину тіосульфату натрію.
Готовиться методом приблизної наважки.
Розрахунок еквівалентної маси тіосульфату натрію: _________________
________________________________________________________
Розрахунок наважки тіосульфату натрію робимо за формулою:
q =  , г
, г
де Секв – еквівалентна молярна концентрація, моль·екв/дм3 (дорівнює 0,025);
q – наважка речовини, г;
Е – еквівалентна маса, г/моль;
V – об’єм, см3 (дорівнює 500).
________________________________________________________________________________________________________________
На т/х терезах зважуємо суха чиста фарфорова чашка, масу уточнюємо на аналітичних терезах. До зваженої фарфорової чашки додаємо розраховану наважку тіосульфату натрію та зважуємо на т/х терезах, уточнюємо масу на аналітичних терезах. Результати заносять у таблицю.
| № | Зважуємий предмет | Маса на т/х терезах | Маса на аналітичних терезах |
| Порожня фарфорова чашка | |||
| Наважка тіосульфату натрію | |||
| Чашка з наважкою |
Зважену кількість речовини обережно через воронку переносимо в ємкість на 500 см3 розчиняючи у дистильованій воді, розчин перемішати, обережно закрити кришкою, оформити етикеткою, покласти в відведене місце.
2. Приготування стандартного розчину дихромату калію.
Розрахунок еквівалентної маси дихромату калію: ___________________
________________________________________________________________________________________________________________
Розрахунок наважки дихромату калію робимо за формулою:
q =  , г
, г
де Секв – еквівалентна молярна концентрація, моль·екв/дм3 (дорівнює 0,025);
q – наважка речовини, г;
Е – еквівалентна маса, г/моль;
V – об’єм, см3 (дорівнює 100).
________________________________________________________________________________________________________________
На т/х терезах зважуємо суха чиста фарфорова чашка, масу уточнюємо на аналітичних терезах. До зваженої фарфорової чашки додаємо розраховану наважку дихромату калію та зважуємо на т/х терезах, уточнюємо масу на аналітичних терезах. Результати заносять у таблицю.
| № | Зважуємий предмет | Маса на т/х терезах | Маса на аналітичних терезах |
| Порожня фарфорова чашка | |||
| Наважка К2Сr2О7 | |||
| Чашка з наважкою |
3. Визначення еквівалентної молярної концентрації розчину тіосульфату натрію з використанням стандартного розчину дихромату калію.
Бюретка наповнюється розчином тіосульфату натрію, концентрацію якого потрібно визначити: у колбу для титрування піпеткою відміряємо точний об’єм дихромату калію, циліндром виміряємо туди стільки ж об’єми розчинів йодиду калію і сірчаної або соляної кислоти. Реакційна суміш зачиняється склом і кладемо у темне місце, щоб не сталися на світлі побічні окислювальні процеси. Реакція, яка йде з виділенням йоду потребує деякого часу (10-15 хвилин). Через цей час починаємо титрування. Титрування проводять до появи світло-жовтого забарвлення, тільки після цього додають 5 см3 розчину крохмалю, розчин синіє, продовжуємо титрування до знебарвлення по краплинам. Правильність титрування можливо перевірити. Якщо до обезбарвленого розчину додати 1-2 краплини розчину дихромату калію, розчин повинен посиніти.
Результати титрування заносять у таблицю:
| K2Cr2O7 | Na2S2O3 |
| Ceкв = V = об’єм піпетки, см3 | V1 =
V2 =
V3 =
Vср = 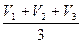 = =
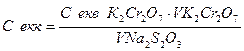 = =
|
Контрольні питання:
1. Сутність йодометрії.
2. На чому засновано використання крохмалю як індикатору?
3. Чому йодометричні визначення забороняється проводити при нагріванні?
________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Оцінка викладача: ________________________________________________________
Лабораторна робота № 17
Тема: «Визначення еквівалентності молярної концентрації розчину йоду.»
Мета: закріпити навики йодометричного титрування та розрахунки пов’язаних з ним.
Прилади та реактиви: титрувальні установки, розчин тіосульфату натрію, розчин йоду, крохмалю, циліндр, колби для титрування, мікроворонки.
Титрування ведеться прямим методом, а саме розчин йоду (точний об’єм) відтитровується тіосульфатом натрію. Механізм виявлення протікає за рівнянням:
2Na2S2O3 + J2 → 2NaJ + Na2S4O6
2S2O32- - 2e → S4O62-
J2 + 2e → 2J-
Розрахунок еквівалентної маси йоду: ___________________________
________________________________________________________
Бюретка наповнюється розчином тіосульфату натрію, еквівалентна концентрація якого виявлена на попередній лабораторній роботі.
У реакційну колбу піпеткою Мора відмірюємо точний об’єм розчину йоду і без індикатору починаємо титрувати розчином тіосульфату натрію до з’явлення солом’яно-жовтого забарвлення. Потім додаємо 5 см3 розчину крохмалю. Розчин синіє. До синього розчину продовжуємо по краплинам додавати з бюретки розчин тіосульфату натрію до того, поки розчин не знебарвиться.
При цьому енергійно, але обережно стряхнути реакційну суміш. Після знебарвлення в реакційну колбу знову додають 1 краплину розчину йоду. Якщо суміш посиніє, то титрування проведено вірно. Титруємо 3-4 правильних рази.
Результати титрування заносять у таблицю:
| Na2S2O3 | J2 |
Ceкв = з роботи № 16
V1 =
V2 =
V3 =
Vср = 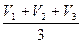 = =
| V = об’єм піпетки, см3
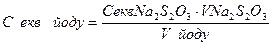 = =
 = =
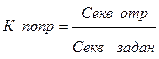 = =
|
Контрольні питання:
1. Які робочі розчини використовують у методі йодометрії?
2. Як потрібно зберігати титровані розчини?
3. Для яких визначень використовують йодометрію у харчовій промисловості?
________________________________________________________________________________________________________________
Оцінка викладача: ________________________________________________________
Лабораторна робота № 18
Тема: «Йодометричні визначення кількості тіосульфату в дослідженому розчині.»
Мета: засвоїти методику визначення відновників у методі йодометрії і розрахунків, пов’язаних з ним.
Прилади та реактиви: мірні колби ємкістю 100 см3 з невідомим об’ємом дослідженого розчину тіосульфату натрію, розчину йоду, розчин тіосульфату натрію (робочий), крохмаль, титрувальні установки, дистильована вода.
Йодометричні визначення відновників проводяться методом зворотного титрування. Точний об’єм невідомого відновника обробляється точним надмірним об’ємом невідомого окислювача (йоду), надлишок якого відтитровується еквівалентним об’ємом невідомого відновника розчину тіосульфату натрію з відомою молекулярною концентрацією.
Рівняння реакції між розчином тіосульфату натрію в йодометрії йде по схемі:
2Na2S2O3 + J2 → 2NaJ + Na2S4O6
2S2O32- - 2e → S4O62-
J2 + 2e → 2J-
Отриману задачу (досліджуємий розчин) у мірній колбі об’ємом 100 см3 розводимо дистильованою водою до мітки і вирівнюємо концентрацію. Точний об’єм розведеного розчину поміщаємо у реакційній колбі (10 см3 – 1 піпетка), додаємо точний надмірний об’єм розчину йоду (2 піпетки), надлишок якого відтитровуємо робочим розчином тіосульфату натрію, розміщеним у бюретці. Титрування проводимо до появи соломено-жовтого забарвлення, потім вводять 5 см3 розчину крохмалю і по краплинам продовжуємо титрувати синій розчин до знебарвлення. Вірність титрування перевіряємо по посинінню реакційної знебарвленої суміші при додаванні 1 краплини йоду. Титрування проводимо 3-4 правильних рази. Результати заносять у таблицю і виконують необхідні розрахунки.
| Na2S2O3 (задача) | J2 | Na2S2O3 (робочий) |
| V = об’єм піпетки, см3 | Vзаг. = подвійний об’єм піпетки, см3 Секв = з роботи № 17 | Секв = з роботи № 16
V1 =
V2 =
V3 =
 = =
|
1. Визначаємо об’єм йоду по тіосульфату натрію (робочий):
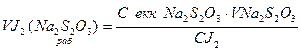 , см3
, см3
________________________________________________________________________________________________________________________________________________________________________
2. Визначаємо об’єм йоду по тіосульфату натрію (загальний):
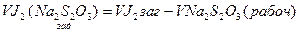 , см3
, см3
________________________________________________________________________________________________________________
3. Визначаємо еквівалентну молярну концентрацію тіосульфату натрію:
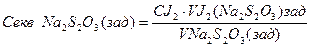
________________________________________________________________________________________________________________________________________________________________________
4. Визначаємо наважку тіосульфату натрію
q = 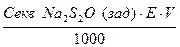 =
=
________________________________________________________________________________________________________________________________________________________________________
Контрольні питання:
1. Як визначаються відмінники у методі йодометрії?
2. Сутність йодометрії.
3. Рівняння реакції, яке лежить в основі йодометрії?
________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Оцінка викладача: ________________________________________________________
Лабораторна робота № 19
Тема: «Приготування стандартного розчину сульфату магнію і визначення еквівалентної молярної концентрації розчину трилону Б.»
Мета: вивчити особливості комплексонометричного методу аналізу, закріпити навики пов’язані з приготуванням розчинів, засвоїти методику комплексонометричного титрування і вивчити особливості індикатору еріохрому чорного Т.
Прилади та реактиви: терези т/х та аналітичні, різноваги, фарфорові чашки, мірні колби ємкістю 100 см3, воронки, титрувальні установки, сухий сульфат магнію, розчин аміачної буферної суміші, розчин трилон Б, індикатор еріохром чорний Т.
Сутністю комплексонометричного методу аналізу є взаємодія робочого розчину комплексну, з визначаємими іонами. Ця реакція аналогічна реакції осадження. У ролі комплексну дуже часто використовують кислу двухнатрієву сіль етилендіамінтетраоцтової кислоти. Цей комплекс має назву трилон Б.
Реакція комплексоноутворення зворотна. Внаслідок утворення комплексона утворюється іони водню. Щоб змістити рівновагу комплексоноутворення, треба вивести іони водню з сфери реакції.
Виводяться вони додаванням аміачної буферної сміши, рН якої 9.
Індикатор – це органічний барвник, який утворює забарвлений комплекс з визначеними іонами винно-червоного кольору.
Хімізм реакції комплексоноутворення йде за рівнянням:
 Na2H2T4 + Mg2+ Na2(MgT4) + 2H+
Na2H2T4 + Mg2+ Na2(MgT4) + 2H+
1. Приготування стандартного розчину сульфату магнію.
Сульфат магнію використовується як стандартний розчин, так як ця речовина відповідає всім вимогам, яким потрібні відповідати вихідні речовини.
Це біла кристалічна речовина, гарно розчинна у воді. Формула сульфату магнію: MgSO4 · 7H2O.
Розрахунок еквівалентної маси сульфату магнію: ___________________
________________________________________________________
Розрахунок наважки сульфату магнію робимо за формулою:
q =  , г
, г
де Секв – еквівалентна молярна концентрація, моль·екв/дм3 (дорівнює 0,05);
q – наважка речовини, г;
Е – еквівалентна маса, г/моль;
V – об’єм, см3 (дорівнює 100).
________________________________________________________________________________________________________________
По величині наважки розраховуємо еквівалентну молярну концентрацію сульфату магнію:
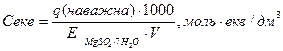
де q – наважка речовини, г;
Е – еквівалентна маса, г/моль;
V – об’єм, см3 (дорівнює 100).
________________________________________________________________________________________________________________
2. Визначення еквівалентної молярної концентрації розчину трилону Б.
Бюретка заповнюємо розчином трилону Б, точку еквівалентної молярної концентрації якого необхідно визначити. В реакційну колбу піпеткою відміряємо точний об’єм розчину сульфату магнію і додаємо 5 см3 аміачної буферної суміші і 10-15 краплин еріохрому чорного Т, розчин сульфату магнію забарвлюється у винно-червоний колір. Цей розчин титрується розчином трилону Б і по краплям, при енергійному струшуванні до того, доки від однієї краплини розчину трилону Б розчин не стане такого ж кольору, як і індикатор – блакитного. Титрування проводимо 3-4 правильних рази.
Результати титрування заносять у таблицю:
| MgSO4 | Трилон Б |
Ceкв = 0,05 моль·екв/дм3
V1 =
V2 =
V3 =
Vср = 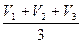 = =
| V = об’єм піпетки, см3
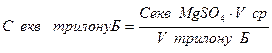 = =
|
Контрольні питання:
1. Сутність комплексонометричного методу.
2. Для чого використовується буферна суміш?
3. Особливості дії еріохрому чорного Т?
4. Показати механізм комплексоноутворення з іонами кальцію, використовуючи структурну формулу трилону Б.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Оцінка викладача: ________________________________________________________
Лабораторна робота № 20
Тема: «Визначення загальної твердості води.»
Мета: навчитися контролювати якість води – загальної сировини харчової промисловості.
Прилади та реактиви: титрувальні установки, мірні колби на 100 см3, розчин трилону Б, аміачна буферна суміш, еріохром чорний Т.
В лабораторній практиці комплексонометричне титрування використовується для визначення загальної твердості води, тобто сумарної твердості, яка зумовлена наявністю у воді солей кальцію або магнію. Від якості води залежить якість випускаємої продукції, тому потрібно визначити можливість використання природної води для технологічних процесів.
Бюретку заповнюємо розчином трилону Б, еквівалентну молярну концентрацією якого визначили за допомогою стандартного розчину сульфату магнію у попередній роботі.
В реакційну колбу відмірюємо мірною колбою ємкістю 100 см3 водопровідну воду, додаємо 10 см3 аміачної буферної суміші, яку відміряємо циліндром та 10-15 краплин еріохром чорного Т, вода забарвлюється у вино-червоний колір за рахунок наявності в ній кальцію і магнію.
Титруємо воду розчином трилону Б до того, поки вона не стане такого ж кольору, як і індикатор – блідо-блакитного. Титрування проводимо 3-4 правильних рази.
Записуємо результат титрування у таблицю.
| Трилон Б | Н2О |
Ceкв = з роботи № 19
V1 =
V2 =
V3 =
 = =
| Vзаг. = 100 см3
 , мг·еквСа2+,Мg2+/дм3 Н2О , мг·еквСа2+,Мg2+/дм3 Н2О
|
Контрольні питання:
1. Чому додавання індикатору до водопровідної води супроводжується появленням вино червоного кольору?
2. Що називається загальною твердістю води?
3. Значення загальної твердості води для харчових підприємств.
________________________________________________________________________________________________________________________________________________________________________
Оцінка викладача: ________________________________________________________
Лабораторна робота № 21
Тема: «Визначення вмісту міді у досліджуємому розчині мідного купоросу методом фотоелектроколориметрії.»
Мета: вивчити особливості роботи фотометра КФК-3, навчитися готувати стандартні розчини, готувати розчин до фотометрування, проводити фотометрування і визначити по графіку концентрацію досліджуємого розчину.
Прилади та реактиви: фотометр фотоелектричний КФК-3, стандартний розчин мідного купоросу, розчин аміаку, дистильована вода, мікропіпетки, титрувальні установки, набір пробірок, мірна колба місткістю 100 см3.
Фотометричний метод заснований на прямо пропорційної залежності концентрації речовини від оптичної густини забарвленого розчину.
Оптичну густину можливо порівнювати для стандартних і досліджуємих розчинів. Тому перед усім, потрібно перевести визначаємий іон у ярко забарвлену сполуку.
CuSO4 + 4NH4OH = [Cu (Nh2)4] SO4 + 4H2O
|
|
|
|
|
Дата добавления: 2017-01-14; Просмотров: 182; Нарушение авторских прав?; Мы поможем в написании вашей работы!