
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Другий вид роботи — прогресивна зачіска 3 страница
|
|
|
|
Іон міді з розчином гідрооксиду амонію утворює ярко-синє забарвлення з’єднання аміаку міді.
1. Будова фотоелектроколориметру КФК – 3 і порядок роботи з ним.
Фотометр фотоелектричний КФК-3 виготовлений у вигляді одного блоку. На металевій основі закріплені усі вузли фотометра, які закриваються кожухом. Кюветне відділення зачинається з’ємною кришкою. У фотометр входять фотометричний блок. На боковій стінці корпусу знаходиться тумблер.
У кюветне відділення встановлюють коветотримач з двома кюветами, при цьому в одне гніздо встановлюють кювету з розчинником, а у друге гніздо з стандартним розчином або досліджуємим розчином. Поворотом рукоятки у світовій потік вводиться кювета з розчинником або розчином.
Прибор вмикається у електромережу за 30 хвилин до початку роботи з ним. Встановлюють необхідна довжину хвилі для даного вимірювання, так як розчин має синє забарвлення, то світофільтр повинен бути червоним, довжина світових червоних хвиль – 580.
Перевіряється вірність показників приладу для цього рукояткою вліво у світовій потік вводять кюветку з розчинником.
Нажимають клавішу Г, а потім клавішу П, тоді праворуч на табло висвітлюється 100,000 – це коефіцієнт світопропускання, а потім на клавішу К при цьому на табло висвічується 0,000 – це оптична густина розчину.
Поворотом рукоятки до упору вправо у світловій потік вводять стандартний або досліджуємий розчин і на табло висвітлюється або коефіцієнт світопропускання, або оптична густина розчину.
Після перевірки вірності показаній приладу, потрібно провести його градуїровку по стандартним розчинам.
2. Приготування стандартних розчинів, їх колориметрирування.
Стандартний розчин купоросу готується розчиненням 6,9268 г мідного купоросу у мірній колбі ємкістю 1000 см3 з доданням 10 см3 концентрованої сірчаної кислоти для подавлення гідролізу. У 1 см3 такого розчину знаходиться 1 мг міді.
Приготування шкали стандартних розчинів: підбираємо 11 однакових пробірок з загальним розміром трішки більш ніж 10 см3. У 3 бюретках розміщують: розчин мідного купоросу, розчин гідрооксиду амонію і дистильовану воду.
Заповнення пробірок ведеться за таблицею:
| № пробірки | ||||||||||
| Об’єм стандартного р-ну CuSO4 | 0,5 | 1,0 | 1,5 | 2,0 | 2,5 | 3,0 | 3,5 | 4,0 | 4,5 | 5,0 |
| Об’єм розчину NH4OH | 5,0 | 5,0 | 5,0 | 5,0 | 5,0 | 5,0 | 5,0 | 5,0 | 5,0 | 5,0 |
| Oб’єм води | 4,5 | 4,0 | 3,5 | 3,0 | 2,5 | 2,0 | 1,5 | 1,0 | 0,5 |
Розмістивши всі компоненти у 10 пробірок, перемішати їх і приготувати до фотометрування.
Отриманий досліджуємий розчин у мірній колбі ємкістю 100 см3 розводимо дистильованою водою до мітки і вирівнюємо концентрацію.
У пробірку № 11 піпеткою відміряємо 3 см3 розчину задачі, з бюреток 5 см3 розчину аміаку і 2 см3 води, перемішуємо.
Усі розчини готові до фотометрування.
Почергово, після промивання кюветки, визначаємо коефіцієнт світопропускання, або оптичну густину стандартних і досліджуємих розчинів. Результати вимірювань заносимо до таблиці:
| № пробірки | |||||||||||
| Містить міді, мг | 0,5 | 1,0 | 1,5 | 2,0 | 2,5 | 3,0 | 3,5 | 4,0 | 4,5 | 5,0 | |
| Коефіцієнт світопропускання | |||||||||||
| Оптична густина |
По даним таблиці будуємо графіки залежності коефіцієнту світопропускання від концентрації розчина мідного купоросу.
 |
Контрольні питання:
1. Яка галузь використання фотоколиметрії?
2. У яких випадках присутність сторонніх іонів у розчин відображається на його забарвленні?
3. У чому сутність фотоелектроколориметрії?
4. Що таке коефіцієнт світопропускання?
5. Що таке оптична густина розчину?
________________________________________________________________________________________________________________
Оцінка викладача: ________________________________________________________
Лабораторна робота № 22
Тема: «Визначення масової частки цукру
у досліджуємому розчині рефрактометричним методом аналізу.»
Мета: вивчити основи рефрактометричного методу аналізу, отримати навик у роботі з рефрактометром, переконатися у необхідності придбання навичок для використання їх у ТХК харчових виробництв.
Прилади та реактиви: рефрактометри типу РПЛ-3, стакани, скляні пальці, пробірки з досліджуємим і стандартним розчином цукру дистильована вода.
В основі рефрактометричного методу аналізу полягає визначення показника заломлення та його залежність від концентрації досліджуємого розчину цукру. Будь яка речовина характеризується якимось кутом і показником заломлення. Якщо промінь світла переходить з одного середовища в інше, то напрям його проміння змінюється, а саме: промінь світла заломлюється. Показник заломлення дорівнює відношенню синуса до кута заломлення. Кут падіння завжди більший ніж заломлення. Тому показник заломлення завжди більше 1. Для одного середовища показник заломлення величина постійна. Але, показник заломлення залежить від довжини світлових хвиль, температури і концентрації. З підвищенням температури показник заломлення зменшується. А з підвищенням концентрації досліджуємого розчину підвищується. Ця залежність дає можливість визначити концентрації цукру у розчині по величині показника заломлення.
1. Будова і принцип роботи рефрактометра РПЛ-3.
За допомогою рефрактометра можна визначити показник найбільшого кута заломлення або кута повного внутрішнього відбиття. Визначення можна проводити як у проходящому так і у відбитому світлі.
Рефрактометр РПЛ-3 складається з корпуса, колонки і основи. У корпусі знаходяться верхня рухома і нижня нерухома камери. У камерах містяться призми. У нижній – вимірювальна, у верхній – освітлювальна. На верхній камері знаходиться освітлювач з червоним світлофільтром. Збоку призми зачиняються. Освітлювальна – шторкою, вимірювальна – пробкою. На передній панелі прибору є шкала, рукоятка з окуляром, її використовують для поєднання візирної лінії з межею світла і тіні. На осі знаходиться шкала з вікном для повороту дисперсного компенсатору з ціллю усування спектру з межі світла і тіні.
Перед початком роботи прибору його показання перевіряють по дистильованій воді. Для цього відкривають верхню камеру, протирають обидві призми і оплавленим кінцем скляної площі наносять на вимірювальну призму каплю дистильованої води, верхню камеру зачиняють. Прилад вмикають в електромережу крізь трансформатор. При цьому загорається лампочка і світло направляється у вікно вимірювальної призми.
Рукоятку з окуляром переміщують у нижнє положення і повільно переміщують вверх, доки візирна лінія не поєднається з межею світла і тіні. Добившись контрастності освітлення поля зору, а поворотом спектру зі шкалою зміщуємо дисперсний компенсатор і цим устроняємо спектр з межі світлотіні. При вірній наладці приладу. Межа світлотіні повинна співпадати з нульовим діленням школи сухих речовин, а на шкалі показників заломлення візирна лінія зміщується з показником заломлення 1,333.
2. Визначення кількості цукру у досліджуємому розчині.
Всі визначення проводяться при температурі 200С. Після перевірки вірності показників приладу починаємо визначати масову частку стандартних і досліджуємих розчинів цукру. Всі визначення проводять так само, як і перевірка нуля приладу. Після кожного визначення потрібно промити обидві призми приладу і протерти сухою м’якою ганчіркою або фільтрувальним папером.
Результати визначення заносять у таблицю:
| Конц. р-ну | Показник заломлення | Кількість сухої речовини по приладу |
| С = | ||
| С = | ||
| С = | ||
| С = |
Потім будуємо графік залежності показника заломлення від концентрації стандартних розчинів. На осі Х потрібно відкласти концентрацію стандартних розчині, а на осі У – показник заломлення. По показнику заломлення визначаємо концентрацію досліджуємого розчину цукру. Зрівнюємо графічні визначення з показника на приладі.
 |
Контрольні питання:
1. Сутність рефрактометричного методу аналізу.
2. Особливості методу.
3. Завжди лі можна використовувати рефрактометричний метод для визначення склад розчину?
4. Будова рефрактометру РПЛ-3 та принцип роботи з ним.
5. Застосування рефрактометричного методу аналізу у харчовій промисловості.
________________________________________________________________________________________________________________
Оцінка викладача: ________________________________________________________
Лабораторна робота № 23
Тема: «Визначення масової частки глюкози у досліджуємому розчині поляриметричним методом аналізу.»
Мета: ознайомитись з сутністю поліметрії, вивчити будову кругового поляриметру, отримати навики у поляриметриванні розчинів глюкози з різкими масовими долями.
Прилади та реактиви: поляриметр, розчини з визначною масовою долею глюкози і досліджуємий розчини, дистильована вода.
Поляриметрія – це один з методів фізико-хімічного аналізу, оснований на визначенні кута обертання площини поляризації світла.
Згідно з теорією світлових явищ, з курсу фізики відомо, що електромагнітні коливання світлового проміння, направлені перпендикулярно-світловому промінню. А площина, у який розміщуються ці електромагнітні хвилі, носить назву площина поляризації.
Якщо розглянутий промінь природного світла, та його електромагнітні коливання проходять у всіх напрямках, то таке світло називається неполяризованим. Природних джерел поляризованого світла не існує. Отримати повністю поляризоване світло, можливо лише використовуючи характер проходження променів крізь кристалічні речовини. Найбільш підходяща для цього речовина – ісландський шпат або кальцит.
Вперше простий поляризатор використовував англійський вчений Улільян Ніколь. Він із ісландського шпату вирізав 2 прямокутні призми склеїв їх площинами катетів бальзамом, який поглинає ультрафіолетові проміні. Полізатор, виготовлений з ісландського шпату, є прозорим для світових промінів світла.
У природі існують речовини, при пропусканні крізь розчини яких поляризованого промінню світла площина поляризації поверхні повертається на деякий кут, величина якого залежить від концентрації цього розчину. Такі речовини мають назву оптично активних.
Таким чином, кут повертання площини поляризації залежить від концентрації розчину оптично-активної речовини, вимірюючи кут обертання, можливо визначити концентрацію якоїсь речовини.
Цей метод широко використовуються у цукровій, кондитерський, масложировій промисловості.
1. Будова та принцип роботи поляриметру.
Прилад встановлено на масивній станині, складається з освітлювача, поляризатору, траверсу прибору, куди встановлюють поляриметричну трубу з дистильованою водою або оптично-активною речовиною аналізатора, окуляра, шкала приладу і рукоятка, яка змінює положення аналізатору рухомого поляризатора, який дозволяє вимірювати кут відхилення.
Для визначення куту обертання спостерігати у полі зору в окулярі і повільно повертати рукоятку аналізатора до того, доки обидві половинки не будуть затемнені після першого затемненні, після перемінного затемнення то правої, то лівої половини поля:
 |
Тільки після цього треба знімати показання шкали приладу, яка має шкалу з цілими градусами і допоміжну шкалу – шкалу корпусу, яка дозволяє виміряти десяту частку градусу.
2. Визначення кута обертання площини поляризації.
Спочатку проводимо заповнення поляриметричної трубки дистильованою водою, дивимось, щоб не утворився пузир повітря, який не дозволяє проводити вимірювання. Встановлюємо трубку у траверсу прибору, закриваємо його чохлом і нагріваємо прибор. Встановив 0 на приборі, можливо приступати до поляриметрування стандартних і досліджуємих розчинів глюкози. Поляриметричну трубку заповнюють послідовно стандартними розчинами глюкози з відомою концентрацією, а потім досліджуємим розчином глюкози. Після кожного вимірювання потрібно вимити поляриметричну трубку дистильованою водою. Всі визначення записуємо у таблицю і будуємо колібровочний графік: на осі “Х” відкладаємо концентрацію розчину глюкози, а на осі “У” – величина кута обертання. Потім знаходять кут обертання досліджуємого розчину, проводячи пряму, паралельну осі «Х», опускаємо перпендикуляр з точки перетину прямої з графіком, на осі “Х” знаходимо концентрацію досліджуємого розчину.
| Конц. розчину | Кут повертання площин поляризації |
| С = | |
| С = | |
| С = | |
| С = |
 |
Контрольні питання:
1. Особливості отримання поляризованого проміння світла.
2. Сутність поляриметричного методу аналізу.
3. Будова і принцип роботи поляриметру.
4. Застосування поляриметричного методу аналізу у харчовій промисловості.
5. Оптично-активні речовини.
________________________________________________________________________________________________________________
Оцінка викладача: ________________________________________________________
Лабораторна робота № 24
Тема: «Визначення вітаміну В2 у досліджуємому розчині люмінесцентним методом аналізу.
Мета: вивчити будову флуориметру, навчитися працювати з ним, отримати навики у визначенні вітамінів групи В у харчових продуктах, у яких зі збільшенням кількості вітамінів збільшується якість цих продуктів.
Прилади та реактиви: флуориметр, стандартний розчин рибофлавіну з Т = 4 · 10-5 г/см3, мірні колби ємкістю 100 см3, мікропіпетки і дистильована вода.
Люмінесцентний аналіз оснований на визначенні кількості люмінесцентних речовин у дуже маленьких концентраціях по величині виходу флуоресценції.
Люмінесценція – це другорядне світіння, яке визнане увібраною променевої енергії. У залежності від тривалості світіння люмінесценція класифікується на фосфоресценцію (світіння, яке продовжується тривалий час після вилучення джерела збудження) і флуоресценцію (світіння, яке зникає відразу ж після вилучення джерела збудження).
В аналітичній хімії використовується флуоресценція, викликана променевою енергією. Для збудження люмінесцентного світіння джерело збудження повинно бути багато проміннями з короткими довжинами хвиль – ультрафіолетовим промінням.
Основним фактором, який заважає при зміні люмінесцентного світіння є розсіювання збудженого спектру, дна кювету і самої рідини. Тому у всіх приладах для люмінесцентного аналізу використовують систему світофільтрів (для відділення спектральної ділянки збуджуючого спектру від спектральної ділянки, характерної для люмінесценції).
Для кількісного люмінесцентного аналізу використовують величину виходу флуоресценції.
Виходом флуоресценції до енергії Вфл. називають відношення енергії, яка випромінюється у вигляді флуоресценції до енергії поглинаючої речовини.
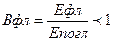
Для кількісного аналізу цікава залежність виходу флуоресценцій від концентрації аналізуємої речовини.
Характерна крива залежності виходе флуоресценції.
 |
Вфл
 |
 Е
Е
На графіку видно, що в області малих концентрацій між виходом флуоресценції і концентрації існує пряма залежність. Ця область дуже цікава для кількісного аналізу.
Для більшості речовин ця область концентрації порядка 10-7 г/см3. При значному підвищенні концентрації вихід флуоресценції знижується. Це явище називається концентраційним гасінням.
1. Будова та принцип роботи флуориметру.
Світло від кварцової лампи проходить крізь діафрагму, первинний світлофільтр, кварцову оптику, попадає у кварцову кюветку з дослідженим розчином. Досліджений розчин, облучений короткохвильовою областю спектра, починає світитись. Світло флуоресценції досліджуємого розчину, збуджене кварцовою лампою, попадає на кварцову оптику, розташовану з двох сторін кюветки. Потім сфокусований пучок світла проходить крізь вторинні світлофільтри і попадають на фотоелементи, які перетворюють світлову енергію флуоресценції у електричну. Далі пучок світла попадає крізь усилювач на записуючий устрій (шкалу).
Показники прямо пропорціональні концентрації аналізуємої речовини у розчині.
2. Визначення вітаміну В2 у досліджуємому розчині.
Рибофлавін (вітамін В2) є невід’ємною часткою всіх рослинних організмів. У природі вітаміни находяться в зв’язаному стані. Сучасні засоби визначення рибофлавіну засновані на його здібності флуоресцирувати. Пов’язані з білком форми не флуоресцирують. Тому у даній лабораторній роботі будемо визначати вміст В2 у розчинах, які містять його у свобідному стані.
Хід визначення рибофлавін. Рибофлавін (вітамін В2) являється невід’ємною частиною усіх рослинних організмів. У природі вітаміни находяться у зв’язаному стані. Сучасні способи визначення рибофлавіну засновані на його здібності флуоресцирувати. Зв’язані з білком форми не флуоресцирують. Тому у даній лабораторної роботі будемо визначати вміст В2 у розчинах, які містять його у вільному стані.
Мікропіпеткою ємкістю 1см3 відміряємо готовий розчин вітаміну з Т = 4 · 10-5 г/см3 і переносимо у мірну колбу ємкістю 100 см3, розводиться дистильованою водою до мітки. Отриманий розчин розташовуємо у кюветці і облучаємо кварцовою лампою, регулятором приладу встановлюємо на шкалі приладу флуоресценції 100.
Таким чином готуються і інші стандартні розчини з різною величиною титру менше, ніж Т = 4 · 10-7 г/см3.
В окремій колбі від лаборанта отримуємо задачі з невідомою кількістю рибофлавіну. Потім всі розчини: стандартний і досліджуємий, піддають флуориметрируванню, результати заносять до таблиці.
По даним таблиці будуємо графік прямо пропорціональної залежності від концентрації. Знаходять концентрацію розчину.
| Конц. розчину | Данні флуориметру |
| С = | |
| С = | |
| С = | |
| С = |

Контрольні питання:
1. Сутність люмінесцентного методу аналізу.
2. Яка спектральна характеристика люмінесценції?
3. Що називають виходом флуоресценції?
4. Від яких факторів залежить гасіння флуоресценції?
5. Флуориметр, його будова, принцип роботи з ним.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Оцінка викладача: _______________________________________________________
Лабораторна робота № 25
Тема: «Визначення рН буферних розчинів.»
Мета: вивчення особливостей водневого показника буферних розчинів на іономірі, засвоїти методику роботи іономіра.
Прилади та реактиви: іонометри, стакан, стандартні буферні розчини, розчини з невідомим значенням водневого показника.
1. Будова та принцип роботи з іономіром.
Вимірювання електричного потенціалу відбувається за допомогою іономіру.
Робочими органами якого є електроди: один з них індикаторний, скляний електрод, чуйний до іонів, які є у розчині, (потенціал який виникає на іонному, залежить від концентрації іонів водню у дослідженому розчині).
Інший електрод – електрод зрівняння хлор сріблястий, не чуйний до іонів водню у розчині, потенціал його постійний. На визначення електродного потенціалу, який утворився при зануренні електродів у досліджуємий розчин, засновано потенціонометричне визначення концентрації водневих іонів або рН розчинів.
При зануренні скляного електроду (тонкий скляний шарик з літієвого скла), стається обмін іонами між розчином і поверхнею шарика. Іони літію проникають зі скла у розчин, а іони водню з розчину у скло. На поверхні скляного електроду виникає потенціал, величина якого визначається концентрацією іонів водню.
У лабораторних іонометрах кнопкою вибору режиму обирають рХ. Індикаторний електрод – скляний і реагує тільки на змінення концентрації іонів водню, то рХ є рН. Спочатку опускають обидва електрода у стандартний буферний розчин з рН = 9,18 і натискають кнопку діапазону вимірювання 9-14, при необхідності, рукояткою, крутизна настроюють іономір на рН – 9,18. Після цього здійснюють перевірку показань іономіру по буферному розчину з рН = 1,68. Для цього промиваються електроди у дистильованій воді, висушуються фільтрувальним папером і вставлять їх у стакан з буферним розчином рН якого 1,68. Для цього натискають кнопку діапазону вимірювань 1-4 і рукояткою “калібровка” встановлюють стрілку іонометру на потрібне ділення.
Зробивши операції, можна приступати до визначення рН досліджуємих розчинів. Після цього заміру електроду промивають і висушують.
2. Визначення рН буферних розчинів.
Техніка визначення дуже проста. Електроди і стакани після кожного визначення треба промивати. При кожному вимірюванні натискують на кнопку діапазону 1-19 по якому визначають приблизний рівень рН, тільки після цього вибирають клавішу діапазону вимірювальні і визначають точне значення водневого показника.
Показання замірів перевіряються викладачем і зрівнюються з дійсними значенням рН буферних розчинів.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Контрольні питання:
1. Сутність і класифікація електрохімічних методів аналізу?
2. Особливості потенціометричного методу аналізу.
3. Будова лабораторного іонометру і правила його експлуатації.
4. Порядок визначення водневого показника?
5. Чому скляний електрод замінює водневий?
6. Буферні розчини та їх характеристика.
7. Класифікація потенціометричного методу аналізу.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Оцінка викладача: ________________________________________________________
Лабораторна робота № 26
Тема: «Визначення нітратів у харчових продуктах.»
Мета: засвоїти методику роботи іономіра-нітратоміра, перевірку показань по стандартним розчинам, підготовку харчових продуктів до аналізу і заміри показань приладу.
Прилади і реактиви: іономір, селективний мембранний електрод ЕМ-NO3 мірні колби ємкістю 1000 см3, 100 см3, мікропіпетки, тертка, фарфорова ступка, техніко-хімічні терези і різноваги до них, колби ємкістю 500 см3 з пробірками, алюмокалієві квасці, нітрат калію.
1. Приготування розчинів нітрату калію та розчинів порівняння.
Аналіз проб на вміст нітратів. Сутність методу складаються з того, що нітрати з аналізуємого матеріалу добуваються розчином алюмокалієвих квасців і визначаються потенціометричним методом за допомогою електроду ЕМ-NO3-0,1.
1.1. Розчин зрівняння готується з розчину нітрату калію приготовленого розчиненням 10,11 г нітрату калію в алюмокалієвих квасцях у мірній колбі ємкістю 1000 см3 (С = 1)
1.2. Розчин зрівняння з С 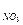 = 0,01 моль/дм3 (рС = 2). Готуємо шляхом відбирання піпеткою ємкістю 10 см3 розчину нітрату калію і переносимо у мірну колбу ємкістю 100 см3 і розводимо до мітки розчином алюмокалієвих квасців.
= 0,01 моль/дм3 (рС = 2). Готуємо шляхом відбирання піпеткою ємкістю 10 см3 розчину нітрату калію і переносимо у мірну колбу ємкістю 100 см3 і розводимо до мітки розчином алюмокалієвих квасців.
1.3. Розчин зрівняння С 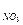 = 0,001моль/дм3 (рС = 3). Готуємо шляхом відбирання піпеткою ємкістю 10 см3 розчину з рС = 2 і переносимо у мірну колбу ємкістю 100 см3 і розводимо до мітки розчином алюмокалієвих квасців.
= 0,001моль/дм3 (рС = 3). Готуємо шляхом відбирання піпеткою ємкістю 10 см3 розчину з рС = 2 і переносимо у мірну колбу ємкістю 100 см3 і розводимо до мітки розчином алюмокалієвих квасців.
1.4. Розчин зрівняння з С 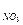 = 0,001 моль/дм3 (рС = 4). Готуємо розведенням 10 см3 нітрату калію з рС = 3 у мірній колбі ємкістю 100 см3 розчином алюмокалієвих квасців.
= 0,001 моль/дм3 (рС = 4). Готуємо розведенням 10 см3 нітрату калію з рС = 3 у мірній колбі ємкістю 100 см3 розчином алюмокалієвих квасців.
2. Будова та настройка іономіра-нітратоміра.
Іономір ЕВ-74 вмикають у електромережу, при цьому загорається індикаторна лампочка і прогрівається протягом 30 хвилин.
Іоноселективний електрод виймають з розчину нітрату калію, промивають дистильованою водою, обидва електроди висушують фільтрувальним папером і вставляють у стакан з розчином нітрату калію (рС = 2) натискають кнопку рХ = 1-4, рукояткою “калібровка” встановлюють на 0, потім нажимають кнопку рХ. Промивають і висушують електроди і поміщають їх у розчині нітрату калію (рС = 4), при натиску кнопки рХ рукояткою, “крутизна” настроюють стрілку приладу на 2 (4 – 2 = 2), рукояткою “калібровка” повертають таким чином, щоб стрілка приладу зупинилась на цифрі 4. Нажимають рХ, після промивки і висушування електродів поміщають їх у розчині з рС = 3, при натиску кнопки рХ стрілка приладу повинна встановитися на цифрі 3. Це означає, що нітратомер готовий до роботи.
3. Підготовка проб до аналізу.
Овочі, які потрібно аналізувати, промивають, просушують, натирають на тертці і розтирають у ступці. Потім зважують у скляному стакані на т/х терезах 10г, додають 50 см3 алюмокалієвих квасців, усе переносять у конічну колбу ємкістю 500 см3 з пробіркою, струшуємо протягом 5 хвилин, потім переносимо у стакан і поміщаємо висушені електроди.
|
|
|
|
|
Дата добавления: 2017-01-14; Просмотров: 268; Нарушение авторских прав?; Мы поможем в написании вашей работы!