
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Диссоциация кислот, оснований
|
|
|
|
Согласно теории электролитической диссоциации Аррениуса, кислотой называется вещество, которое при диссоциации отщепляет свободные ионы водорода Н+, а основанием – вещество, которое при
диссоциации отщепляет свободные ионы гидроксида ОН-. Основания, образованные щелочными металлами (Li, Na, K и т.д.), являются сильными электролитами (a»1) и называются щелочами. Диссоциация кислот и оснований протекает ступенчато: последовательно отщепляется ион Н+ (или ОН -), т.е. число ступеней зависит от основности кислоты (числа атомов Н в молекуле) или от кислотности основания (числа гидроксидных групп ОН -). Например: диссоциация Н3РО4 протекает в три ступени:
I Н3РО4 ⇄ Н+ + Н2РО4- a 1 < 1;
II Н2РО4 - ⇄ Н+ + НРО42-, a 2 <a 1;
III НРО42- ⇄ Н+ + РО43 - , a 3 <a 2 <a 1;
а Zn(OH)2 в две ступени:
I Zn(OH)2 ⇄ ZnOH+ +OH -; II ZnOH+ ⇄ Zn2++ OH -
Процесс диссоциации солей определяется типом соли: средние соли распадаются одноступенчато, диссоциация кислых и основных определяется «остатком» кислоты (или основания) в составе соли. Например, основная соль MgOHCl диссоциирует в 2 ступени:
I. MgOHCl ⇄ MgOH+ + Cl -, a =1; II. MgOH+ ⇄ Mg2+ + OH - a <1.
Обратимый процесс диссоциации слабых электролитов характеризуется константой диссоциации Кд. Например, для слабой уксусной кислоты, процесс диссоциации которой идет в соответствии с уравнением CH3COOH ⇄ H+ + CH3COO -,
Кд = 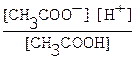 . В зависимости от величины Кд
. В зависимости от величины Кд
электролиты подразделяются на сильные (Кд > 10-3) и слабые (Кд < 10 -3). Кд зависит только от природы электролита и температуры и является табличной величиной.
Для слабых электролитов бинарного типа (распадаются на один катион и один анион) взаимосвязь между исходной концентрацией растворенного вещества (молярностью См), концентрациями ионов, нераспавшихся молекул, степенью и константой диссоциации выражается законом разведения (разбавления) Оствальда:
Реакция диссоциации АВ ⇄ А+ + В-
Концентрации ионов в растворе [A+] = [B-] = a Cм
Концентрация нераспавшихся молекул [AB] = (1- a) Cм
Уравнение Оствальда для слабых (ά→0, Кд <10- 4) электролитов Кд = a 2См
|
|
|
|
|
Дата добавления: 2015-07-13; Просмотров: 384; Нарушение авторских прав?; Мы поможем в написании вашей работы!