
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Образование слабых электролитов
|
|
|
|
Выделение газа
Образования осадка
Реакции ионного обмена.
Для растворов электролитов характерны реакции ионного обмена. Обязательным условием протекания таких реакций практически до конца является удаление из раствора тех или иных ионов вследствие:
FeSO4 + 2 NaOH ® Fe(OH)2¯ + Na2SO4 - молекулярное уравнение (МУ)
Fe2++SO42-+2Na++2OH-®Fe(OH)2¯+2Na++SO42— ионно-молекулярное уравнение (ИМУ)
Fe2+ +2OH- ® Fe(OH)2¯ (ПР Fe(OH)2 = 4,8×10-16) – краткое ионно-молекулярное уравнение образования осадка
Na2CO3 + 2H2SO4 ® H2CO3 + 2NaHSO4 (МУ)
2Na+ +CO32- + 2H+ + 2HSO4- ® H2C03 + 2Na+ + 2HSO4- (ИМУ)
2H+ + CO32- ® H2C03 ® H2O + C02 - ионно-молекулярное ур-е
образования летучего соединения.
а). Простые вещества.
2KCN + H2SO4 ®2HCN + K2SO4 (МУ)
2K+ + 2CN- + 2H+ +SO42- ® 2HCN + 2K+ +SO42- (ИМУ)
CN- + H+ ® HCN (Кд HCN = 7,8•10-10) –ионно-молекулярное ур-е образования слабого электролита HCN.
б).Комплексные соединения.
ZnCl2 + 4NH3 ® [Zn (NH3)4]Cl2 (МУ)
Zn2+ + 2Cl- +4NH3 ® [ Zn (NH3)4]2+ + 2Cl- -(ИМУ)
Zn2++4NH3 ® [Zn(NH3)4]2+- краткое ионно-молекулярное уравнение образования комплексного катиона.
Встречаются процессы, при которых слабые электролиты или малорастворимые соединения входят в число исходных веществ и продуктов реакции. Равновесие в этом случае смещается в сторону образования веществ, имеющих наименьшую константу диссоциации или в сторону образования менее растворимого вещества:
А) NH4OH + HCl ® NH4Cl + H2O (МУ)
NH4OH + H+ + Cl- ® NH4+ + Cl- + H2O (ИМУ)
NH4OH + H+ ® NH4+ + + H2O (ИМУ)
Кд( NH4OH) =1,8× 10-5 > Кд( H2O) =1,8×10-16
Равновесие сдвинуто в сторону образования молекул воды.
Б) HCN + CH3COONa ® NaCN + CH3COOH (МУ)
HCN + CH3COO- + Na+ ® Na+ + CN- + CH3COOH (ИМУ)
HCN + CH3COO- ® CN- + CH3COOH
Kд( HCN)=7,9× 10-10 < Кд( CH3COOH) =1,8 ×10-5
Равновесие сдвинуто в сторону образования HCN.
В) AgCl¯ + NaI ®AgI¯ + NaCl (МУ)
AgCl¯ + Na+ +I- ®AgI¯+ Na+ +Cl- (ИМУ)
AgCl¯ + I- ®AgI¯ + Cl- ПР AgCl=1,78×10-10 > ПР AgI =8,3×10-17
Равновесие сдвинуто в сторону образования осадка AgI.
Г) Могут встречаться процессы, в уравнениях которых есть и малорастворимое соединение и слабый электролит
MnS¯ + 2HCl ® MnCl2 + H2S
MnS¯ + 2H+ +2Cl- ® Mn 2+ + 2Cl- + H2S
MnS¯ + 2 H+ ® Mn2+ + H2S
ПР MnS=2,5×10-10; [S-2]= 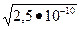 =1,58.10-5 моль/л
=1,58.10-5 моль/л
Kд H2S= K1×K2 = 6×10-22; [S2-] = 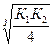 =5,4.10-8 моль/л
=5,4.10-8 моль/л
Связывание ионов S2- в молекулы H2S происходит полнее, чем в MnS, поэтому реакция протекает в прямом направлении.
|
|
|
|
|
Дата добавления: 2015-07-13; Просмотров: 476; Нарушение авторских прав?; Мы поможем в написании вашей работы!