
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Произведение растворимости
|
|
|
|
Вещества, в зависимости от своей природы, обладают различной растворимостью в воде, которая колеблется от долей миллиграмма до сотен граммов на литр. Трудно растворимые электролиты образуют насыщенные растворы очень маленьких концентраций, поэтому можно считать, что степень их диссоциации достигает единицы. Таким образом, насыщенный раствор труднорастворимого электролита представляет собой систему, состоящую из собственно раствора, находящегося в равновесии с осадком растворенного вещества. При постоянных внешних условиях скорость растворения осадка равна скорости процесса кристаллизации.
КnАm ⇄ n К+m + mA-n (1)
осадок раствор 8
Для описания этого гетерогенного равновесного процесса используют константу равновесия, называемую произведением растворимости ПР = [K+m]n[A-n]m, где [K+m] и [A-n] – концентрации ионов в насыщенном растворе (моль/л). Например:
AgCl= Ag+ +Cl -, ПР = [Ag+] [Cl-]; здесь n=m=1.
PbI2 = Pb2+ +2I-, ПР =[Pb2+][I-]2; здесь n=1, m=2.
ПР зависит от природы растворенного вещества и температуры. ПР является табличной величиной. Зная ПР, можно вычислить концентрацию насыщенного раствора вещества, а также оценить его растворимость в г на 100 мл воды (величина s, приводимая в справочной литературе) и определить возможности выпадения вещества в осадок.
Для уравнения (1) взаимосвязь концентрации насыщенного раствора трудно растовримого вещества (См, моль/л) с величиной ПР определяется следующим уравнением: 

 , где n и m –стехиометричекие коэффициенты в ур. 1.
, где n и m –стехиометричекие коэффициенты в ур. 1.
Задача 5. Концентрация насыщенного раствора (См) Mg(OH)2 равна 1,1 • 10-4 моль/л. Записать выражение для ПР и вычислить его величину.
Решение: В насыщенном растворе Mg(OH)2 устанавливается равновесие между осадком и раствором Mg(OH)2 ⇄ Mg2++2OH-, для которого выражение ПР имеет вид ПР = [Mg2+][OH-]2. Зная концентрации ионов, можно найти его численное значение. Учитывая полную диссоциацию Mg(OH)2, концентрация егонасыщенного раствора
См= [Mg2+]= 1,1×10-4 моль/л, а [OH-] = 2[Mg2+] = 2,2×10-4 моль/л. Следовательно, ПР = [Mg2+][OH-]2 =1,1. 10-4× (2,2 10-4)2 = 5,3. 10-12.
Задача 6. Вычислить концентрацию насыщенного раствора и ПР хромата серебра, если в 0,5л воды растворяется 0,011 г соли.
Решение: Для определения молярной концентрации насыщенного раствора Ag2CrO4 воспользуемся формулой CM = 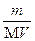 , где m - масса растворенного вещества (г), М- молярная масса (г/моль), V - объем раствора (л). М (Ag2CrO4) =332 г/моль. См =
, где m - масса растворенного вещества (г), М- молярная масса (г/моль), V - объем раствора (л). М (Ag2CrO4) =332 г/моль. См = 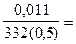 9,48.10-5 моль/л. Растворение хромата серебра (I) сопровождается полной (a=1) диссоциацией соли Ag2CrO4 ⇄ 2Ag++ CrO42-, ПР =[Ag+]2[CrO42-], где [CrO42-] = См = 9,48.10-5 моль/л, а [Ag+] = 2 [CrO42-]=1,896× 10-4.
9,48.10-5 моль/л. Растворение хромата серебра (I) сопровождается полной (a=1) диссоциацией соли Ag2CrO4 ⇄ 2Ag++ CrO42-, ПР =[Ag+]2[CrO42-], где [CrO42-] = См = 9,48.10-5 моль/л, а [Ag+] = 2 [CrO42-]=1,896× 10-4.
Т.о. ПР = (1,896× 10-4)2 (9,48 ×10-5) = 3,4 ×10-12.
Задача 7. Можно ли приготовить растворы соли СаСО3 с концентрациями СаСО3 С1 =10-2 М и С2 = 10-6 М, если ПР СаСО3 = 3,8× 10-9.
Решение: Зная величину ПР, можно рассчитать концентрацию
насыщенного раствора соли и, сравнив ее с предлагаемыми
концентрациями, сделать вывод о возможности или невозможности приготовления растворов. Растворение карбоната кальция протекает по схеме CaCO3 ⇄ Ca2+ +CO32- В данном уравнении n = m = 1, тогда
 =
=  ≈ 6,2•10-5моль/л
≈ 6,2•10-5моль/л
С1> См – раствор приготовить нельзя, т.к. будет выпадать осадок.
С2< См – раствор приготовить можно. 10
|
|
|
|
|
Дата добавления: 2015-07-13; Просмотров: 1380; Нарушение авторских прав?; Мы поможем в написании вашей работы!