
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Примеры решения задач. Задача 1.Рассчитать концентрацию ионов водорода в растворе HCN (См = 10-3М), если a = 4,2∙10-3
|
|
|
|
Задача 1. Рассчитать концентрацию ионов водорода в растворе HCN (См = 10-3М), если a = 4,2∙10-3.
Решение: Диссоциация цианистоводородной кислоты протекает по уравнению HCN ⇄ H+ + CN -; концентрации ионов [H+] и [CN - ] в
растворе равны между собой (т.к. n Н+ : n СN- = 1:1,
где n - стехиометрические коэффициенты) т.е. [H+] = [CN - ] = a Cм, моль/л; Тогда [H+]=[CN - ] = 4,2∙10-3∙ 10-3 = 4,2×10-7 моль/л.
Задача 2. Рассчитать концентрацию ионов водорода и гидроксид-ионов в рстворе NH4OH, концентрацией См= 0,01М, если Кд = 1,8×10-5.
Решение: Гидроксид аммония диссоциирует следующим образом:
NH4OH ⇄ NH4+ + OH- константа диссоциации имеет вид Кд = 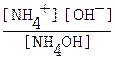 ; концентрации ионов аммония [NН4+] и гидроксида [OH-] совпадают (n (NH4+): n (OH-) = 1:1), обозначим их за х:
; концентрации ионов аммония [NН4+] и гидроксида [OH-] совпадают (n (NH4+): n (OH-) = 1:1), обозначим их за х:
[NH4+] = [OH-] = х моль/л, тогда выражение для Кд примет вид
1,8×10-5 = х 2/ 0,01- х. Считая, что х << См, решаем уравнение
1,8×10-5=x2/ 0,01, относительно х: х = 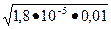 =4,2∙10-4моль/л; [OH-]= 4,2∙10-4 моль/л.
=4,2∙10-4моль/л; [OH-]= 4,2∙10-4 моль/л.
Концентрации ионов водорода и гидроксида связаны через ионное произведение воды Кw = [H+][OH-] =10-14, выразим концентрацию ионов водорода [H+] = Kw /[OH-] и рассчитаем её значение [H+]=1×10-14/4,2×10-4 @ 2,3×10-11моль/л.
Задача 3. Определить рН раствора НСl (a =1), если См =2∙10-3 М
Решение: Диссоциация соляной кислоты протекает по уравнению
HCl ® H+ + Cl-, концентрация ионов водорода [H+] = a Cм =1∙2∙10-3 = 2∙10-3 моль/л. Водородный показатель рН = - lg[H+] = - lg2∙10-3 = 2,7. Ответ: рН=2,7
Задача 4. Определить молярную концентрацию гидроксида аммония, если рН=11, а Кд =1,8∙10-5.
Решение: Концентрация ионов водорода [H+]=10-pH=10-11моль/л. Из ионного произведения воды определяем концентрацию [OH-] = Kw /[H+] = 10-14/10-11=10-3моль/л. Гидроксид аммония - слабое основание и характеризуется уравнением реакции диссоциации
NH4OH ⇄ NH4+ + OH-. Выражение для константы диссоциации
Кд =. 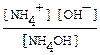 из закона Оствальда следует, что [NH4+ ] = [OH-] = a ∙Cм, а Кд = a 2См. Объединяя уравнения, получим См= [OH-]2 /Kд = 10-6/ 1.8∙10-5 = 0,056 моль/л
из закона Оствальда следует, что [NH4+ ] = [OH-] = a ∙Cм, а Кд = a 2См. Объединяя уравнения, получим См= [OH-]2 /Kд = 10-6/ 1.8∙10-5 = 0,056 моль/л
|
|
|
|
|
Дата добавления: 2015-07-13; Просмотров: 457; Нарушение авторских прав?; Мы поможем в написании вашей работы!