
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Физиологические иммунодефициты
|
|
|
|
К физиологическим иммунодефицитам можно отнести иммунодефициты беременных, новорожденных и частично возрастные.
Иммунодефицит беременных связан прежде всего с ингибирующим действием (во время беременности) гормонов (кортикостероидов) и биологически активных веществ желтого тела и плаценты (прогестерона и др.), действующих как на центральные органы иммунной системы (с частичной инволюцией тимуса), так и местно — плацентарно. При этом в популяции Т-лимфоцитов повышается доля Т-супрессоров, подавляющих образование цитотоксических лимфоцитов и ингибирующих активацию В-лимфоцитов и, как следствие, антителообразование. Не исключена возможность появления иммунодефицита у беременных путем нейтрализации антител и эффекторных лимфоцитов регуляторными антиантителами (антиидиотипическими антителами).
Иммунодефицит у новорожденных проявляется прежде всего почти полным отсутствием синтеза антител в первые дни после рождения, что компенсируется поступлением в их организм готовых антител из материнского организма, или через плаценту (люди, приматы, кролики, морские свинки), или через молозиво (лошади, свиньи, жвачные), или частично через плаценту и преимущественно через молозиво (собаки, мыши, крысы).
Иммунодефицит у новорожденных можно было бы отнести к врожденному, но он не является следствием генетических дефектов эмбрионального развития, характерных для различных врожденных иммунодефицитов. У новорожденных относительно развита Т-система лимфоцитов и завершается антигеннезависимая стадия формирования клонов В-лимфоцитов; формирования же антигензависимых плазматических клеток, а следовательно, и синтеза антител практически не происходит вследствие отсутствия в эмбриональный период антигенной стимуляции. После рождения требуется время для первичного иммунного ответа на поступающие в организм многочисленные и разнообразные антигены с образованием клеток памяти, плазматических клеток и синтезом специфических антител. Именно в этот период (т. е. период новорожденности) и имеет место наиболее выраженный дефицит собственных иммуноглобулинов в организме, компенсируемый пассивным иммунитетом за счет материнских антител. В связи с тем что иммуноглобулины класса IgG поступают в организм плода через плаценту главным образом в конце беременности, иммунодефицит особенно выражен у недоношенных новорожденных детей.
А.М.Петров (1995, 1998) выявил особую разновидность иммунодефицита — иммунодефицит новорожденных телят-трансплантантов, имеющих по отношению к родившим их коровам-реципиентам 100 % чужеродного генетического материала. Новорожденные телята-трансплантанты имеют еще больший иммунодефицит, чем обычные телята, особенно в отношении синтеза антител, который в гораздо меньшей мере компенсируется приемом молозива. Телята-трансплантанты в отношении развития иммунной системы имеют некоторые функциональные признаки недоношенности.
Однако и эту разновидность иммунодефицита можно включить в группу физиологических, так как при соблюдении соответствующих гигиенических условий содержания и полноценном кормлении телята-трансплантанты развиваются нормально и к 6-месячному возрасту у них, как и у обычных телят, завершается становление всех иммунологических параметров.
Возрастные иммунодефициты, вероятно, частично связаны с генетически запрограммированными процессами, а частично являются следствием патологических процессов, происходящих в организме в течение индивидуального развития. В частности, значительной физиологической инволюции подвергается тимус, особенно в период полового созревания и с наступлением старости.
Физиологическая инволюция тимуса у человека фактически начинается с первого года жизни, хотя общая масса паренхимы тимуса и уровень тимических гормонов достигают своего максимума к 10-летнему возрасту. Усиление атрофии паренхимы тимуса с уменьшением продукции тимических гормонов и Т-лимфоцитов происходит в возрасте 10—20 лет, а в возрасте 25—40 лет скорость атрофии паренхимы тимуса достигает 5 % в год и резко снижается продукция тимических гормонов и Т-лимфоцитов. После 80 лет в тимусе остаются лишь мелкие островки эпителиальных клеток с небольшим количеством лимфоцитов, а продукция тимических гормонов снижается более чем на 50%.
Возрастное снижение функции тимуса с последующим накоплением мутантных форм соматических клеток и развитием хронического аутоиммунного конфликта является, по-видимому, одной из главных причин иммунодефицита при старении.
С некоторым отставанием от инволюции тимуса происходит инволюция всех периферических органов иммунной системы.
В связи со снижением функциональной активности центральных и периферических органов иммунной системы с
возрастом снижаются реакции клеточного иммунитета (уменьшаются как количество, так и активность Т-клеток); становится меньше концентрация Ig, прежде всего секреторного IgA, что ведет к повышению чувствительности эпителиальных покровов в отношении инфицирования.
С возрастом угнетается способность макрофагов и Т-лимфоцитов к контакту с антигеном, к его переработке и распознаванию; в субпопуляции Т-лимфоцитов увеличивается преобладание Т-супрессоров.
В целом с возрастом снижается способность иммунной системы к ответу на экзогенные антигены, что снижает резистентность организма к инфекции и повышает риск возникновения злокачественных опухолей; в то же время повышается сенсибилизация иммунной системы к аутоантителам, что способствует, как указано выше, увеличению аутоиммунной патологии. Выраженность аутоиммунных процессов при старении животных находится в обратной зависимости от способности к нормальному иммунному реагированию, которое, в свою очередь, обусловлено нормально функционирующим тимусом, контролирующим созревание Т-лимфоцитов, и опосредованно В-лимфоцитов. Характер возрастной инволюции тимуса различен у животных разных видов и в значительной мере коррелирует с продолжительностью жизни.
Тема 4. ПАТОЛОГИЧЕСКИЕ ИММУНОДЕФИЦИТЫ (АЛИМЕНТАРНЫЕ, ВИРУСНЫЕ ИММУНОДЕФИЦИТЫ ЧЕЛОВЕКА, СТРЕССОВЫЕ, ЭКОЛОГИЧЕСКИЕ, ИММУНОДЕФИЦИТЫ, ВЫЗЫВАЕМЫЕ ЛЕКАРСТВЕННЫМИ ПРЕПАРАТАМИ)
Приобретенная патологическая недостаточность специфических и неспецифических факторов резистентности является результатом патологических изменений в постнатальном периоде и встречается чаще, чем наследственная.
Приобретенные иммунодефициты возникают при состояниях, сопровождающихся потерей белка (голодание, болезни почек, некоторые болезни крови), при ожогах, тяжелых травмах, хирургических вмешательствах, ряде злокачественных опухолей, инфекционных болезней, воздействии некоторых иммунотоксических лекарственных препаратов и экологических факторов.
При бактериальных инфекциях (лепра, туберкулез, сифилис, бруцеллез, пневмококк, менингококк, скарлатина, коклюш и др.) важную роль в развитии иммунодефицитов играют липополисахариды и элементы цитоплазмы, нарушающие функции тимуса и подавляющие функцию моноцитомакрофагальной системы. При протозойных и гельминтных болезнях возможны нарушения иммунорегуляции, угнетение функции макрофагов (малярия), выработка лимфоцитотоксинов (трихинеллез, опи-сторхоз) или супрессивно действующих факторов (шисто- и трипаносомоз).
Наиболее активное воздействие на иммунную систему оказывают:
алиментарные иммунодефицита;
вирусные инфекции, вызывающие вирусный иммунодефицит (вирусный СПИД);
стрессорные факторы, вызывающие стрессовый иммунодефицит (стрессовый СПИД);
экологические факторы, вызывающие экологический иммунодефицит (экологический СПИД);
иммунодефицита, вызываемые лекарственными препаратами.
Алиментарные иммунодефициты. Недостаточное питание может влиять на различные формы иммунной реактивности: Т-клеточный иммунитет, продукцию антител и цитокинов, фагоцитарную функцию, активность системы комплемента.
Алиментарные иммунодефицита у сельскохозяйственных животных наиболее выражены при истощении, вызванном недостаточным по общей питательности, особенно по белку, кормлении. Ускоряют развитие алиментарных иммунодефицитов содержание животных в сырых и холодных помещениях, чрезмерная работа, беременность, лактация. При длительном недоедании белковое голодание сочетается с витаминно-минеральным, что может привести к нарушениям обмена веществ, понижению нейроэндокринной регуляции различных функций в организме, атро-фическим и дистрофическим изменениям органов и систем, в том числе к атрофии лимфоидной ткани. При этом резко угнетаются функции как неспецифических факторов резистентности, так и специфического иммунитета, т. е. все формы иммунной реактивности, и, как следствие, снижается сопротивляемость организма животных к инфекционным и паразитарным заболеваниям.
Аналогичные иммунодефицитные состояния возникают у животных при истощении, не связанном с недостаточностью питательных веществ в рационе, а обусловленном различными системными нарушениями в организме (опухолевые заболевания, хронические инфекции, почечные, эндокринные расстройства, множественные травмы и др.).
Различной выраженности иммунодефициты возможны при частичной (качественной) недостаточности питания.
При качественной недостаточности белкового питания, в том числе при недостатке в рационе незаменимых аминокислот, возможны угнетение синтеза антител, цитокинов, компонентов комплемента, нарушение клеточной пролиферации, в том числе лимфоцитов.
При инфицировании животных, в рационе которых имеется недостаток селена и меди, вирусы могут мутировать и изменять свою вирулентность; при недостатке цинка происходят нарушение функции Т-клеток, снижение соотношения клеток с CD4+/CD8+-мapкepaми, ослабление кожных реакций ГЧЗТ: при недостатке железа нарушается функция ЕК-клеток, уменьшается способность нейтрофилов уничтожать бактерии и грибы вследствие снижения активности железозависимых ферментов, обеспечивающих функции лимфоцитов и фагоцитов.
При недостатке в рационе полиненасыщенных жирных кислот (линоле-вой, линоленовой, арахидоновой), которые иногда относят к группе витаминов F, возможно нарушение структуры и функции клеточных мембран, регуляции внутриклеточных процессов, а также клеточных реакций, индуцируемых внедрившимся в ткань патогеном. Как известно, производные арахидоновой кислоты (простогландины, лейкотриены, тромбоксаны), продуцируемые активизированными тучными клетками, базофилами и эозинофилами, участвуют в осуществлении местной воспалительной реакции, увеличивая проницаемость капилляров в очаге воспаления и выполняя роль хемоаттрактантов для фагоцитов (см. разделы 1.2 и 2.2.1), тем самым способствуя устранению патогенных агентов из организма.
В связи с тем что витамин А (ретинол) после превращения в организме в гормон — ретиноевую кислоту оказывает системные эффекты на рост и дифференцировку нервной, костной ткани эпителиальных покровов желудочно-кишечного тракта, верхних дыхательных, мочеполовых путей, кожи, конъюнктивы, роговицы, участвует в транскрипции мРНК, индуцировании синтеза белка, в том числе иммуноглобулинов и компонентов мембран, а также необходим для нормального функционирования мембран, его недостаток существенно отражается на резистентности животных и человека.
Недостаток витамина А прежде всего неблагоприятно сказывается на структуре эпителия, приводя к метаплазии клеток, гиперкератозу (ороговению) эпителия, ослаблению его защитных свойств, повышенному связыванию бактерий и их проницаемости через эпителиальные покровы (открываются «ворота инфекции»), уменьшению числа некоторых субпопуляций лимфоцитов, снижению их реакции на антиген, уменьшению синтеза антител и ослаблению устойчивости организма животного к инфекции.
Витамины группы Е (α-, β-, γ-, δ-токоферолы) являются наиболее активными природными жирорастворимыми антиоксидантами. Входя в комплексе с непредельными жирными кислотами в состав клеточных мембран, токоферолы стабилизируют их, предотвращая окисление непредельных жирных кислот и витамина А, тем самым способствуя лучшему их использованию, а том числе в регуляции иммунного ответа. Имеются сведения об участии витаминов Е в регуляции уровня транскрипции мРНК, синтеза белка, биологического окисления и образовании в клетках основного источника энергии — АТФ. Можно предположить особенно важную роль витаминов Е в активированных фагоцитах — в защите их мембран от действия наиболее реактивных форм кислорода во время так называемого «кислородного взрыва».
В известной мере недостаток любого витамина может вызвать различно выраженный иммунодефицит. В частности, при недостаточности витаминов В6 и фолиевой кислоты происходит нарушение клеточного иммунитета, в том числе пролиферации лимфоцитов.
Вирусные иммунодефициты. Нарушения различных звеньев иммунной системы выявлены при многих вирусных инфекциях, в том числе при острых (корь, грипп, краснуха, паротит) и персистирующих (герпес), а также при вирусных инфекциях иммунной системы (ВИЧ, лейкоз крупного рогатого скота).
Механизмы формирования и продолжительности иммунодефицитных состояний при участии вирусов разнообразны, что можно проследить на примере иммунодефицитов, вызываемых вирусами гриппа, простого герпеса и семейства ретровирусов.
Все вирусы гриппа (типы А, В, С) являются РНК-содержащими, состоят из восьми молекул РНК. Из них наиболее изменчив вирус А, имеющий три подтипа (А1, А2, А3) и несколько штаммов. Вирус гриппа А особенно изменчив по поверхностным белкам — гемагглютинину и нейраминидазе, вирусы В и С более стабильны. Вирус гриппа вызывает прежде всего снижение количества и функциональной активности Т-лимфоцитов, наиболее выраженное при заболевании, вызванном новым подтипом вируса А, полностью отличающимся по структуре гемагглютини-на и нейраминидазы от вирусов, с которыми заболевшие встречались ранее (Шварцман Я. С. и др., 1979).
Прямое воздействие вируса гриппа на Т-лимфоциты вызывает в первую очередь поражение их рецепторного аппарата, что ведет к резкому нарушению функции Т-лимфоцитов и утрате в значительной степени их способности к рециркуляции. Вирус гриппа может оказывать и опосредованное действие на иммунную систему, влияя на синтез кортикостероидных гормонов.
Иммунодефицит при гриппе усиливается повреждающим действием вируса гриппа на макрофаги и нейтрофилы. У поврежденных вирусом фагоцитов снижаются литическая активность и цитотоксичность, уменьшается число цитоплазматических гранул, подавляется хемотаксис.
У больных гриппом хемотаксис фагоцитов возвращается к норме не ранее чем через 3 нед после выздоровления, а полное восстановление популяции Т-лимфоцитов периферической крови происходит не ранее чем через 4 нед от начала болезни. Следовательно, иммунодефицит при гриппе носит временный характер и относительно непродолжителен — около 4 нед. Однако в этот период иммунодефицит у больных гриппом может быть причиной активации латентных форм инфекций (например, герпеса) или более тяжелого течения острых инфекций. Временное поражение Т-клеток вызывает и вирус кори.
Иммунитет у лиц, переболевших гриппом А, сохраняется I—3 года, гриппом В — 3—6 лет. У новорожденных детей возможен непродолжительный пассивный иммунитет, передаваемый им через плаценту от матерей, имеющих иммунитет против гриппа.
Вирусы простого герпеса состоят из одной молекулы двухцепочечной ДНК, являются внутриклеточными паразитами, проникающими внутрь клетки-хозяина путем рецепторного пиноцитоза. Вирусная ДНК аккумулируется в ядре инфицированной клетки, где происходят ее депротеинизация, транскрипция и репликация с помощью клеточных и вирусных ферментов.
Основными путями заражения вирусом простого герпеса являются воздушно-капельный и половой. Имеются сведения, что вирус герпеса встраивается в генный аппарат клетки человека и передается дочерним клеткам при каждом следующем делении. Вирус содержится в слюне, слезах, крови, моче, сперме, спинномозговой жидкости, молоке. Болезнь в основном ограничивается воротами внедрения вируса (кожа губы, конъюнктива, гениталии) и нервной тканью, иннервирующей место инокуляции. Однако в случае наличия иммунодефицита в момент инфицирования или при реактивации латентного вируса возможна генерализация вируса (в региональные лимфатические узлы, кровь, внутренние органы).
Для вируса простого герпеса характерна пожизненная персистенция в виде двухнитевых кольцевых форм ДНК с нейронах чувствительных и вегетативных ганглиев, а также в коже (в латентном состоянии) с периодической реактивацией. Провоцирование рецидивов происходит преимущественно за счет вирусов, находящихся в ганглиях. Возможна периодическая циркуляция вируса из нейронов в клетки эпителия ин-трааксонально и обратно — из эпителиальных клеток через нервные окончания в нейрон и далее в ганглий. Во время ре-инфицирования ганглия могут появиться новые фокусы латентной инфекции, проникающей в них через соседние сенсорные нервные окончания.
В противовирусной защите при инфицировании вирусом простого герпеса участвуют как неспецифические факторы защиты (нейтрофилы, макрофаги, естественные киллеры, а и (3-интерфе-роны), так и специфические иммунные реакции, причем первые играют ведущую роль при первичной инфекции, а вторые приобретают важное значение при вторичной инфекции (Сухих Г. Т. и др., 1997).
При простом герпесе у больных имеет место иммунодефицит, выражающийся в угнетении функциональной активности моноцитов, макрофагов (угнетение хемотаксиса, снижение антителоза-висимой цитотоксичности и фагоцитоза), иммунокомпетентных клеток и в нарушении регуляторных взаимоотношений в иммунной системе (увеличение числа супрессорных клеток и вырабатываемого ими супрессорного вирус-специфического фактора, подавляющего вызванную вирусом пролиферацию иммунокомпетентных клеток).
Вызвать рецидив могут переохлаждение, перегревание, беременность, большая доза алкоголя, психическая травма, другие инфекционные заболевания (например, грипп, ослабивший иммунную систему).
Вторичное появление эндогенных вирусных антигенов, связанное с рецидивами заболевания, в свою очередь, сильно подавляют иммунные реакции, создавая условия для активной, не сдерживаемой репликации вируса герпес, для развития других инфекций, а также повышает риск возникновения злокачественных опухолей.
Наиболее тяжелый вирусный иммунодефицит вызывает вирус иммунодефицита человека (ВИЧ). Синдром приобретенного иммунодефицита (СПИД) развивается в течение 9—10 лет у половины инфицированных ВИЧ-инфекцией, протекаете поражением иммунной и нервной систем и проявляется развитием тяжелых инфекционных заболеваний и злокачественных новообразований.
ВИЧ относится к семейству ретровирусов — РНК-содержащих вирусов, обладающих ферментом обратной транскриптазой (рис. 1), способной на матрице РНК синтезировать ДНК (провирус), которая может интегрироваться в геном инфицированной клетки. К ретровирусам также относятся вирусы лейкоза крупного рогатого скота, кошек и птиц, опухолей молочных желез мышей (подсемейство Oncovirinae), прогрессирующей пневмонии мэди и висны овец (подсемейство Lentivirinae).
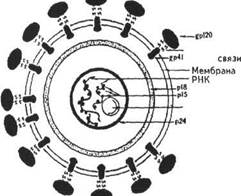
|
Для вирусов подсемейства Lentivirinae, к которому относят и ВИЧ, установлена одна характерная особенность: существенная часть синтезиро-ванной в инфицированной клетке вирусной ДНК не интегрирует с клеточным геномом, обеспечивая независимость размножения вируса от деления клеток.
Рис. 1. Схема молекулярной организации ВИЧ (Кожемякин Л. А. и др., 1990):
gp — гликопротеин; р — протеин
Количество ВИЧ-ДНК в крови и ВИЧ-РНК в плазме инфицированных людей различно и коррелирует с клиническим состоянием пациента. Содержание ВИЧ-ДНК в крови разных людей колеблется от нескольких копий до сотен и тысяч на 10 тыс. лимфоцитов всех типов. Среди всех лейкоцитов крови инфицированными бывают от 0,1 до 13 %, а среди имеющих на поверхности клеточной мембраны СД4-рецепторы (Т-хелперы и макрофаги) — от 0,2 до 69 %. В плазме может содержаться от 100 до 22 млн молекул РНК на 1мл плазмы. Количество РНК в плазме минимально при асимптоматичной фазе и велико при развернутом СПИДе. В ходе противовирусной терапии отмечается снижение как ВИЧ-РНК п плазме, так и ВИЧ-ДНК в клетках.
Прикрепительным белком ВИЧ является поверхностный белок гликопротеин (gp 120), специфическим клеточным рецептором для которого является детерминанта СД. В связи с этим клетками-мишенями (СД4-содержащи-ми) для ВИЧ являются Т-хелперы, макрофаги, моноциты, астроциты — глиальные клетки ЦНС, эпителиальные клетки слизистой оболочки прямой кишки.
Моноциты и макрофаги ВИЧ-инфицированных больных характеризуются сниженными бактерицидной активностью, способностью к хемотаксису, а также функциями рецепторов к Fc-фрагментам иммуноглобулинов.
Повреждение клеток, несущих на поверхности СД4-рецепторы, происходит не только за счет их ВИЧ-инфицирования, но и в результате аутоиммунных реакций, стимулируемых вирусом. Установлено, что вирусный gp 120 индуцирует образование клонов цитотоксических Т-лимфоцитов, направленных на специфическое уничтожение всех своих Т-клеток и моноцитов, в том числе и неиндуцированных, но несущих на поверхности gp 120, который продуцируется зараженными клетками, разносится по организму и связывается с СД4-рецептора ми других клеток. Кроме того, обнаружено, что во внешних полипептидных цепях вирусного gp 120, мембранных белков ГКГС класса II антигенраспознающих клеток и белка CD4 находится один и тот же повторяющийся тетрапептид (арг-фен-асп-сер), являющийся высокоиммуногенным, стимулирующим выработку антител на ВИЧ и одновременно блокирующим кооперативное взаимодействие иммунокомпетентных клеток.
ВИЧ-инфекция вызывает дисфункцию В-системы иммунитета, в том числе поликлональную активацию В-клеток, приводящую к развитию гипергам-маглобулинемии всех классов, но особенно IgA и IgG. Однако, несмотря на то, что суммарная концентрация иммуноглобулинов сыворотки крови при ВИЧ-инфекции повышена, имеет место диспропорция уровней подклассов иммуноглобулинов, в частности IgG, среди которых существенно уменьшена концентрация IgG2 и IgG4 В связи с этим у ВИЧ-инфицированных наблюдается повышенная восприимчивость к пневмо-и стафилококкам.
Прямое и аутоиммунное повреждающее действие вируса на Т-хелперы и другие клетки ведет к постепенному их уменьшению в организме и, как следствие, к недостаточности Т-зависимых иммунных реакций, расстройству регуляции всей иммунной системы, прогрессивному снижению резистентности организма, развитию различных инфекционных заболеваний (кандидоз ротовой полости, опоясывающий лишай и другие генетические поражения, различные кожные и другие, в том числе тяжелые, оппортунистические инфекции) и злокачественных опухолей. Из опухолей наиболее часто развивается саркома Капоши — многоочаговая опухоль эн-дотелиального происхождения. С развитием этой опухоли ассоциирована инфекция, возбудителем которой является вирус герпеса человека.
Итак, при воздействии вирусной инфекции возможно развитие кратковременного (грипп, корь), периодически повторяющегося при реактивации латентных вирусов (герпес) и прогрессирующего с течением времени (ВИЧ-инфекция) иммунодефицита.
Стрессовые иммунодефициты. Вызываются длительным воздействием на организм стрессорных факторов (стрессоров), которые условно делят на физические (большие физические нагрузки, жара, холод, стихийные бедствия, травмы, хирургические операции, транспортировка животных), химические (интоксикация), биологические (инфекционный процесс), психоэмоциональные (у человека) — воздействующие на психику и вызывающие сильные эмоции (информационные перегрузки, социальная и политическая нестабильность, конфликты на работе и в семье, постоянный страх и неуверенность в завтрашнем дне, потеря близких). Стресс, являясь вначале адаптацией организма к неблагоприятным воздействиям, может перейти в стадию истощения, когда изменения, происходящие в организме, в том числе и в иммунной системе, зачастую становятся необратимыми.
Стресс проявляется центральными регуляторными перестройками, включающими эндокринные, нейромедиаторные, нейропептидные компоненты, сопровождающиеся значительными затратами энергии. Повышенный выброс в кровь кагехоламинов способствует стимуляции гликогенолиза и быстрой мобилизации энергоресурсов на ранней стадии стресс-реакции; глюкокортикоиды на более поздних стадиях стимулируют образование углеводов (для энергетических целей) из расщепленных белков и свободных аминокислот.
При стрессе наряду с гиперактивацией системы гипоталамус — гипофиз — надпочечники, способствующей резкому повышению концентрации в крови катехоламинов и глюкокортикоидов, происходит значительное увеличение концентрации опиоидных пептидов (эндорфинов и энкефалинов), которые при стрессе могут снижать болевую чувствительность.
Иммунокомпетентные клетки обладают рецепторами ко многим медиаторам стресса: катехоламинам, серотонину, кортикостероидам, эндорфинам и др. Кортикостероиды на ранних стадиях стресса подавляют активность Т-супрессоров, тем самым оказывая иммуностимулирующий эффект.
При чрезмерных стресс-нагрузках, когда функциональные и метаболические изменения от предыдущих воздействий не успевают нормализоваться, возникают нарушения, вызываемые избытком катехоламинов, кортикостероидов и опиоидных пептидов:
уменьшение количества всех субпопуляций Т-лимфоцитов (Т-киллеров, Т-супрессоров, Т-хелперов) и их функциональной активности;
нарушение соотношения Т-, В-лимфоцитов и макрофагов;
снижение функциональной активности макрофагов;
подавление синтеза и секреции цитокинов (интерлейкинов, интерферонов и др.);
угнетение фагоцитоза;
активация антителозависимой цитотоксичности.
Уровень иммуноглобулинов при стрессе может сохраниться в пределах нормальных значений.
В большинстве случаен стрессорная реакция создает условия для развития вторичных иммунодефицитов, как правило, сопровождающихся инфекционной патологией и повышением риска возникновения злокачественных опухолей, аутоиммунных заболеваний.
Стрессовые воздействия на материнский организм повышают содержание в молоке стресс-гормонов и стресс-медиаторов, вызывая соответствующие изменения в организме ребенка после приема молока.
Психоэмоциональный стресс может участвовать путем влияния на иммунную систему в развитии диффузного токсического зоба, сахарного диабета.
Прекращение стресса на определенном этапе может привести к восстановлению иммунных реакций.
Экологические иммунодефициты. Первичные, генетически детерминированные, и вторичные иммунные дефициты, возникающие под влиянием факторов окружающей среды физической, химической или биологической природы, являются предметом изучения экологической иммунологии.
Под экологическим иммунодефицитом чаще понимают иммунные дефициты у человека и животных, вызванные прежде всего физическими и химическими факторами, в том числе антропогенного характера.
Иммунная система является исключительно сложной многокомпонентной системой, состоящей из быстро делящихся, находящихся на различных стадиях дифференцировки клеток, наиболее чувствительных к воздействию различных, в том числе антропогенных, факторов. В связи с этим иммунная система человека и животных может быть высокочувствительной индикаторной системой, чутко реагирующей на наличие в регионе экологически неблагоприятной ситуации и одновременно наиболее уязвимой к воздействию многих химических и физически факторов.
Среди химических веществ, влияющих на иммунную систему человека и животных, только пестицидов (химических средств защиты растений) ежегодно поступает в окружающую среду нашей планеты около 1 млн т. Даже кратковременный контакт с пестицидами группы фосфорорганических соединений сопровождается резким снижением количества Т-хелперов, Т-супрессоров, функциональной активности естественных киллеров. При длительном контакте с хлор- и фосфорорганическими пестицидами происходят угнетение пролиферации и миграции стволовых кроветворных клеток, снижение количества и функциональной активности Т-лимфоцитов, в меньшей степени В-лимфоцитов, угнетение кооперативного взаимодействия Т- и В-лимфоцитов с макрофагами.
Чрезвычайно устойчивы во внешней среде полихлорциклические соединения типа диоксина (2, 3, 7, 8-тетрахлорди-бензопарадиоксин и др.), способные к кумуляции в организме и обладающие выраженными иммунотропным, канцерогенным и эмбриотоксическим действиями. Диоксины вызывают атрофию тимуса, супрессию биосинтеза мРНК, угнетение пролиферации клеток, и, как следствие, иммуносупрессорное влияние, главным образом воздействуя через В-лимфоциты (снижение титра противоинфекционных и антитоксических антител).
Помимо пестицидов и диоксинов иммунодефицитные состояния могут вызывать многие средства бытовой химии, побочные продукты промышленного производства (бензпирены, диоксиды азота, соли тяжелых металлов и др.), лекарственные препараты (кортикостероиды, иммуносупрессорные, противоопухолевые средства, антибиотики и др.).
Независимо от химической природы первым патогенетическим звеном воздействия большинства химических факторов является мембраноповреждающий эффект, сопровождающийся нарушением функции каскада митохондриальных и микросомальных элементов — оксигеназ, гидрогеназ, участвующих в детоксикации и элиминации патогенного агента. Затем следуют остальные процессы, реализуемые на клеточном, органном и организменном уровнях. При этом в основе патогенеза иммунологической недостаточности лежат механизмы, состоящие:
из затруднения захвата антигена фагоцитами вследствие прямого токсического действия химического фактора на клетки и угнетения гуморальных факторов естественной резистентности;
замедления обработки антигена и ухудшения передачи антигена в кооперативной клеточной системе макрофагами вследствие угнетения активности кислых гидролаз и изменения проницаемости лизосомных мембран;
ингибирования продукции антител вследствие угнетения биосинтеза белков поступающими в организм антибиотиками, диоксинами и др.
Иммунная система — одна из наиболее чувствительных систем организма и к действию ионизирующей радиации. Повышение радиационного фона возможно при локальных и особенно при крупных авариях на атомных электростанциях, атомных двигательных установках на морских судах, в космосе. Огромное количество радионуклидов было выброшено в атмосферу и выпало на земную поверхность в период испытаний атомного и ядерного оружия в 1945-1963 гг.
Под действием ионизирующего излучения подавляются как специфические факторы иммунитета (изменения тимуса, костного мозга, селезенки, лимфоузлов, снижение функциональной активности Т- и В-лимфоцитов лимфопения), так и неспецифические факторы (подавление фагоцитарной активности лейкоцитов, гранулоцитопения, снижение общей бактерицидной активности сыворотки крови, других жидких сред организма, бактерицидной активности крови, повышение проницаемости тканей, в частности эпителия дыхательных путей и желудочно-кишечного тракта в отношении различных антигенов, в том числе и микроорганизмов).
Снижение уровня общей резистентности организма проявляется в уменьшении минимальных инфицирующих доз микроорганизмов, увеличении числа случаев с тяжелым клиническим течением инфекционной болезни, обострением латентных форм инфекций.
Повышенные дозы ионизирующей радиации приводят к дистрофии лимфоидных тканей, играющих важную роль в обеспечении иммунного ответа организма.
По степени радиочувствительности иммунокомпетентные клетки располагаются от наиболее радиочувствительных к наименее радиочувствительным в следующем порядке: Т-супрессоры, Т-киллеры, В-клетки-предшественники, Т-хелперы, зрелые антителопродуцирующие клетки. Макрофаги (А-клетки), которые концентрируют антигены и служат местом взаимодействия Т- и В-клеток, относительно радиорезистентны. Они сохраняют свою способность перерабатывать антиген даже при дозах до
100 Гр, однако взаимодействие Т-клеток с В-клетками нарушается уже при дозе 5 Гр.
Эпителиальные ткани относятся к наиболее чувствительным, действие на них ионизирующей радиации и угнетающих факторов химической природы, в том числе алкоголя и цитотоксических препаратов, подавляет их барьерную функцию, которая в нормальном состоянии обеспечивается их морфологической структурой и бактерицидной активностью. Это влечет за собой интенсификацию процессов инфильтрации антигенов, в том числе микроорганизмов, во внутреннюю среду организма. Как механические, так и функциональные нарушения эпителиального покрова создают возможность для его колонизации патогенными и условно-патогенными микроорганизмами, их проникновения в подслизистую оболочку и развития патологического процесса. Особенно важную роль при этом играет поражение эпителия тонкого кишечника и дыхательной системы. Увеличение проницаемости стенок кишечника ведет к интоксикации и заражению организма и в тяжелых случаях может привести к сепсису. Снижение защитной функции эпителия дыхательных путей, которая в норме обеспечивается реснитчатым и слизистым эпителием и бактерицидностью стенок дыхательных путей, ведет к интенсификации респираторных инфекционных заболеваний и нередко оборачивается бронхопневмониями и пневмониями (в норме альвеолы легких абсолютно стерильны).
Снижение иммунитета при радиационных воздействиях происходит при дозах более 2 Гр, хотя кратковременные изменения обнаруживаются и при меньших доза. Ранние стадии иммунологической реакции, включающие процесс распознавания антигена, более радиочувствительны, чем поздние, включающие сам синтез антител.
Ряд факторов, имеющих различную природу, усиливает угнетающее действие друг друга на иммунную систему, наиболее яркий пример — появление в природе вируса иммунодефицита человека (ВИЧ) в сочетании с загрязнением окружающей среды диоксинами — химическими веществами преимущественно антропогенного происхождения. ВИЧ вызывает иммунодефицит при СПИДе, поражая главным образом Т-хелперы. При воздействии ТХДД также происходит уменьшение Т-хелперов, однако выраженность иммунного дефицита существенно меньше, чем при ВИЧ-инфекции. Однако ТХДД обладает способностью стимулировать репродукцию ВИЧ-1 в зараженном организме. При этом значительно повышается уровень экспрессии вирусных белков, в 3-6 раз возрастает активность обратной транскриптазы, в 4—6 раз — вирусопродукция (Покровский А. Г. и др., 1990). Это было показано на первично инфицированной культуре клеток МТ-4 (линии лимфоидных клеток человека, обладающих высокой чувствительностью к ВИЧ). Жизнеспособность клеток МТ-4 в этих условиях по сравнению с контрольными образцами (без ТХДД) не менялась, что свидетельствует, по мнению авторов, об отсутствии собственно цитотоксического эффекта использованных доз препарата.
Тяжелые последствия наблюдаются при комбинированных радиационно термических поражениях, т. е. при сочетании лучевых поражений с термическими ожогами, при которых наблюдаете значительное угнетение как специфического иммунитета, так и неспецифических факторов защиты:
деструкция лимфоидных органов;
резкое снижение числа функционала но активных Т- и В-лимфоцитов;
резкое снижение числа и активности макрофагов;
прогрессивное снижение уровня основных классов сывороточных иммуноглобулинов;
прогрессирующая недостаточность барьерных функций эпителиальных тканей;
поступление в общую циркуляцию микроорганизмов как из ожоговой раны, так и со слизистых оболочек дыхательных путей и желудочно-кишечного тракта.
Организм пострадавшего при комбинированном поражении становится практически беззащитным перед инфекцией и токсическими продуктами различной природы.
Следовательно, при экологических иммунодефицитах, вызываемых различными химическими и физическими факторами, поражаются прежде всего центральные органы иммунной системы (костный мозг и тимус), в которых наиболее интенсивно протекают процессы пролиферации и дифференцировки различных популяций Т- и В-лимфоцитов. При этом наиболее чувствительны к воздействию неблагоприятных факторов Т-супрессоры, затем В-лимфоциты, а при более продолжительном воздействии фактора происходит снижение количества и функциональной активности Т-хелперов с дальнейшей прогрессией нарушений иммунной системы.
Последовательные изменения в количестве и функциональной активности Т-супрессоров, В-лимфоцитов и Т-хелперов обусловливают стадийность изменений в иммунной системе при воздействии химических, физический и ряда биологических факторов на здоровый организм. Эта триада изменений является стереотипной реакцией иммунной системы на воздействие неблагоприятных факторов (Хаитов М. Р. и др., 1995).
Иммунодефициты, вызываемые лекарственными препаратами. Наиболее распространенными лекарственными препаратами, угнетающими иммунную систему и вследствие этого ослабляющими иммунные реакции, являются:
кортикостероидные гормоны (глюкокортикоиды);
антибиотики;
вещества, подавляющие пролиферативные процессы и биосинтез нуклеиновых кислот, в том числе большинство противоопухолевых средств.
Применение глюкокортикоидов оказывает прямое влияние на миграцию и функции клеток, участвующих в иммунном ответе, а также существенно воздействует на синтез цитокинов. При прямом действии глюкокортикоиды вызывают лимфо- и моноцитопению (снижение соответственно числа циркулирующих лимфоцитов и моноцитов); повышение количества циркулирующих нейтрофилов за счет поступления зрелых клеток из костного мозга и задержки их в циркуляции с одновременным быстрым и продолжительным падением числа циркулирующих эозинофилов и базофилов. Глюкокортикоиды ингибируют активацию и пролиферацию Т-лимфоцитов. Число Т-клеток падает больше, чем В-клеток, а среди Т-лимфоцитов субпопуляция клеток с СD+4-маркерами уменьшается больше, чем с CD8+. Т-клетки лишаются способности отвечать на ИЛ-1 синтезом ИЛ-2.
Кроме того, глюкокортикоиды ингибируют продукцию цитокинов ИЛ-1, ИЛ-2, ИЛ-6, ИЛ-10, ФНОα ИФγ (путем ингибирования транскрипции генов или ускорения расщепления мРНК). Основным следствием этих эффектов является угнетение активности Т-клеток (в равной степени Тх1 и Тх2) и клеток моноцитарно-макрофагальной системы, что ведет, в свою очередь, к угнетению функции В-лимфоцитов (на ранних стадиях созревания).
На зрелые В-лимфоциты глюкокортикоиды действуют слабо, однако при длительном введении высоких доз гормонов снижается содержание в крови антител всех классов. В то же время глюкокортикоиды в лечебных дозах не влияют на хемотоксическую, фагоцитарную и цитотоксическую активность полиморфно-ядерных лейкоцитов.
При использовании антибиотиков возможны побочные эффекты. В частности, применение антибиотиков может привести к исчезновению из организма животных чувствительных к ним сапрофитных микроорганизмов. Вместо них в организме начинают размножаться более устойчивые к антибиотикам условно-патогенные бактерии и грибы, которые в определенных условиях могут вызывать вторичные инфекции. Кроме того, некоторые антибиотики действуют непосредственно на клетки, участвующие в иммунном ответе, угнетая продукцию цитокинов и антител (актиномицины, пуромицин, стрептомицин, левомицетин, циклоспорин и др.). В частности, актиномицины угнетают транскрипцию мРНК, синтез антител, особенно при введении за 4—8 ч до инъекции антигена. Многие антибиотики, угнетающие пролиферацию лимфоидных клеток, обладают ингибирующим действием и на другие быстропролифирирующие ткани, в том числе на опухолевые, и используются в качестве противоопухолевых препаратов (актиномицин Д, андриамицин, блеомицин, рубомицин, метотрексат, циклорасфан, циторабин, проспидин, азатиоприн, циклоспарин и др.). Некоторые из них в настоящее время используются при лечении аутоиммунных заболеваний (метотрексат, циклофосфан, цитарабин, проспидин), другие — для подавления иммунного ответа при трансплантации органов и тканей (азатиоприн, циклоспорин).
Наиболее широкое распространение получил циклоспорин — антибиотик, выделенный из некоторых видов грибов, состоящий из 11 аминокислотных остатков. Циклоспорин избирательно изменяет функции лимфоцитов путем обратимого подавления образования и секреции лимфокинов (ИЛ-2 и фактора роста Т-клеток), а также их связывания со специфическими рецепторами, в результате чего происходит подавление пролиферации и дифференцировки Т-клеток, участвующих в отторжении трансплантанта.
Антиопухолевым и одновременно угнетаюшим иммунный ответ действием обладают антиметаболиты, конкурирующие с естественными метаболитами: 6-меркапторурин (аналог пуриновых оснований), 5-фторудацил и 5-бромуранил (аналоги пиримидиновых оснований), которые, включаясь в нуклеиновые кислоты вместо пуриновых и пиримидиновых оснований, инактивируют нуклеиновые кислоты. Антиметаболит мето-трексат — аналог фолиевой кислоты, включаясь вместо нее в состав ферментов, нарушает синтез пуриновых и пиримидиновых оснований.
Иммунодефицитные состояния у животных также вызывают некоторые алкалоиды [розевин (винбластин), конхамин, колхицин (угнетают лейко- и лимфопоэз)] и алкилирующие препараты (нитрозолметилмочевина, циклофосфан, хлорбутан, сарколизин), которые образуют ковалентные связи со структурами ДНК (пуринами, пиримидинами), блокируя ее функции.
Последствиями вторичных иммунодефицитов, возникающих под влиянием физических и химических факторов, могут быть:
генетические повреждения в органах и тканях;
наследственные мутации;
возникновение злокачественных опухолей;
развитие аутоиммунной патологии;
развитие инфекционных заболеваний.
Одним их распространенных и опасных осложнений, возникающих в организме при наличии иммунодефицитных состояний, является сепсис, при котором в условиях нарушения реактивности организма происходит постоянное или периодическое проникновение в кровяное русло различных микроорганизмов и их токсинов из местного очага инфекции.
Возбудителями сепсиса могут быть различные микроорганизмы, однако доминирующими из них являются стрептококки, стафилококки, пневмококки, менингококки, синегнойная и кишечная палочки, клебсиелла, протей, неспорообразующие аэробы и др. (Шевченко Ю.Л., Шихвердиев Н. Н., 2000).
Развитию сепсиса способствуют механические и термические повреждения тканей, в том числе оперативные вмешательства, усиливающие иммуносупрессию, а также бактериальная загрязненность с инфицированием поврежденных тканей вирулентными микроорганизмами.
При достаточной выраженности иммунодефицитного состояния и нарушений барьерных свойств покровных тканей микроорганизмы могут получить практически полную свободу роста и размножения.
При массивных нагноениях мягких тканей, в том числе миндалин, возбудитель поступает непосредственно в кровоток, и поэтому вследствие блокирования рецепторов иммунокомпетситмых клеток и связывания циркулирующих антител сепсис развивается быстро и при наличии патогенных бактерий может завершиться летально.
Развитие сепсиса возможно и за счет возбудителей, являющихся представителями условно-патогенной микрофлоры, которые обитают на кожных покровах и слизистых оболочках (сапрофитные штаммы стафилококка, различные типы стрептококка, кишечная флора и пр.) и приобретают в условиях иммунодефицита и дефектов эпителиальных барьеров возможность беспрепятственного проникновения во внутреннюю среду организма, размножения и диссеминации в нем.
Септический процесс характеризуется быстрым развитием, размножением микроорганизмов высокими темпами, опережающими специфический иммунный ответ. В эффекторные процессы борьбы с инфекцией вовлекаются преимущественно В-система иммунитета и факторы неспецифической защиты. В начальный период развития сепсиса возможна повышенная продукция как антител класса IgM, так и более высокоспецифичных антител класса IgG. При неблагоприятном течении септического процесса в организме наступают угнетение регуляторных и биосинтетических механизмов антителогенеза, существенное снижение синтеза IgM и FgG, ослабление фагоцитоза в очагах воспаления («септический иммунодефицит»). В периферической крови возможны лимфопения нейтрофильный лейкоцитоз, повышение уровня циркулирующих иммунных комплексов и их тропности к почечной ткани, эндокарду, эндотелию сосудов.
Следовательно, отличительной чертой сепсиса как патологии является неспособность организма вследствие декомпенсации иммунной системы к отграничению инфекционного очага и сдерживанию размножения циркулирующих в крови микроорганизмов, что ведет к тяжелой микробной интоксикации, повсеместному возникновению метастатических гнойных очагов и в наиболее тяжелых случаях — к фатальному исходу
|
|
|
|
|
Дата добавления: 2015-07-13; Просмотров: 11660; Нарушение авторских прав?; Мы поможем в написании вашей работы!