
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
По признаку участия катализаторов
|
|
|
|
По наличию границы раздела фаз
· гомогенная протекает в пределах одной фазы 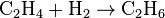
· гетерогенная, протекающая на границе раздела CuO + 2HCl = CuCl2 + H2O
· каталитические протекают в присутствии катализаторов.В уравнениях таких реакций химическую формулу катализатора указывают над знаком равенства, иногда вместе с обозначением условий протекания(температура t, давление p).К реакциям данного типа относятся многие реакции разложения и соединения.
· Некаталитические протекают в отсутствие катализаторов. Это реакции обмена и замещения.
Химическое равновесие
Состояние химической системы, в которой протекает одна или несколько химических реакций, причём скорости в каждой паре прямой-обратной реакции равны между собой. Для системы, находящейся в химическом равновесии, концентрации реагентов, температура и другие параметры системы не изменяются со временем.
А2 + В2 ⇄ 2AB
Смещение химического равновесия
Принцип работы: если на систему воздействовать, то она противодействует!
Положение химического равновесия зависит от следующих параметров реакции: температуры, давления и концентрации. Влияние, которое оказывают эти факторы на химическую реакцию, подчиняется закономерности, которая была высказана в общем виде в 1885 году французским учёным Ле Шателье «Если изменить одно из условий, при котором система находится в состоянии равновесия – концентрацию, давление или температуру, — то равновесие сместится в направлении той реакции, которая противодействует этому изменению».
Принцип Ле Шателье — если на систему, находящуюся в равновесии, воздействовать извне, изменяя какое-либо из условий равновесия (температура, давление, концентрация), то в системе усиливаются процессы, направленные на компенсацию внешнего воздействия.
Факторы, влияющие на химическое равновесие:
1) температура
При увеличении температуры химическое равновесие смещается в сторону эндотермической (поглощение) реакции, а при понижении - в сторону экзотермической (выделение) реакции.
При повышении температуры (внешнее воздействие) система будет стремиться понизить температуру, значит усиливается процесс поглощающий тепло. равновесие сместится в сторону эндотермической реакции, т.е. в сторону реагентов.
CaCO3=CaO+CO2 -Q t↑ →, t↓ ← эндотермическая
N2+3H2↔2NH3 +Q t↑ ←, t↓ → экзотермическая
2) давление
Понижение давление (внешнее воздействие) приведет к усилению процессов увеличивающих давление, значит равновесие сместится в сторону большего количества газообразных частиц (которые и создают давление).
При повышении температуры (внешнее воздействие) система будет стремиться понизить температуру, значит усиливается процесс поглощающий тепло. равновесие сместится в сторону эндотермической реакции, т.е. в сторону реагентов.
При увеличении давления химическое равновесие смещается в сторону меньшего объёма веществ, а при понижении - в сторону большего объёма. Этот принцип действует только на газы, т.е. если в реакции участвуют твёрдые вещества, то они в расчёт не берутся.
N2+3H2↔2NH3
|
|
|
|
|
Дата добавления: 2015-08-31; Просмотров: 313; Нарушение авторских прав?; Мы поможем в написании вашей работы!