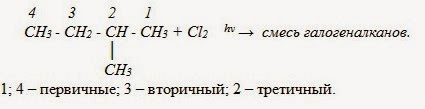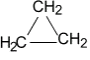КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Пример1
В какой системе при повышении давления химическое равновесие сместится в сторону исходных веществ?
1) 
2) 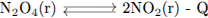
3) 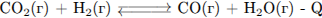
4) 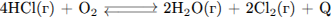
Пояснение.
Повышением или понижением давления можно сместить равновесие только в процессах, в которых участвуют газообразные вещества, и которые идут с изменением объемов.
Для смещения равновесия в сторону исходных веществ при повышении давления необходимо условия, чтобы процесс протекал с увеличением объёма.
Это процесс 2. (Исходные вещества 1 объёмов, продукты реакции - 2)
3) концентрация исходных веществ и продуктов реакции
При увеличении концентрации одного из исходных веществ химическое равновесие смещается в сторону продуктов реакции, а при понижении концентрации - в сторону исходных веществ.
S+O2=SO2 [S],[O]↑ →, [SO2]↑ ←
Катализаторы не влияют на смещение химического равновесия
«Электролиз растворов и расплавов солей»
Электролиз — физико-химический процесс, состоящий в выделении на электродах составных частей растворённых веществ или других веществ, который возникает при прохождении электрического тока через раствор либо расплав электролита.
Электроды — это такие пластинки или стержни, опущенные в раствор, они подключены к источнику тока.
· Анод — положительно заряженный электрод
· Катод — отрицательно заряженный электрод
Мы будем рассматривать случай инертных электродов — т.е. они не будут вступать ни в какие химические реакции.
При пропускании электрического тока, вещество раствора будет претерпевать химические изменения, т.е. буду образовываться новые химические вещества. Они будут притягиваться к электродам следующим образом:
· Неметаллы и их производны, анионы — к аноду
· Металлы и их производный, катионы — к катоду
Теперь рассмотрим электролиз водных растворов различных солей
Для этого нам понадобится ряд активности металлов \ электрохимический ряд напряжений:

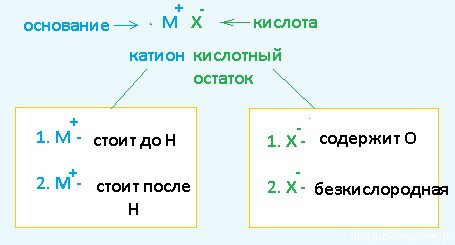
Разберем сначала катионы:
· Если металл стоит до Н, то вместо него электролизу подвергается вода:
2H2O + 2 е = H2 + 2OH– Образовавшийся водород H2 идет к катоду
· Если металл стоит после Н, то он сам восстанавливается:
Cu2+ + 2 е = Cu 0 Медь осаждается на катоде
· Катионы металлов, стоящие в ряду напряжений после алюминия до водорода, могут восстанавливаться вместе с молекулами воды:
2Н2О + 2е = Н2 + 2ОН — Zn2+ + 2e = Zn0

Теперь анионы-кислотные остатки:
· Кислородсодержащие кислотные остатки — вместо них электролизу подвергается вода:
2H2O — 4e = O2 + 4H+ Образовавшийся O2 выделяется на аноде
· Бескислородные кислотные остатки — окисляются до простого вещества:
Cl− — 1e = Cl2 0 Хлор выделяется на аноде
· Исключение: F− — вместо него будет выделяться кислород.
· при окислении анионов органических кислот происходит процесс:
2R–COO- → R–R + 2CO2↑
Рассмотрим процесс электролиза раствора ацетата натрия. СН3СООNa – соль, которая образована активным металлом и кислотным остатком карбоновой кислоты. При электролизе получается водород, щелочь. Уравнение диссоциации: СН3СООNa → СН3СОО - + Na+ К (-) 2Н2О + 2е- = Н2 0 ↑ + 2ОН- А (+) 2CH3COO¯ − 2e = C2H6 + 2CO2↑ Суммарное уравнение: 2Н2О + 2CH3COO¯ = Н2 0 ↑ + 2ОН - + C2H6 + 2CO2↑ 2Н2О + 2CH3COONa = 2NaОH + Н2 0 ↑ + C2H6↑ + 2CO2↑.
Примеры:
1.1.Катион стоит в ряду до Н, кислотный остаток содержит кислород О:
K2SO4↔2K++SO42−
K(-): 2H2O + 2e = H2 + 2OH−
A(+): 2H2O — 4e = O2 + 4H+
2H2O (электролиз) → 2H2 + O2
1.2. Катион стоит в ряду до Н, кислотный остаток беcкислородный:
LiCl ↔ Li+ + Cl−
катод (-): 2H2O + 2e = H2 + 2OH−
анод (+): Cl− — 1e = Cl0; Cl0+Cl0=Cl2
2LiCl + 2H2O(электролиз) → H2 + Cl2 +2LiOH
2. Катион стоит в ряду между алюминием и водородом, кислотный остаток содержит кислород О: Ni(NO3)2 - соль, которая образована металлом, стоящим в ряду напряжений от Mn до H2 и кислородсодержащим кислотным остатком. В процессе получаем металл, водород, кислород и кислоту. Уравнение диссоциации: Ni(NO3)2 → Ni2+ + 2NO3
- К (-)Ni2+ +2e - = Ni0 2Н2О + 2е- = Н2 0 ↑ + 2ОН- A (+) 2H2O – 4e - = O2 0 ↑ + 4H +
Cуммарное уравнение: Ni2+ + 2Н2О + 2H2O = Ni0 + Н2 0 ↑ + 2ОН- + O2 0 ↑ + 4H + Ni(NO3)2 + 2Н2О = Ni0 +2HNO3 + Н2 0 ↑ + O2 0 ↑
3.1. Катион стоит в ряду после Н, кислотный остаток содержит кислород О:
СuSO4 ↔ Cu2++SO42−
K(-): Cu2+ + 2e = Cu0
A(+): 2H2O — 4e = O2 + 4Н+
2CuSO4 + 2H2O(электролиз) → 2Cu + 2H2SO4 + O2
3.2. Катион стоит в ряду после Н, кислотный остаток беcкислородный:
катод (-): Cu2+ + 2e = Cu0
анод (+): 2Cl− — 2e = 2Cl0
CuCl2 (электролиз) →Cu + Cl2

Электролиз водных растворов солей отличается от электролиза расплавов.
Отличие — в наличии растворителя. При электролизе водных растворов солей кроме ионов самого вещества в процессе участвуют ионы растворителя. При электролизе расплавов — только ионы самого вещества.
Алканы СnH2n+2 Sp3-гибридизация
В обычных условиях С1- С4 – газы С5- С15 – жидкие С16 – твёрдые
Температуры плавления и кипения алканов, их плотности увеличиваются в гомологическом ряду с ростом молекулярной массы. Все алканы легче воды, в ней не растворимы, однако растворимы в неполярных растворителях (например, в бензоле) и сами являются хорошими растворителями.
Изомерия Структурная — изомерия углеродного скелета Химические свойства алканов 1. Реакции замещения. а) Галогенирование при действии света - hν или нагревании (стадийно – замещение атомов водорода на галоген носит последовательный цепной характер. Реакция Н. Н. Семёнова) В реакции образуются вещества галогеналканы Сn H2n+1Г (Г - это галогены F, Cl, Br, CH4 + Cl2 hν → CH3Cl + HCl (1 стадия); хлорметан CH3Cl + Cl2 hν → CH2Cl2 + HCl (2 стадия); дихлорметан СH2Cl2 + Cl2 hν → CHCl3 + HCl (3 стадия); трихлорметан CHCl3 + Cl2 hν → CCl4 + HCl (4 стадия). тетрахлорметан
Электронная плотность связи С – Cl смещена к более электроотрицательному хлору, в результате на углерода ближайщего к заместителю: CH3 – CH2 – Cl + Cl2 hν → CH3 – CHCl2 + HCl хлорэтан 1,1 -дихлорэтан. Внимание! В реакциях замещения алканов легче всего замещаются атомы водорода у третичных атомов углерода, затем у вторичных и, в последнюю очередь, у первичных.
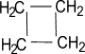
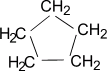
б) Нитрование (реакция М.И. Коновалова, он провёл её впервые в 1888 г) CH4 + HNO3(раствор) t˚С → CH3NO2 + H2O нитрометан RNO2 или Сn H2n+1 NO2 (нитроалкан) 2. Реакции отщепления (дегидрирование) а) CnH2n+2 t˚С, Ni или Pd → CnH2n + H2 б) При нагревании до 1500 С происходит образование ацетилена и водорода: 2CH4 1500°С → C2H2 + 3H2 3. Реакции перегруппировки (изомеризация) н-алкан AlCl3, t°С → изоалкан 4. Реакции горения (горят светлым не коптящим пламенем) CnH2n+2 + O2 t°С → nCO2 + (n+1)H2O Помните! Смесь метана с воздухом и кислородом взрывоопасна 5. Реакции разложения а) Крекинг при температуре 700-1000°С разрываются (-С-С-) связи: C10H22 t°С → C5H12 + C5H10 б) Пиролиз при температуре 1000°С разрываются все связи, СH4 1000°С → C + 2H2 в) Конверсия метана с образованием синтез – газа (СО + Н2) CH4 + H2O 800˚C, Ni → СО + 3Н2 Циклоалканы СnH2n Sp3-гибридизация
|
|
|
Дата добавления: 2015-08-31; Просмотров: 648; Нарушение авторских прав?; Мы поможем в написании вашей работы!