
- Р Р‡.МессенРТвЂВВВВВВВВжер
- ВКонтакте
- РћРТвЂВВВВВВВВнокласснРСвЂВВВВВВВВРєРСвЂВВВВВВВВ
- РњРѕР№ Р В Р’В Р РЋРЎв„ўР В Р’В Р РЋРІР‚ВВВВВВВВРЎР‚
- LiveJournal
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Реакции разложения нитратов при нагревании
|
|
|
|
Специфические свойства азотной кислоты
Химические свойства
Получение
1. Лабораторный способ KNO3 + H2SO4(конц) –= KHSO4 + HNO3
2. Промышленный способ. Осуществляется в три этапа:
a) Окисление аммиака на платиновом катализаторе до NO
4NH3 + 5O2 = 4NO + 6H2O
b) Окисление кислородом воздуха NO до NO2 2NO + O2 = 2NO2
c) Поглощение NO2 водой в присутствии избытка кислорода
4NO2 + О2 + 2H2O =4HNO3
Очень сильная кислота. Реагирует:
· с основными оксидами CuO + 2HNO3 ® Cu(NO3)2 + H2O
· с основаниями HNO3 + NaOH ® NaNO3 + H2O
вытесняет слабые кислоты из их солей 2HNO3 + Na2CO3 ® 2NaNO3 + H2O + CO2
Сильный окислитель
1. Разлагается на свету и при нагревании 4HNO3 = 2H2O + 4NO2 + O2
2. Окрашивает белки в оранжево-желтый цвет ("ксантопротеиновая реакция")
3. При взаимодействии с металлами никогда не выделяется водород
металл + HNO3 ® соль азотной кислоты + вода + газ
| HNO3 | |||||||
| / | \ | ||||||
| концентрированная | разбавленная | ||||||
| ¯ | ¯ | ¯ | ¯ | ¯ | |||
| Fe, Al, Cr, Au, Pt пассивирует (без нагревания) | с тяжелыми металлами NO2 | со щелочными и щел.зем. металлами N2O | с тяжелыми металлами NO | со щелочными и щел.зем. металлами, а также Sn и Fe NH3 (NH4NO3) | |||
4. С неметаллами. Азотная кислота превращается в NO (или в NO2); неметаллы окисляются до соответствующих кислот:
S0 + 6HNO3(конц) =H2SO4 + 6NO2 + 2H2O 3P0 + 5HNO3 + 2H2O =5NO + 3H3PO4
1) Нитраты щелочных металлов разлагаются до нитритов: 2NaNO3 –t°® 2NaNO2 + O2
2) Нитраты менее активных металлов (от щелочноземельных до меди) разлагаются до оксидов: 2Mg(NO3)2 –t°® 2MgO + 4NO2 + O2 2Cu(NO3)2 –t°® 2CuO + 4NO2 + O2
3) Нитраты наименее активных металлов разлагаются до металлов:
Hg(NO3)2 –t°® Hg + 2NO2 + O2 2AgNO3 –t°® 2Ag + 2NO2 + O2
| 4) Нитрат аммония разлагаются до N2O NH4NO3 –t°® N2O + 2H2O | |||||||||
Фосфор.
Р +15)2)8)5 1S22S22P63S23P3, фосфор: p– элемент, неметалл
АЛЛОТРОПИЯ ФОСФОРА
В свободном состоянии фосфор образует несколько аллотропных видоизменений:белый (мол.кр.реш), красный и чёрный фосфор (атомная решетка)
Красный фосфор практически нетоксичен. Белый фосфор очень ядовит,
ПОЛУЧЕНИЕ ФОСФОРА
Ca3(PO4)2 + 5C + 3SiO2 →2 P + 5CO + CaSiO3.
Фосфорную кислоту получают из фосфата кальция:
Или взаимодействием с водой оксида фосфора(V), H3PO4 — трёхосновная кислота средней силы. Качественная реакция с нитратом серебра — образуется жёлтый осадок:
Фосфаты Соли фосфорной кислоты называются фосфатами. Фосфорная кислота образует одно-, двух- и трехзамещенные соли.
Дигидрофосфаты (однозамещенные фосфаты) имеют кислую реакцию, гидрофосфаты (двузамещенные фосфаты) — слабощелочную, средние (трехзамещенные фосфаты, или просто фосфаты) — щелочную. Дигидрофосфаты обычно хорошо растворимы в воде, почти все гидрофосфаты и фосфаты растворимы мало. Фосфаты при прокаливании не разлагаются, исключение составляет фосфат аммония (NH4)3PO4. |
Углерод и его свойства
Углерод образует множество аллотропных модификаций: алмаз – одно из самых твердых веществ, графит, уголь, сажа.
I. Строение атома Углерод – элемент IV группы
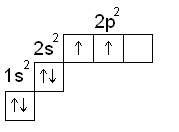
В нормальном состоянии атом углерода имеет степень окисления +2.
В данной степени окисления углерод образует оксид – СО
2. Возбужденное состояние атома углерода
В возбужденном состоянии атом углерода имеет степень окисления +4.
В данной степени окисления углерод образует оксид – СО2
ХИМИЧЕСКИЕ СВОЙСТВА УГЛЕРОДА
Углерод - малоактивен, на холоде реагирует только со фтором; химическая активность проявляется при высоких температурах.
| С – восстановительС – 4 е-→ С+4 | С – окислительС + 4 е-→ С-4 |
| 1) с кислородом C + O2 t˚C → CO2 углекислый газ 2C0 + O2 t˚C → 2CO2 2) со фтором С + 2F2 → CF4 3) с водяным паром C0 + H2O t˚ → СO2 + H2 водяной газ 4) с оксидами металлов C + 2CuO t˚C → 2Cu + CO2 5) с кислотами – окислителями: C + 2H2SO4(конц.) → СO2 + 2SO2 + 2H2O С + 4HNO3(конц.) → СO2 + 4NO2 + 2H2O 6) С СОЛЯМИ BaSO4+4C=BaS+4CO | 1) с некоторыми металлами образует карбиды 4Al + 3C t˚C → Al4C3 Ca + 2C t˚C → CaC2 2) с водородом C + 2H2 t˚C → CH4 |
Адсорбция - поглощение газообразных или растворённых веществ поверхностью твёрдого вещества
II. СОЕДИНЕНИЯ УГЛЕРОДА 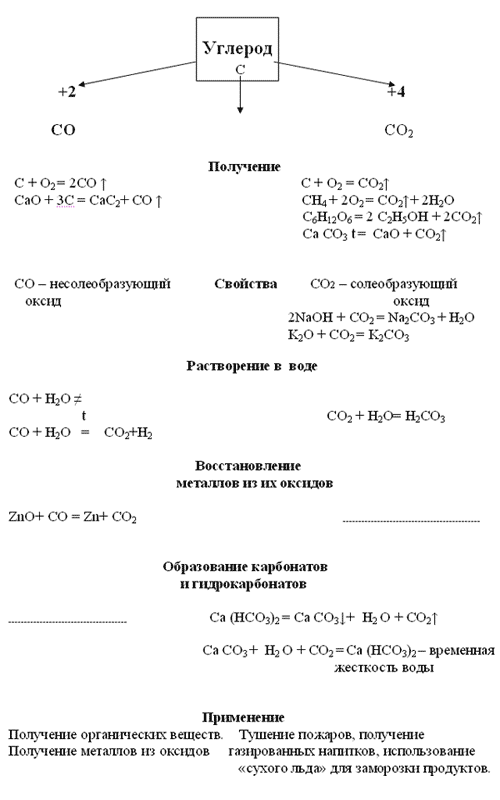
|
|
|
Дата добавления: 2015-08-31; Просмотров: 1505; Нарушение авторских прав?; Мы поможем в написании вашей работы!
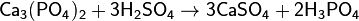
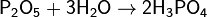
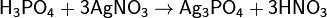
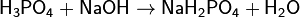 (дигидрофосфат натрия)
(дигидрофосфат натрия)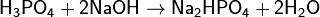 (гидрофосфат натрия)
(гидрофосфат натрия)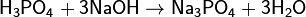 (фосфат натрия)
(фосфат натрия)