
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химические свойства. Производство серной кислоты
Производство серной кислоты
1-я стадия. Печь для обжига колчедана.
4FeS2 + 11O2 ® 2Fe2O3 + 8SO2 + Q
Процесс гетерогенный:
1) измельчение железного колчедана (пирита)
2) метод "кипящего слоя"
3) 800С; отвод лишнего тепла
4) увеличение концентрации кислорода в воздухе
2-я стадия. После очистки, осушки и теплообмена сернистый газ поступает в контактный аппарат, где окисляется в серный ангидрид (450С – 500С; катализаторV2O5):
a) разбавленная серная кислота растворяет только металлы, стоящие в ряду напряжений левее водорода:Zn + H2SO4(разб) ® ZnSO4 + H2O
b) концентрированная H2SO4 – сильный окислитель; при взаимодействии с металлами (кроме Au, Pt) может восстанавливаться до SO2, S или H2S (без нагревания не реагируют также Fe, Al, Cr - пассивируются):
2Ag + 2H2SO4 ® Ag2SO4 + SO2 + 2H2O
8Na + 5H2SO4 ® 4Na2SO4 + H2S + 4H2O
2) концентрированная H2SO4 реагирует при нагревании с некоторыми неметаллами за счет своих сильных окислительных свойств, превращаясь в соединения 2SO2 + O2 «2SO3
Химические свойства H2SO4 - сильная двухосновная кислота
H2SO4 «H+ + HSO4- «2H+ + SO42-
1) Взаимодействие с металлами:
серы более низкой степени окисления, (например, S+4O2):
С + 2H2SO4(конц) ® CO2 + 2SO2 + 2H2O
S + 2H2SO4(конц) ® 3SO2 + 2H2O
2P+ 5H2SO4(конц) ® 5SO2 + 2H3PO4 + 2H2O
3) с основными оксидами:CuO + H2SO4 ® CuSO4 + H2O
4) с гидроксидами:H2SO4 + 2NaOH ® Na2SO4 + 2H2O
| 5) обменные реакции с солями:BaCl2 + H2SO4 ® BaSO4¯ + 2HCl |
АЗОТ (5 ГРУППА)
Основной компонент воздуха (78% по объему).Газ, без цвета, запаха и вкуса; плохо растворим в воде.
Получение
1. Промышленный способ. Перегонка жидкого воздуха.
2. Лабораторный способ. Разложение нитрита аммония:
NH4NO2 –t= N2 + 2H2O
Молекула азота (:NN:) В молекуле имеются тройная связь: одна - и две - связи.
Очень устойчива, поэтому обладает низкой реакционной способностью.
Реагирует при высокой температуре (электрическая дуга, 3000°С) N2 + O2 «2NO(в природе - во время грозы)
1. c водородом (500°С, kat, p) N2 + 3H2 «2NHЗ
2. с активными металлами (с щелочными и щел.зем. металлами)
6Li + N2 ® 2LiЗN 3Mg + N2 –t°® MgЗN2
АММИАК NH3
Молекула полярная, имеет форму треугольной пирамиды с атомом азота в вершине
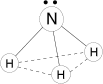
NH3 - бесцветный газ, запах резкий, удушливый, ядовит, легче воздуха. Хорошо растворим в воде.
Молекулы аммиака связаны слабыми водородными связями

|
|
Дата добавления: 2015-08-31; Просмотров: 334; Нарушение авторских прав?; Мы поможем в написании вашей работы!