
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Статистическая обработка
|
|
|
|
Определение содержания гидроксикоричных кислот
Определение содержания растворимых фенольных соединений
Схема опыта
Объект исследования
Объектом исследования служили проростки тритикале сорта «Динаро», районированного в Республике Беларусь. Это пшенично-ржаной гибрид, полученный путем объединения хромосомных комплексов двух разных родов – пшеницы (Triticum) и ржи (Secale).
Систематическое положение:
| Царство: | Растения Plantae |
| Отдел: | Покрытосеменные Magnoliophyta |
| Класс: | Однодольные Monocotyledone s |
| Порядок: | Злакоцветные Poales |
| Семейство: | Злаки Poaceae |
| Подсемейство: | Мятликовые Pooideae |
| Род: | Тритикале Triticale |
К преимуществам, свойственным тритикале, относятся: 1) урожайность – при соблюдении технологии возделывания тритикале обеспечивает высокую урожайность: 6-8 т зерна с 1 га; 2) питательная ценность – повышенное содержание белка (на 1-1,5% выше, чем у пшеницы, и на 3-4%, чем у ржи) незаменимыми аминокислотами (лизин, триптофан). Содержание клейковины на 3-4% больше, чем у пшеницы, но качество – ниже; 3) устойчивость к неблагоприятным почвенно-климатическим условиям; 4) устойчивость к наиболее опасным болезням – тритикале практически не поражается мучнистой росой, твёрдой и пыльной головнёй, бурой ржавчиной; 5) приспособляемость к различным типам почв – растет на всех почвах, в том числе на кислых и переувлажнённых.
К недостаткам, свойственным тритикале, относят: 1) большое варьирование по годам урожайности; 2) склонность к полеганию и прорастанию зерна на корню; 3) слабая выполненность зерна у некоторых форм тритикале; 4) позднеспелость; 5) сильное поражение снежной плесенью и корневыми гнилями.
Тритикале используют в кормовых целях при производстве комбикормов, зерно тритикале может быть основой при производстве спирта (его выход из зерна тритикале на 3-5% больше, чем из пшеницы и других зерновых).
Большие перспективы в применении муки из тритикале в качестве основного компонента сырья в кондитерском производстве (печенье, бисквиты, рулеты, кексы, крекеры и др.). Особое место тритикале занимает при изготовлении диетического хлеба для лиц, страдающих нарушением обмена веществ. Следовательно, тритикале – это перспективная культура, которая широко выращивается на территории РБ и используется в различных областях промышленности.
Семена тритикале замачивали в чашках Петри в воде в течение 24 часов. На вторые сутки высаживали проклюнувшиеся семена в рулоны и выращивали в течение 10 суток на водопроводной воде в комнатных условиях. На 11 сутки часть проростков обрабатывались элиситорами путем опрыскивания надземной части листьев следующими композициями: водный раствор синтетического пептида GmPep890 в концентрации 10-12 М, пептид + янтарная кислота в концентрации 10-6 М, пептид+ глутаминовая кислота в концентрации 10-7 М (контроль – без обработки). Через 24 часа часть проростков подвергали воздействию оксидативного стресса, для этого в наружный раствор добавляли 10-3М СuCl2, 10-3 М Н2О2, 10-3 М АК, вызывая образование гидроксильных радикалов. Время воздействия стрессового фактора составляло 48 часов. На 15 сутки измеряли морфометрические параметры проростков, а именно сырую массу надземной части и корней.
Кроме того определяли влияние элиситоров на суммарное содержание растворимых фенольных соединений и ГКК в листьях проростков, подвергнутых действию оксидативного стресса. Для этого на 6 сутки проростки обрабатывали элиситорами (как описано выше). Через 24 часа часть проростков подвергали воздействию оксидативного стресса, после чего измеряли уровень ФС и ГКК в листьях 8-дневных проростков. Время воздействия стрессового фактора составляло 48 часов.
Для экстракции взвешивали по 200 мг механически измельченного сырья (листья). Помещали навеску в фарфоровую ступку, добавляли на кончике скальпеля мел для нейтрализации кислотности вакуолярного сока и столько же кварцевого песка в качестве абразива, приливали 2 мл спирта и тщательно растерли. Затем к смеси добавили 8 мл 70% этилового спирта. После чего содержимое ступки профильтровали через фильтр Шотта.
В градуированную пробирку объемом 10 мл приливали 0,5 мл полученного экстракта, 8 мл дистиллированной воды и 0,5 мл реактива Фолина-Дениса, через 2 мин добавили 1 мл 10% раствора углекислого натрия. Полученную смесь оставляли на 40 мин до появления окраски. Затем измеряли оптическую плотность с помощью спектрофотометра Cary Vin (Германия) при длине волны 720 нм. В качестве контрольного раствора использовали спирт. Расчет содержания фенольных соединений произвели с использованием калибровочного коэффициента (а=0,0058) по формуле:
С= (Р× V1)÷(а× V2× В), где
С-содержание фенольных соединений (мкг/г);
Р - оптическая плотность раствора;
а - калибровочного коэффициента (0,0058);
V1-объем экстракта (мл);
V2-общий объем пробы (мл);
В-навеска биологического материала для анализа (г).
Для определения содержания гидроксикоричных кислот использовали спиртовой экстракт из листьев тритикале, способ его получения описан выше.
В градуированную пробирку объемом 10 мл приливали 0,5 мл экстракта и 4,5 мл дистиллированной воды. Затем измеряли оптическую плотность с помощью спектрофотометра Cary Vin (Германия) при длине волны 330 нм.
Содержание гидроксикоричных кислот (в мг/мл) рассчитывали по уравнению калибровочной кривой, построенной для кофейной кислоты (рисунок 2.1).
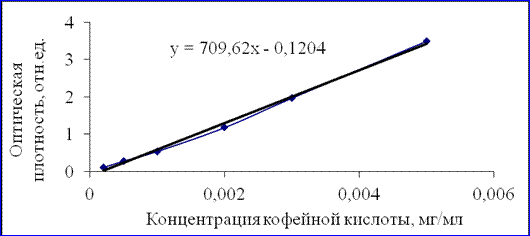
Рисунок 2.1 – Зависимость оптической плотности от концентрации кофейной кислоты.
Пересчет на единицу сырого веса листьев (в мг/г) производили следующим образом: С=С мг/мл× 1000÷0,2, где С – содержание ГКК (мг/г).
Статистическая обработка результатов опыта позволяет определить границы случайных колебаний полученных данных, то есть установить точность опыта, а также достоверность различий по средним значениям между вариантами опыта.
Представленные экспериментальные данные проводились в 3-кратной биологической повторности. Для обработки полученных результатов были использованы стандартные методы вариационной статистики. Основными статистическими характеристиками служили средняя арифметическая величина (х¯), среднее квадратное отклонение (δ) и ошибка средней величины (Sх).
Средняя арифметическая величина определяется по формуле:
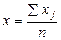
где ∑xj – сумма всех повторностей измерения,
n – число повторностей.
Для определения среднего квадратичного отклонения использовалось выражение:
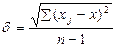
где ∑(xj-x)² - сумма квадратов отклонений от средней арифметической величины.
Ошибка средней величины определяется по формуле:
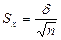
Данные величины рассчитывали с помощью пакета статистического анализа данных программы Microsoft Excel.
Глава 3. Результаты и их обсуждение
На начальном этапе исследований было изучено влияние синтетического пептида GmPep890 10-12 М, ГК 10-7 М, ЯК 10-6 М на морфометрические показатели проростков тритикале. Как видно из полученных результатов, применение данных веществ, приводило к снижению морфометрических параметров проростков тритикале (рис. 3.1, рис. 3.2). При предобработке проростков пептидом сырая масса надземной части проростков снижалась на 33 % по сравнению с контролем, а масса корней на 27 %. Ингибирующее действие пептида может быть обусловлено запуском сигнальных систем и торможением ростовых процессов проростков. Ингибирующее действие ГК и ЯК проявлялось в меньшей степени. Опрыскивание проростков этими кислотами вызывало уменьшение надземной части проростков на 11 % по сравнению с контролем и не влияло на рост корневой системы.
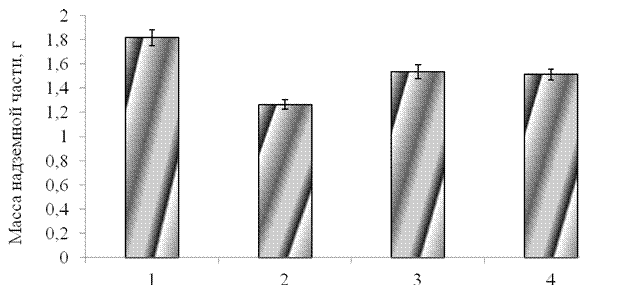
1 – контроль, 2 – синтетический пептид GmPep890 10-12 М,
3 – ГК 10-7 М, 4 – ЯК 10-6 М.
Рисунок 3.1 – Влияние синтетического пептида, ГК и ЯК на массу надземной части проростков тритикале.

1 –контроль, 2 -синтетический пептид GmPep890 10-12 М, 3 - ГК 10-7 М, 4 – ЯК 10-6 М.
Рисунок 3.2 – Влияние синтетического пептида, ГК и ЯК на массу корней проростков тритикале.
Согласно литературным данным, олигопептиды, а также исследованные нами органические кислоты могут обладать элиситорным действием, а, следовательно, влиять на синтез защитных соединений фенольной природы. Поэтому на следующем этапе нами было изучено влияние данных соединений на накопление растворимых фенольных соединений и ГКК.
Как видно из полученных результатов, применение всех исследованных элиситоров не оказывало существенного влияния на суммарное содержание растворимых фенольных соединений (рис.3.3), однако приводило к увеличению уровня ГКК в листьях тритикале на 29 % по сравнению с контролем (рис. 3.4).
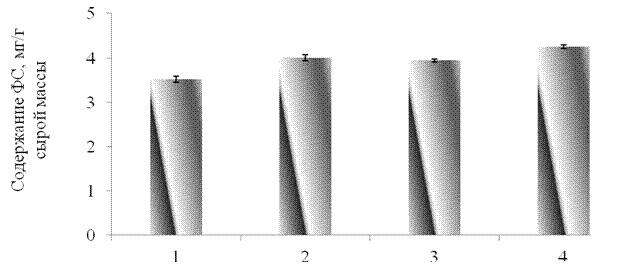
1 –контроль, 2 -синтетический пептид GmPep890 10-12 М, 3 - ГК 10-7 М, 4 – ЯК 10-6 М.
Рисунок 3.3 – Влияние синтетического пептида, ГК и ЯК на содержание фенольных соединений в проростков тритикале.

1 –контроль, 2 -синтетический пептид GmPep890 10-12 М, 3 - ГК 10-7 М, 4 – ЯК 10-6 М.
Рисунок 3.4 – Влияние синтетического пептида, ГК и ЯК на содержание ГКК в проростков тритикале.
Анализируя полученные данные, можно заключить, что применение исследованных элиситоров приводит к незначительному ингибированию морфометрических показателей проростков тритикале и модификации биосинтеза вторичных метаболитов фенольной природы. Хотя под действием исследованных соединений суммарное содержание фенолов не претерпевает существенных изменений, но наблюдается увеличение количества гидроксикоричных кислот, играющих важную роль в защите растений от фитопатогенов. Представленные результаты позволяют предположить, что пептидный элиситор GmPep890, а также глутаминовая и янтарная кислоты обладают элиситорными свойствами и могут влиять на устойчивость растений к действию стрессовых факторов. Поэтому на следующем этапе нами было изучено влияние синтетического пептида GmPep890, ГК и ЯК, а также их сочетанное действие на морфометрические характеристики 2-недельных проростков тритикале, подвергнутых оксидативному стрессу. Оксидативный стресс моделировали путем добавления в наружный раствор 10-3 М CuCl2, 10-3 М Н2О2 и 10-3 М аскорбиновой кислоты. Медь легко меняет свой окислительно-восстановительный статус, она взаимодействует с аскорбиновой кислотой, переходя в восстановленное состояние, а затем взаимодействует с перекисью водорода, приводя к образованию гидроксильных радикалов. Следовательно, присутствие в наружном растворе данных соединений приводит к развитию окислительного стресса в растениях.
Как видно из полученных результатов, оксидативный стресс приводил к снижению массы надземной части проростков на 24 % по сравнению с контролем (рис. 3.5). Еще в большей степени происходило ингибирование роста корневой системы. Согласно полученным результатам, при стрессовом воздействии масса корней проростков снижалась на 39 % по сравнению с контролем (рис. 3.6). Столь сильный ингибирующий эффект стрессора на морфометрические характеристики проростков, обусловлен активацией окислительных процессов в растениях, вызванных присутствием АФК. Согласно литературным данным, снижение морфометрических характеристик проростков может быть обусловлено активным протеканием в наружном растворе реакции Фентона, при которой образуется гидроксильный радикал, являющийся самым мощным известным окислителем [11].
Как показывают полученные данные, при предварительной обработке (за 24 ч. до действия стресса) проростков синтетическим пептидом GmPep890 не наблюдалось выраженного защитного эффекта как на массу надземной части, так и массу корней. В данном варианте опыта исследуемые параметры снизились более, чем на 30 % по сравнению с контролем и были сравнимы с необработанными растениями, подвергнутыми стрессу. При обработке проростков ГК ингибирующее действие оксидативного стресса оказалось ниже – масса надземной части снизилась на 18%, а масса корней на 26% по сравнению с контролем. Предварительная обработка проростков тритикале ЯК привела к тому, что масса надземной части оказалась сравнимой с контролем, а масса корней снизилась на 26 % по сравнению с контролем.

1 –контроль, 2 – оксидативный стресс без предварительной обработки проростков элиситором, 3 – синтетический пептид GmPep890 10-12 М,
4 – ГК 10-7 М, 5 – ЯК 10-6 М, 6 – сочетанное воздействие пептида GmPep890 и ЯК,7- сочетанное воздействие пептида GmPep890 и ГК.
Рисунок 3.5 – Влияние предобработки растений различными элиситорами на массу надземной части проростков тритикале, подвергнутых действию оксидативного стресса (10-3 М CuCl2, 10-3 М Н2О2 и 10-3 М аскорбиновой кислоты) в течение 48 часов.
Кроме того было изучено сочетанное действие композиций пептидного элиситора и органических кислот. Показано, что при предварительной обработке проростков синтетическим пептидом в композиции с ЯК масса надземной части была сравнима с контролем, масса корней снизилась по сравнению с контролем на 16%. При сочетанном действии пептида и ГК масса надземной части снизилась только на 16 %, а масса корней – 20% по сравнению с контролем.

1 –контроль, 2 – оксидативный стресс без предварительной обработки проростков элиситором, 3 – синтетический пептид GmPep890 10-12 М,
4 – ГК 10-7 М, 5 – ЯК 10-6 М, 6 – сочетанное воздействие синтетического пептида и ЯК,7- сочетанное воздействие синтетического пептида и ГК.
Рисунок 3.6 – Влияние предобработки растений различными элиситорами на массу корней проростков тритикале в условиях оксидативного стресса (10-3 М CuCl2, 10-3 М Н2О2 и 10-3 М аскорбиновой кислоты) в течение 48 часов.
Анализируя полученные данные, можно заметить, что обработка проростков тритикале чистым синтетическим пептидом GmPep890 не оказала защитного эффекта на морфометрические параметры растений, подвергнутых оксидативному стрессу. Отсутствие защитного действия этого пептида может быть обусловлено его видовой специфичностью. Как известно, данный пептид был выделен из листьев сои и является самым маленьким по размерам пептидным элиситором, найденным к сегодняшнему дню [66]. Показано, что данный пептид осуществляет индукцию защитных генов в растениях сои. Вместе с тем, имеются данные свидетельствующие о том, что соевый пептид не проявляет активности на табаке и арабидопсисе [45]. Следовательно, можно предположить, что активность данного соединения на злаковых культурах также проявляется в значительно меньшей степени по сравнению с бобовыми культурами, к которым и относится соя.
Вызванный защитный эффект применения ГК можно объяснить имеющимися в литературных источниках данными о том, что данная органическая кислота участвует в биосинтезе аминокислоты пролина, который обладает ярко выраженным осморегуляторным и стресс-протекторным действием. Защитный эффект глутаминовой кислоты может быть опосредован ее антиоксидантными свойствами. Как уже упоминалось в первой главе, ГК обладает способностью связывать ионы тяжелых металлов [7,56], а, следовательно, препятствует активному протеканию процессов образования гидроксильного радикала. Кроме того, положительное действие ГК может быть связано с ее участием в процессах накопления азота, приводящих к росту вегетативных органов растений, а также к увеличению количества хлорофилла и усилению фотосинтеза.
Значительно больший защитный эффект по сравнению с применением ГК выявлен при предварительной обработке проростков ЯК. Защитное действие ЯК может быть связано с тем, что ЯК обладает мощным антиоксидантным свойством, так как она принимает активное участие в обезвреживании свободных радикалов. Как показывают литературные данные, ЯК стимулирует рост и повышает урожай растений, способствуя повышению содержания в листьях хлорофилла, а это, в свою очередь, позволяет растению более интенсивно расти и давать больший урожай [27,56]. Применение ЯК также способствует повышению содержания в растениях других органических кислот, аскорбиновой кислоты, аминокислот, сахаров [48]. Вероятно, этим и объясняется положительное воздействие обработок препаратами янтарной кислоты на устойчивость и продуктивность сельскохозяйственных растений. Кроме того, янтарная кислота, наряду с яблочной, лимонной и другими кислотами функционирует в цикле Кребса. В литературе имеются данные, что данные кислоты, введенные экзогенно, легко проникают в митохондрии и используются в цикле трикарбоновых кислот, как и их эндогенные формы, активируя физиолого-биохимические процессы у растений [27].
Наиболее выраженный защитный эффект на морфометрические параметры проростков тритикале, подвергнутых воздействию оксидативного стресса, обнаружен при предобработке растений композицией пептид GmPep890 в сочетании с ЯК. Несмотря на отсутствие защитного действия чистого пептида, его сочетанное действие с ЯК приводит к усилению адаптации растения к стрессовому воздействию. Согласно данным, представленным в литературе, при совместном применении элиситоров различной химической природы, защитный эффект усиливается по сравнению с применением элиситоров по отдельности [45]. Считается, что одно вещество стимулирует проявление большей степени активности другого вещества. Растение же от сочетанного применения испытывает двойную выгоду, так как, во-первых, у него стимулируются физиологические процессы, а это дает возможность интенсификации ростовых процессов, а во-вторых, повышается устойчивость к неблагоприятным факторам среды.
Таким образом, в результате проведенных экспериментов выявлено, что предварительная обработка растений композицией пептид GmPep890 в концентрации 10-12 М и янтарная кислота в концентрации 10-6 М оказывает защитное действие на рост и развитие проростков тритикале в условиях воздействия оксидативного стресса.
Свидетельством влияния элиситоров на устойчивость растений к различного рода стрессорам могут служить увеличение накопления в растении ряда вторичных веществ, обладающих защитным действием. Это связано с тем, что элиситоры являются сигнальными веществами и осуществляют запуск сигнальных систем, приводящих к экспрессии защитных генов, и тем самым повышают устойчивость растений к биотическим и абиотическим стрессам. Согласно литературным данным, пептид GmPep890 вызывает активацию генов халконсинтезы и хитиназы в растениях сои. Это приводит к усилению синтеза фенольных соединений, в частности ГКК, являющихся предшественниками лигнина, и флавоноидов, обладающих антиоксидантными свойствами. Поэтому на следующем этапе нами было изучено влияние элиситоров на суммарное содержание фенольных соединений и ГКК в проростках тритикале при воздействии оксидативного стресса.
Как видно из полученных результатов, оксидативный стресс приводил к увеличению содержания вторичных соединений фенольной природы. В условиях действия стрессового фактора в течение 48 часов суммарный уровень растворимых фенольных соединений в листьях тритикале увеличился на 24 % по сравнению с контролем (рис.3.7). Еще в большей степени происходило увеличение содержания ГКК. Согласно полученным данным, при стрессовом воздействии уровень ГКК увеличился на 26% по сравнению с контролем (рис. 3.8). Столь сильное возрастание данных соединений в условиях действия стрессора свидетельствует об участии фенольных соединений в защите клеток от негативного влияния факторов среды. Являясь сильными акцепторами, фенольные соединения проявляют антиоксидантное действие, заключающееся в том, что они связывают ионы тяжелых металлов в устойчивые комплексы, лишая их каталитического действия, а также служат акцепторами образующихся при аутоксидации свободных радикалов и поэтому способны гасить свободнорадикальные цепи. Вторым, не менее важным, аспектом является то, что фенолы выполняют роль защитных барьеров на пути механических, химических, физических факторов среды, а также фитопатогенов [21].

1 –контроль, 2 – оксидативный стресс без предварительной обработки проростков элиситором, 3 – синтетический пептид GmPep890 10-12 М,
4 – ГК 10-7 М, 5 – ЯК 10-6 М, 6 – сочетанное воздействие синтетического пептида и ЯК, 7- сочетанное воздействие синтетического пептида и ГК.
Рисунок 3.7 – Влияние предобработки растений различными элиситорами на содержание растворимых фенольных соединений в проростках тритикале в условиях оксидативного стресса (10-3 М CuCl2, 10-3 М Н2О2 и 10-3 М аскорбиновой кислоты) в течение 48 часов.
Как показывают полученные данные, при предварительной обработке (за 24 ч. до действия стресса) проростков синтетическим пептидом уровень фенольных соединений увеличился на 34%, а уровень ГКК увеличился на 38% по сравнению с контролем. При обработке проростков ГК содержание фенольных соединений увеличилось в меньшей степени (на 25%), а уровень ГКК увеличился на 30% по сравнению с контролем. Обработка проростков ЯК привела к увеличению суммарного уровня растворимых фенольных соединений на 38% по сравнению с контролем. В данном варианте опыта наблюдалось значительное увеличение содержания ГКК, на 45% по сравнению с контролем. Следовательно, предварительная обработка проростков элиситорами, такими как синтетический соевый пептид GmPep890, ГК и ЯК стимулирует синтез фенольных соединений, что может свидетельствовать о запуске защитных систем растительного организма. Еще в большей степени влияние элиситоров на синтез фенольных соединений проявляется при их сочетанном воздействии. Показано, что при использовании композиции пептида с ЯК суммарное содержание фенолов увеличилось на 45%, а содержания ГКК увеличилось на 61% по сравнению с контролем. Композиция пептида с ГК вызвала меньший по величине ответ: суммарный уровень фенольных соединений повысился на 29%, а уровень ГКК на 42% по сравнению с контролем.

1 –контроль, 2 – оксидативный стресс без предварительной обработки проростков элиситором, 3 – синтетический пептид GmPep890 10-12 М,
4 – ГК 10-7 М, 5 – ЯК 10-6 М, 6 – сочетанное воздействие синтетического пептида и ЯК, 7 – сочетанное воздействие синтетического пептида и ГК.
Рисунок 3.8 – Влияние предобработки растений различными элиситорами на содержание ГКК в проростках тритикале в условиях оксидативного стресса (10-3 М CuCl2, 10-3 М Н2О2 и 10-3 М аскорбиновой кислоты) в течение 48 часов.
Анализ полученных результатов позволяет заключить, что предварительная обработка проростков тритикале пептидным соевым элиситором, а также его композициями с ГК и ЯК приводит к значительному накоплению суммарного содержания растворимых фенольных соединений, а также ГКК в листьях растений, подвергнутых оксидативному стрессу. Это свидетельствует об индукции защитных механизмов, в частности, синтезу веществ фенольной природы, позволяющих растению адаптироваться к стрессовому воздействию. Наибольшее накопление фенолов выявлено при обработке проростков тритикале композицией синтетического пептида GmPep890 с ЯК. Как было показано ранее, именно эта композиция оказывала наибольший защитный эффект на морфометрические показатели проростков, подвергнутых оксидативному стрессу.
На основании полученных результатов, а также литературных данных можно предположить воздействие элиситоров на физиолого-биохимические характеристики проростков тритикале в условиях воздействия оксидативного стресса. При экзогенной обработке растений данными препаратами, они воспринимаются как сигнальные вещества, и в растительном организме происходит запуск антистрессовых программ, приводящих к увеличению содержания фенольных соединений. Данные вещества выполняют антиоксидантную функцию, приводя к снижению скорости окислительных процессов, и ряд других функций, связанных с регуляцией роста и развития. В конечном итоге действие элиситоров приводит к увеличению устойчивости растений к стрессовым воздействиям, которая отражается в стабилизации физиолого-биохимических процессов.
Заключение
Исследовано влияние экзогенной обработки пептидным элиситором GmPep890, а также его композициями с ГК и ЯК на устойчивость проростков тритикале к оксидативному стрессу. На основании полученных результатов сделаны следующие выводы:
1) Экзогенная обработка проростков тритикале пептидным элиситором GmPep890 не оказывает защитного действия на растения, подвергнутые оксидативному стрессу.
2) Предварительная обработка проростков тритикале композициями пептидного соевого элиситора GmPep890 с ГК и ЯК приводит к повышению устойчивости растений к действию оксидативного стресса.
3) Наибольший защитный эффект на морфометрические характеристики проростков тритикале, подвергнутые оксидативному стрессу, оказывает композиция пептид GmPep890 в концентрации 10-12 М и ЯК в концентрации 10-6 М.
4) Экзогенная обработка проростков тритикале пептидным соевым элиситором GmPep890, а также его композициями с ГК и ЯК вызывает индукцию защитных механизмов, в результате чего происходит значительное накопление растворимых фенольных соединений, а также ГКК в листьях растений, подвергнутых оксидативному стрессу.
5) Наибольшее влияние на уровень фенольных соединений выявлено при сочетанном действии пептида GmPep890 с ЯК, приводящих к увеличению суммарного содержания фенольных соединений в листьях тритикале на 45 %, а уровня ГКК на 61% по сравнению с контролем.
Список использованной литературы
1.Алиева, Д.Р. Влияние повышения концентрации NaСI на фотосинтез и активность каталазы клеток Dunaliella salina // Вестник Днепропетровского университета, 2009. –В.17. –№1. –С.3-9.
2.Байрамбеков, А.А. Влияние обработки регулятора роста циркон на урожайность различных культур // Естественные науки, 2009. –Т.29. – №4. –С. 137-142.
3.Бараненко, В.В. Супероксиддисмутаза в клетках растений// Институт ботаники имени Н.Г.Холодного, 2006. – Т.48. – №6. – С.465-474.
4.Богдан, Г.П. Природа защитной реакции растений // Химия растительного сырья, 1981. –С.207.
5.Болдырев, М.И. Действие стрессовых факторов на растения // Журнал Защита и карантин растений, 2008. – №4.– С.14-15.
6.Бухов, Н.Г. Динамическая световая регуляция фотосинтеза // Физиология растений, 2004. – Т. 51. – С. 825-837.
7.Вахитов, В.А. Способ повышения урожайности сельскохозяйственных растений // Агрономия и лесное хозяйство, 1997. –Т.45. – №2. – С.30-32.
8.Веселова, Т.В. Стресс у растений (Биофизический подход) // Биохимия, 1993. – С.144.
9.Волынец, А.П. Ароматические оксисоединения – продукты и регуляторы фотосинтеза //Биохимия растений, 1983. – Т. 2. – №2. – С.157.
10.Газарян, И.Г. Особенности структуры и механизм действия пероксидаз растений// Успехи биологической химии, 2006. – Т.46. – С.303-322.
11.Гарифзянов, А.Р. Образование и физиологические роли АФК в клетках растений // Тульский государственный педагогический университет имени Толстого, 2008.–№6.–С.115-125.
12.Герасимова, Н.Г. Участие L-фенилаланинаммиаклиазы в индуцированной устойчивости и восприимчивости картофеля // Прикладная биохимия, 2005. –Т. 41. – № 1. – С.  117-120
117-120
13.Грибова, Н.Ю. Антиоксидантная активность фенольных фракций экстрактов лекарственных растений // Вестник Донецкого университета, 2008. – Т.10. – №1. –С. 137-140.
14.Гудвин, Т.Э. Введение в биохимию растений // Физиология и биохимия растений, 1986. – Т. 2.–№2. – С.312.
15.Гуськов, Е.Н. Роль низкомолекулярных антиоксидантов при оксидативном стрессе// Успехи современной биологии, 1993. –Т.113. –В.4. –С.456-470.
16.Демидчик, В.В. Оксидативный стресс и ионные каналы растений // Труды БГУ, 2013.–Т.3.–№2.
17.Достанова, Р.Х. Фенольный комплекс растений при засолении среды // Новосибирск, 1994. – С.34.
18.Егоров, Ц.А. Защитные пептиды иммунитета растений//Биоорганическая химия, 2012. –Т.38. –№1. –С.7-17.
19.Жуков, Н.Н. Динамика активности антиоксидантных ферментов Triticosecale на фоне NaCL засоления// Известия Тульского государственного университета, 2012. –В.2. – С.285-291.
20.Жусупова, К.С. Антиоксидантная активность некоторых препаратов, полученных на основе растений Казахстана // Вестник Новосибирского государственного педагогического университета, 2013. – Т.15. – №5. –С. 130-139.
21.Запрометов, М.Н. Фенольные соединения растений и их биогенез // Итоги науки и техники, 1988. – Т. 27. – С.188.
22.Кавеленова, Л.М. Особенности сезонной динамики водорастворимых фенольных соединений в листьях березы повислой в лесостепи // Химия растительного сырья, 2001. – №3. – С. 91–96.
23.Карпец, Ю.В. Ответ на гипертермию: молекулярно-клеточные аспекты // Вестник Харьковского национального аграрного университета. Сер. Биология, 2009. – В. 1(16). – С. 19-38.
24.Кашулин, П.А. Фотохимические процессы в растениях на Севере и окружающая среда // Вестник МГТУ, 2009. – Т.12. – №1. –С. 137-142.
25.Козел, Н.В. Аскорбат-глутатионовый цикл в растениях табака с повышенной экспрессией аскорбатпероксидазы при абиотическом стрессе// Вестник Фонда фундаментальных исследований, 2012. – С.89-100.
26.Колупаев, Ю. Е. Активные формы кислорода в растениях при действии стрессоров: образование и возможные функции // Вестник Харьковского Национального Аграрного Университета, 2007. – Т.3. – №12. – С6-26.
27.Кропоткина, В.В. Влияние сверхмалых доз органических кислот на урожайность и показатели качества Raphanus sativus //Вестник Алтайского государственного аграрного университета, 2009. – №8 (58). – С. 30–34.
28.Кузнецов, В.В. Общие системы устойчивости и трансдукции стрессорного сигнала при адаптации растений к абиотическим факторам // Вестник Нижегородского университета имени Лобачевского, 2001.–С.64-68.
29.Курганова, Л.Н. Прооксидантно - антиоксидантный статус гороха при действии стрессирующих абиотических факторов среды// Вестник Нижегородского университета имени Лобачевского Н.И, 2010.–№2(2).–С.550-556.
30. Курганова, Л.Н Перекисное окисление липидов одна из возможных компонент быстрой реакции на стресс // Нижегородский государственный университет имени Лобачевского.– С.76-78.
31.Масленников, П.В. Содержание низкомолекулярных антиоксидантов в лекарственных растениях Калининградской области//Химия растительного сырья, 2010. –№3. – С.127-133.
32.Меньщикова, Е.Б. Антиоксиданты и ингибиторы радикальных окислительных процессов // Успехи современной биологии, 1993. – Т. 113. – № 4. – С. 442-455.
33. Мерзляк, М.Н. Активированный кислород и жизнедеятельность растений // Соросовский образовательный журнал, 1999. – № 9. – С. 20-26.
34. Минибаева, Ф.В. Продукция супероксида и активность внеклеточной пероксидазы в растительных тканях при стрессе // Физиология растений, 2003. – Т.50. – С. 459-464.
35.Надиров, Н. К. Токоферолы — биологически активные вещества//М.: Знание, 1981. – С.64.
36. Николаева, М.К. Влияние засухи на содержание хлорофилла и активность ферментов антиоксидантной системы в листьях трех сортов пшеницы, различающихся по продуктивности // Физиология растений, 2010. – Т. 57. – С. 94-102.
37. Обозный, А.И. Активность аскорбатпероксидазы и содержание АК в проростках пшеницы при закаливании и повреждающих тепловых и осмотических воздействий//Харьковский национальный аграрный университет, 2012.–№3(27).–С.65-74.
38.Павловская, Н.Е. Активные формы кислорода и апоптоз у пшеницы и гороха// Сельскохозяйственная биология, 2010. – № 1. – С.51-55.
39.Полесская, О.Г. Растительная клетка и активные формы кислорода// М.: КДУ, 2007. – 140 с.
40.Полякова, Л.В. Изменчивость фенольных соединений у некоторых травянистых и древесных растений от межпопуляционного до внутривидового уровня //Химия растительного сырья, 2000. – №1. – С.121–129.
41. Попов, В.Н. Перекисное окисление липидов при низкотемпературной адаптации листьев и корней теплолюбивых растений табака//Физиология растений, 2010. – Т. 57. – С. 153-157.
42.Пятыгин, С.С. Стресс у растений: физиологический подход// Журнал общей биологии, 2008. –№4.–С.294-298.
43.Сапко, О.А. Фенольные соединения культуры клеток Alhagi kirghisorum // Химия природных соединений, 1999. – №1. – С.182-184.
44.Селье, Г. На уровне целого организма // М.: Наука, 1972. – 121 с.
45.Соколов, Ю.А. Элиситоры и их применение// Вести национальной академии наук Беларуси, 2014. –№4. –С.109-120.
46. Соловченко, А.Е. Экранирование видимого и УФ излучения как механизм фотозащиты у растений // Физиология растений, 2008. – Т. 55. – С. 803-822.
47.Тарчевский, И.А. Влияние элиситоров на ионные потоки и электрический потенциал растений. М.: Наука, 1993. –83с.
48.Тарчевский, И.А. Элиситор-индуцибельные сигнальные системы и их взаимодействие // Физиология растений, 2000. –Т.47. – №2. – С. 321–331.
49.Тютерев, С.Л. Экологически безопасные индукторы устойчивости растений к болезням и физиологическим стрессам // Вестник защиты растений, 2015. – №1(83). –С.131.
50. Чиков, В.И. Фотодыхание // Соросовский образовательный журнал, 1996. – № 11. – С. 2-8.
51.Чиркова, Т.В. Физиологические основы устойчивости растений. – СПб:Изд-во СПб ун-та, 2002. – 244с.
52.Чупатина, Н.Ю. Сравнение методов анализа суммарной антиоксидантной активности //Вестник Балтийского федерального университета им. И. Канта, 2012. – №1. –С.69-74.
53.Шакирова, Ф.М. Неспецифическая устойчивость растений к стрессовым факторам и ее регуляция //Издательство «Гилем» УФА, 2001. –С. 60-75.
54.Школьник, М.Я. О причинах повышения содержания фенолов у растений при избытке и недостатке минеральных элементов // Растения в экстремальных условиях минерального питания, 1983. –С. 140-148.
55.Шоринг, Б.Ю. Необходимость образования супероксида для развития этиолированных проростков пшеницы // Биохимия, 2000. – Т. 65. – №12. – С. 1612-1618.
56. Яблонская, Е.К. Индукция устойчивости пшеницы к фузариозу абиогенными элиситорами// Научный журнал КубГАУ, 2014. –№99 (05). –С.1-15.
57. Arrigo, A.P. Gene expression and the thiol redox state // Free Rad. Biol. Med, 1999. – V. 27. – P. 936-944.
58. Apel K. Reactive oxygen species: metabolism, oxidative stress, and signal transduction // Annu. Rev. Plant Biol, 2004. – V. 55. – P. 373-399.
59. Brand, M.D. Mitochondrial superoxide production, biological effects, and activation of uncoupling proteins // Free Radical Biology & Medicine, 2004. – V. 37 (6). – P. 755-767.
60. Foyer, С.H. Oxidant and antioxidant signalling in plants: a re-evaluation of the concept of oxidative stress in a physiological context // Plant, Cell and Environment, 2005. – V. 28. – P. 1056-1071.
61. Hart, J. J. Characterisation of Cadmium binding, uptake and translocation in intact seedlings of bread and durum wheat cultivars // Plant Рhysiol, 1998. – V. 116. – № 5. – P. 1413-1420.
62. Herrnandez, J. Salt induced oxidative stress mediated by activated oxygen species in pea leaf mitochondria // Plant Physiol, 1993. – V. 89. – P. 103-110.
63. Scandalios, J.G. Oxidative stress: molecular perception and transduction of signals triggering antioxidant gene defenses // Braz. J. Med. and Biol. Res, 2005. – V. 38. – №7. – P. 995-1014.
64. Slooten, L. Overproduction of Arabidopsis thaliana Fe-SOD confers oxidative stress tolerance to transgenic maize // Plant Cell Physiol, 1999. – V. 40. – P. 515-523.
65.Richard, G. Molecular identification and expression of the peroxidase responsible for the oxidative burst in French bean (Phaseolus vulgaris L.) and related members // Plant Mol. Biol, 2001. – V. 47. – P. 607-620.
66.Yamaguchi, Y. Endogenous peptide elicitors in higher plants// Plant Biology, 2011. –V. 14. – P. 2-9.
|
|
|
|
|
Дата добавления: 2015-08-31; Просмотров: 1753; Нарушение авторских прав?; Мы поможем в написании вашей работы!