
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Розрахунок вмісту фосфору у середовищі 1 страница
|
|
|
|
Розрахунок вмісту в середовищі джерела азотного живлення
Розрахунок вмісту в середовищі джерела вуглецевого живлення
Потреби для синтезу біомаси. Припустимо, що у біомасі міститься 50 % вуглецю. Таким чином, у 9 г біомаси вміст вуглецю становить 4,5 г. Розрахуємо кількість сахарози, необхідної для одержання 9 г/л біомаси. Молекулярна маса сахарози становить 270. Отже, у 270 г сахарози міститься 72 г вуглецю, тоді 4,5 г вуглецю буде міститися в:
С (С6Н22О11) =  = 16,87 г
= 16,87 г
Враховуючи 40% втрат субстрату на «холосте окиснення» для одержання 9 г/л біомаси, необхідно внести:
С (С6Н22О11) = (16,87 * 0,4) + 16,87 = 23,62 г/л
Потреби для синтезу біомаси. Припустимо, що в біомасі міститься 10 % азоту. Таким чином, у 9 г біомаси вміст азоту становить 0,9г. Пептон є джерелом органічного азоту, який засвоюється продуцентом декстрану. Концентрація доступного для бактерій органічного азоту (за елементом N) у пептоні становить 14 % [10]. Отже,
100 г пептону – 14 г N
Xn – 0,9 г N,
X =  г пептону
г пептону
У біомасі міститься близько 3% фосфору (за елементом Р). Отже, для синтезу 9 г/л біомаси вміст фосфору у середовищі повинен становити (9 * 0,03 = 0,27 г/л). Розрахуємо кількість K2HPO4 , необхідного для одержання 9 г/л біомаси. Молекулярна маса K2HPO4 становить 174. Отже, у 174 г K2HPO4 міститься 31 г фосфору, тоді 0,27 г фосфору буде міститися у:
С (Р) = 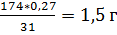 солі.
солі.
Для одержання 9 г/л біомаси вміст K2HPO4 у середовищі повинен становити 1,5 г солі [10].
Отже, компоненти поживного середовища:
Сахароза – 23,62 г/л
Пептон – 6,4 г/л
K2HPO4 – 1,5 г/л
2.4 Характеристика біологічного агента
Бактерії L. mesenteroides відносяться до групи грампозитивних коків. До цієї групи відносять істотно відрізняючі роди, які зібрані в одну групу на основі двох загальних ознак — сферична форма клітин і позитивна реакція по фарбуванню за Грамом. Ці бактерії не утворюють ендоспор. У більшості організмів цієї групи клітини сферичні і лише злегка овальні і майже завжди чітко грампозитивні. Рухливість нетипова. Роди розподіляються на підгрупи аеробних, факультативно анаеробних та строго анаеробних мікроорганізмів [12].

Рис. 2.1 Бактерії виду L. mesenteroides під електронним мікроскопом
Морфолого — культуральні ознаки
Дрібні коки, розташовані як поодинці і попарно (25%), так і у вигляді ланцюжків (75%) витягнутої форми довжиною 0,5 – 0,7 × 0,7 – 1,2 мкм. Іноді спостерігаються довгі ланцюжки із коротких паличок з заокругленими кінцями. Не утворюють спори та нерухливі. Ростуть досить повільно, утворюючи дрібні, іноді слизисті колонії на середовищах з сахарозою. При візуальному вивченні колоній, які виросли на поживному середовищі в термостаті при температурі 24°С і при використанні бінокулярної лупи при звичайному освітленні можна побачити колонії в S-формі не більше 2 мм в діаметрі, матові, зернисті, з рівними краями. Декстран візуально не визначається. При вивченні колоній в косопроходячому штучному освітленні (кут нахилу світлового променя 45°) з використанням бінокулярної лупи можна побачити, що колонії володіють оранжево-зеленим і голубим світінням [8, 12].


Рис. 2.2 L. mesenteroides під електронним мікроскопом: голубе світіння (зліва) та оранжево-зелене (справа)
Фізіолого — біохімічні ознаки біологічного агента
Факультативні анаероби, оптимальна концентрація розчиненого в середовищі кисню дорівнює 5% від повного насичення. За типом живлення — хемоорганотрофи з облігатною потребою в зброджувальнму вуглеводі, які потребують багатих поживних середовищ. Асимілюють амонійний азот. Штам не потребує вітамінів. Оптимальна температура росту штаму 24-250С і при рН середовища — від 6,2 до 7,2. Оптимум 7,0. Присутність каталази, цитохромів і тейхоєвих кислот у складі клітинної стінки — варіабельні ознаки. Бактерії даного роду є гетероферментативними, оскільки у процесі зброджування глюкози утворюється не тільки молочна кислота, а й етанол, оцтова кислота, СО2 [12, 28].
При культивуванні штаму на середовищах з глюкозою, декстран не утворюється. Синтез декстрану відбувається при вирощуванні продуцента на середовищах з сахарозою, при цьому відбувається виділення ферменту декстрансахарози, який каталізує відщеплення від сахарози молекул глюкози і наступний синтез декстрану з 1,6-глюкозидними зв’язками по одноланцюговому механізму без утворення проміжних з’єднань [28].
На сьогодні маємо такий таксономічний статус L. mesenteroides згідно з IX виданням Керівництва Бергі з систематики бактерій(фенотипова класифікація):
Царство – Procaryotae
Відділ – Firmicutes
Клас – Firmibacteria
Родина – Lactobacillaceae
Рід – Leuconostoc
Вид – Leuconostoc mesenteroides
Згідно з філогенетичною класифікацією Бергі даний вид бактерій відноситься до 17 групи, грампозитивні коки, яка в свою чергу поділяється на три підгрупи: 1) аеробні коки, 2) факультативні анаеробні або мікроаерофільні коки, 3) строго анаеробні коки. Мікроорганізми Leuconostoc mesenteroides відносяться до факультативних анаеробів [12].
Особливості метаболізму L. mesenteroides
Бактерії даного роду є гетероферментативними, оскільки у процесі зброджування глюкози утворюється не тільки молочна кислота, а й етанол, оцтова кислота, СО2. Зброджувальні вуглеводи в основному моно- і дисахариди. Дані бактерії здатні тільки до бродіння, вони не містять гемопротеїнів (цитохромів і каталази), аргінін не гідролізують, індол не утворюють, негемолітичні, нітрат не відновлюють. Ще однією особливістю цих бактерій є потреба в ростових факторах (фолієва кислота). Для даних бактерій є характерним гетероферментативне молочнокисле бродіння. Уних відсутні такі ферменти гліколізу, як альдолаза та триозофосфатізомераза. Початкове розщеплення глюкози у них відбувається лише за пентозофосфатним шляхом. Далі проходить процес гетероферментативного бродіння [12, 13].
 РОЗДІЛ 3
РОЗДІЛ 3
ТЕХНІКО-ЕКОНОМІЧНЕ ОБГРУНТУВАННЯ
Декстран — вуглевод, який містить розгалужені ланцюги залишків глюкози, які являються продуктами життєдіяльності бактерій та грибів. Його використовують в якості лікарських засобів, особливо в якості розширювача обсягу плазми крові. Декстран знайшов промислового застосування в харчовій, фармацевтичній та хімічній промисловості як ад’ювант, емульгатор, носій і стабілізатор. У харчовій промисловості декстран в даний час використовується як загусник для варення і морозива. Він запобігає кристалізації цукру, покращує утримання вологи і підтримує аромат, і зовнішній вигляд різних продовольчих товарів [28].
3.1 Короткий огляд технологій виробництва декстрану
Першими технологіями отримання декстрану для медицини був кислотний гідроліз. В результаті утворювались багаточисленні біологічно активні побічні продукти, що не задовольняли вимогам безпеки медичних препаратів. Сучасні технології (біотехнологічні) отримання декстранів із середньою молекулярною масою 35 та 60 кДа в більшій мірі дозволені для використання в медичних цілях. За допомогою різних методів очистки, можна отримати чистий продукт, без будь-яких домішок [8].
Розглянемо більш детально виробничий процес отримання декстрану з використанням бактерій в якості продуцента основного продукту. В основу його виробництва закладений принцип розділення на функціональні блоки.
Розділяють етапи, які відповідають за синтез продукту (передферментаційний та ферментаційний) і його очистку [8].
Процес виробництва декстрану починається з приготування компонентів поживного середовища для вирощування батерій-продуцетів, які потім переносять у змішувач. Отримане поживне середовище передають на стерилізацію та охолодження.
Культивування продуцентів (Leuconostoc mesenteroides PCSIR-4) здійснюють до утворення полісахариду необхідної в’язкості (18 год) [8, 28].
Крім етапів синтезу продукту і їх очистки, технологія виробництва декстрану містить етап фракціонування.
Фракціонування декстранів на виробництві проводять з використанням спиртів, в основному метилового, як найбільш доступного.
На наступній стадії культуральну рідину пропускають через осаджувач для відокремлення декстрану від бактерій [8].
Далі відбувається процес фільтрації, що дозволяє відокремити біологічний матеріал. Наступна стадія – це розділення декстрану на окремі фракції з заданими характеристиками та очищення субстанції на іонообмінній колонці, після чого розчин піддають фінальній ультратонкій фільтрації і стабілізації (див. рис. 1) [8].
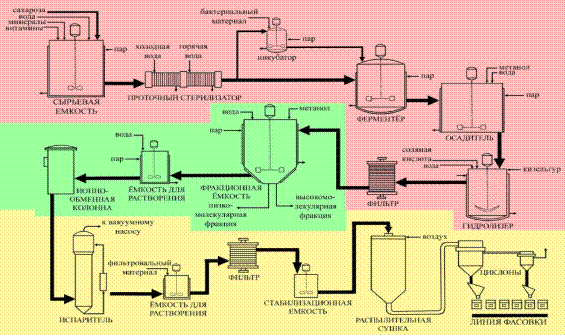
Рис. 3.1 Схема виробничої лінії отримання декстрану
Декстран являється лікарською речовиною у складі кровозамінників, які найбільш часто використовуються в стаціонарних умовах. Вони входять в схеми лікування захворювань різного ступеня тяжкості і в рецептурі клінік хірургічного і терапевтичного профілю, і складають близько 70 % [6, 12, 14].
На сьогоднішній день в Україні зареєстровано 122 торгові назви препаратів в формі перфузійних розчинів. Більше половини асортименту (52,46 %) складає продукція вітчизняних підприємств фармацевтичної промисловості [6, 12, 14].
За класифікацією АТС Реополіглюкін відноситься до групи кровозамінників та білкових фракцій плазми крові (В05АА). В даній групі нараховано 29 торгових назв препаратів.
Реополіглюкін можна віднести до життєво необхідних препаратів, адже цей кровозамінник використовується при таких захворюваннях як: тромбоз, ендартериїт, хвороба Рейно, тромбофлебіт, профілактика та лікування травматичного, операційного, опікового та токсичного шоків, під час судинних та пластичних операціях та операціях на серці. Якщо вчасно не застосувати розчин кровозамінника, половина хворих закінчують своє життя летально [7, 18].
3.2 Розрахунок потужності виробництва декстрану
Станом на 1 червня 2014 року населення України складає майже 43 млн. людей.
Таблиця 3.1 Статистика захворюваності в Україні [1, 3, 5, 15, 18]
| Назва захворювання | Коротка характеристика | Статистичні дані, % | Перерахунок на кількість населення, чол. | Дозування, мл (г) |
| Тромбоз | Процес зажиттєвого утворення згустків крові — тромбів — у кровоносних судинах або в порожнинах серця людини | 1 290 000 | 400 мл (40 г декстрану) | |
| Ендартериїт | Системна хвороба артерій | 3 440 000 | 400 мл (40 г декстрану) |
Продовження табл. 3.1
| Хвороба Рейно | Розлад, що викликає сильне звуження кровоносних судин шкірних покривів, яке відбувається у людини як наслідок сильного стресу або дії холоду. | 1 720 000 | 400 мл (40 г декстрану) | |
| Тромбофлебіт | Запалення стінки вени із закупоркою вени згустком крові (тромбом). | 6 880 000 | 400 мл (40 г декстрану) | |
| Травматични й операційний, опіковий, токсичний шок | – | 1 290 000 | 600 мл (60 г декстрану) | |
| Судинні та пластичні операції | – | – | 12 000 | 1000 мл (90 г декстрану) |
| Операції на серці | – | – | 17 000 | 1000 мл (90 г декстрану) |
Загальна кількість українців, які потребують лікування розчинами кровозамінників складає 14 649 000 людей (34 %). Реополіглюкін займає приблизно 10 % усіх кровозамінників на ринку України. Тому кількість населення, яка потребує саме Реополіглюкін така:
14 649 000 × 0,1 = 1 464 900 чол.
В Україні зареєстровано 4 підприємства, які виготовляють даний лікарський засіб: «Новофарм – Біосинтез», «Юрія – Фарм», ООО «Ніко», «Фармація» [6].
Представлені вище підприємства не мають власного виробництва субстанції (декстран) для виготовлення Реополіглюкіну, вони купують її за кордоном, а саме в Словаччині та Данії [14].
Тому ми пропонуємо розпочати його повне виробництво, починаючи із біосинтезу декстрану і до готового препарату в аптеках.
Проектом передбачено забезпечення субстанцією і препаратом 50% фармацевтичного ринку України та аналогічну кількість в країни близького зарубіжжя.
Продуцентом декстрану є штам бактерій Leuconostoc mesenteroides PCSIR-4, продуктивність яких складає 90,4 г/л, а час культивування – 18 годин [28].
Порахуємо необхідну кількість декстрану на рік:
1л – 90,4 г
1 382 900 л – х г
х = 125 000 (кг)
Загальна кількість культуральної рідини:
125 000 кг × 1 л / 90,4 г/л = 1382 м3/рік.
Врахуємо 20% втрат:
1382 м3 × 120% / 100% = 1658 м3/рік.
Припустимо, що час підготовки процесу стерилізації складає 8 годин, тоді загальний цикл ферментації цикл буде складати:
8 + 18 = 26 годин.
Нехай кількість робочих днів (з урахуванням простою) складає 336 днів (8064 годин). Враховуючи кількість часу на один цикл, порахуємо кількість циклів в рік:
7920 / 26 = 310 циклів.
Кількість культуральної рідини за один цикл складатиме:
1658 м3 / 310 = 6,373 м3
Отже, враховуючи вище викладені розрахунки, річна потужність підприємства буде сягати 1658 м3 культуральної рідини. Кількість робочих днів – 336. За цей час буде відбуватися 310 ферментацій у ферментері об’ємом 10 м3 з коефіцієнтом заповнення 0,7.
3.3 Розрахунок кількості стадій підготовки посівного матеріалу
Перед тим як засіяти поживне середовище мікроорганізмами його попередньо потрібно приготувати та простерилізувати. Це є важливий та відповідальний процес, оскільки від цього залежить якість посівного матеріалу та відповідно кількість продукту біосинтезу.
Компоненти поживного середовища (г/л) [10]:
Сахароза – 300
Дріжджовий екстракт – 5
Пептон – 5
K2HPO4 – 15
NaCl – 0,01
MgSO4×7H2O – 0,01
MnCl2×H2O – 0,01
CaCl2 – 0,05
Отже, при об’ємі ферментера 10 м3, об’єм середовища складатиме (10 * 0,6) 6 м3, оскільки коефіцієнт заповнення (К) дорівнює 0,6 від об’єму ферментера. Оскільки кількість посівного матеріалу складає 10%, то об’єм інокуляту складає (6 * 0,1) 0,6 м3. Враховуючи усі представлені дані ми матимемо 5 стадій підготовки посівного матеріалу:
I стадія – Vінок = 0,6 дм3,
II стадія – Vінок 1 = 6 дм3,
III стадія – Vінок 2 = 60 дм3,
IV стадія – Vінок 3 = 600 дм3,
V стадія – Vінок 4 = 6000 дм3
 РОЗДІЛ 4
РОЗДІЛ 4
БІОСИНТЕЗ ЦІЛЬОВОГО ПРОДУКТУ
4.1 Шляхи катаболізму сахарози у L. mesenteroides PCSIR-4
Джерелом вуглецю та енергії (ростовим субстратом) у поживному середовищі (див. п. 1) для біосинтезу декстрану є сахароза [12, 28].
За Kyoto Encyclopedia of Genes and Genomes сахароза розщеплюється наступним шляхом:
1. З сахарози утворюється сахароза-6-фосфат (фермент сахаразаРТС(КФ 2.7.1.69)) [21].
2. Наступним є перетворення сахароза – 6 – фосфат на β – D – фруктозу (фермент – β-фруктофуранозидаза (КФ 3.2.1.26)). В свою чергу β-D-фруктоза розщеплюється за допомогою фруктокінази (КФ 2.7.1.4) до β- D- фруктози- 6- фосфат та α- D- глюкозо- 6- фосфат, яка в свою чергу перетворюється на α- D- Глюкозо-1-фосфат (ферменти 5 – глюкозо-6-фосфатізомераза (КФ 5.3.1.9), 6 – фосфоклюкомутаза (КФ 5.4.2.2)) [21].
Згідно Kyoto Encyclopedia of Genes and Genomes катаболізм сахарози представлений на прикладі штаму L. mesenteroides. Оскільки у біосинтезі бактерій L. mesenteroides не виявлено ключового ферменту гліколізу, то розщеплення глюкози у них відбувається за пентозофосфатним циклом. Також бактерії L. mesenteroides до гетероферментативних молочнокислих бактерій, у яких розщеплення субстрату відбувається лише за пентозофосфатним циклом [21].
У пентозофосфатному циклі α-D-глюкозо-1-фосфат перетворюється на D-глюконо-1,5-лактон-6-фосфат (фермент глюкозо-6-фосфатдегідрогеназа (КФ 1.1.1.49)). Далі D-глюконо-1,5-лактон-6-фосфат під дією ферменту 6-фосфоглюконолактоназа (КФ 3.1.1.31) перетворюється на D-глюконат-6-фосфат, який окиснюється до D-рибулозо-5-фосфат (фермент 6-фосфоглюконатдегідрогеназа (КФ 1.1.1.44)). В свою чергу D-рибулозо-5-фосфат окиснюється до D-рибозо-5-фосфат. На даному етапі схема розгалужується. За допомогою ферментів фосфоглюкомутази (КФ 5.4.2.2); фосфопентомутази (КФ 5.4.2.7); рибокінази (КФ 2.7.1.15) D-рибозо-5-фосфат може перетворитися на D-рибозу, D-рибозу-1-фосфат, а за участю ферменту рибозофосфатпірофосфокінази (КФ 2.7.6.1) на фосфорибозилпірофосфат [12, 27].
D-рибулозо-5-фосфат під дією ферменту рибулозофосфат-3-епімерази (КФ 5.1.3.1) перетворюється на D-ксилулозо-5-фосфат, останній продукт реакції каталізується транскетолазою і розщеплюється з утворенням гліцеральдегідфосфату та D-седогептулозо-7-фосфат. На даному етапі закінчуються окиснювальні процеси пентозофосфатного циклу [12, 27].
Наступні реакції є реакціями перетворення пентозофосфатів на гексозофосфати, та навпаки. D- ксилулозо-5-фосфат перетворюється на β-D-фруктозо-6-фосфат з якої утворюється α-D-глюкозо-6-фосфат (фермент глюкозо-6-фосфатізомераза (КФ 5.3.1.9)) і цикл замикається [12, 27].
Схема катаболізму сахарози за пентозофосфатним циклом представлена на рис. 4.1.

|
|
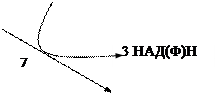 | |||
 | |||

|
|

4.2 Біотрансформація декстрану у L. mesenteroides PCSIR-4 з сахарози
Декстран належить до групи гомополісахаридів, що складається з мономерів глюкози, пов’язаних в основному (95 %) α – 1-6 зв’язками, рідше α – 1-2 та α – 1-3 зв’язками. Він являє собою полімер D-глюкози з високою молекулярною масою [26].
|
|






|
|






 Фруктоза + глюкоза
Фруктоза + глюкоза
 |  | ||||||||||||
 | |||||||||||||
 | |||||||||||||
 | |||||||||||||
 | |||||||||||||
 |
 РОЗДІЛ 5
РОЗДІЛ 5
ОБГРУНТУВАННЯ ВИБОРУ ТЕХНОЛОГІЧНОЇ СХЕМИ
5.1 Обгрунтування доферментаційних процесів та виробничого біосинтезу
5.1.1 Обгрунтування необхідності підготовки персоналу
Організація та функціонування фармацевтичної галузі головним чином залежить від кваліфікованого персоналу. Для того, щоб підприємство виготовляло якісні лікарські засоби, кожен працівник повинен мати спеціальну, вищу освіту та достатній кваліфікаційний рівень. На підприємстві повинна бути достатня кількість персоналу і кожен з них повинен виконувати свої певні обов’язки [9].
Роботодавець повинен забезпечити персоналу навчання відповідно на місці роботи. Воно включає в себе вивчення головних правил та принципів «Належної Виробничої Практики» (GMP), а також навчання для досягнення певного кваліфікаційного рівня. Особливу увагу приділяють робітникам, які працюють в чистих приміщеннях, адже в таких зонах виготовляються стерильні лікарські засоби [9].
Персонал, який працює з сильнодіючими, токсичними, інфікуючими, сенсибілізуючими речовинами, а також мікроорганізмами, повинен проходити додаткове, спеціальне навчання. Перевірку кваліфікаційного рівня персонал проходить один раз на рік.
Велика увага приділяється здоров’ю та гігієні персоналу. Кожен працівник повинен бути ознайомлений з методиками, що стосуються здоров’ю та дотримання гігієнічних правил і безпосередньо дотримуватися їх. Головним правилом є медичне обстеження перед прийомом на роботу та один раз на рік в подальшому [9].
Слід постійно звертати увагу на санітарний стан персоналу, адже люди – це головне джерело забруднення лікарських засобів мікрочасточками та мікроорганізмами. Найбільша їх кількість виділяється з волосся, шкіри та верхніх дихальних шляхів. Тому кожен робітник повинен бути проінформований про правила безпеки та поведінки на підприємстві.
Повинні бути сформовані відповідні методики за якими персонал миється та переодягається. Кожна особа, яка входить і виробничі зони, повинна носити захисний одяг, що відповідає виконуваним нею операціям.
Слід уникати прямого контакту між руками оператора і продукцією, для забезпечення повної стерильності [9].
Необхідно, щоб одяг і його якість відповідали процесу і класу робочої зони, для уникнення контамінації. Робочий одяг за правилами GMP необхідно змінювати один раз на день, а маску раз на дві години.
|
|
|

 Прання
Прання
5.1.2 Обгрунтування необхідності підготовки чистих приміщень
Полісахарид декстран є діючою речовиною кровозамінника Реополіглюкіна. Враховуючи те, що в даному курсовому проекті розглядаються доферментаційні та ферментаційні процеси, то ці операції будуть проходити у класифікованих приміщеннях [20].
Середовище приміщення повинно представляти мінімальний ризик у плані контамінації вихідної сировини, матеріалів. Приміщення повинні бути спроектовані і оснащені таким чином, щоб забезпечувати максимальний захист від контамінації. Їхнє об’ємно-планувальне рішення і розташування устаткування повинні відповідати вимогам державних будівельних норм (ДБН) і інших законодавчих актів України. Приміщення повинні бути розташовані таким чином, щоб виробництво протікало логічно у відповідності з порядком технологічних операцій [9].
Внутрішні фізичні фактори (температура, вологість тощо) повинні бути відповідними і не впливати негативно на проведення усіх стадій ферментації та на сам персонал.
Внутрішні поверхні (стіни, підлога, стеля) повинні бути гладенькі, без щілин і тріщин на стиках, а супряження стін між собою і стін з стелею повинно мати закруглення радіусом 300мм. Стіни «чистих» приміщень покривають пластмасами або емалями. Легко та ефективно очищатися, дезінфікуватися. З них не повинні виділятися часточки. Стеля має бути герметизована задля запобігання виділяння часточок. На підлозі має бути простелений лінолеум або наливна композитна підлога [9].
Також необхідно застосовувати правила безпечного ведення процесу по культивуванню продуцента:
1. Для попередження витоку культуральної рідини, у разі розгерметизації ферментера, підлога повинна бути нижчою на 10 см, ніж оточуючого середовища.
2. Всі стоки, промивні води з ферментерів повинні поступати у окрему ємність та проходити етап знезараження.
3. Викиди технологічного повітря з ферментера повинні проходити очищення на стерилізаційних фільтрах з діаметром пор менше 0,3 мкм (наприклад, фільтри фірми Pall).
4. Всі вузли подачі середовища у ферментер, вентилі, комунікації повинні знаходитися під паровим захистом, що попередить витік продуцента назовні ферментера та надходження контамінуючої мікрофлори у ферментер.
Після завершення робіт приміщення слід обробити дезінфікуючими засобами і УФ-випромінюванням.
Дотримання цих заходів дозволяє виготовляти якісні та безпечні лікарські засоби.
5.1.3 Обгрунтування необхідності підготовки вентиляційного повітря
Лікарські засоби виготовляються у чистих, класифікованих приміщеннях. Для забезпечення повної стерильності чистих зон, за правилами GMP, необхідна підготовка вентиляційного повітря, що забезпечить якість та безпеку готової продукції.
|
|
|
|
|
Дата добавления: 2015-08-31; Просмотров: 1045; Нарушение авторских прав?; Мы поможем в написании вашей работы!