
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Приготування і стерилізація розчину сахарози для дробного внесення в поживне середовище 1 страница
|
|
|
|
В процесі біосинтезу сахарозу вносимо дробно – 300 г/л починаючи з 10-ї години культивування. Постійно підтримували концентрацію сахарози у культуральній рідині 9 г/л.
На початку процесу біосинтезу в поживне середовище ми внесли 40 г/л сахарози. Залишилось – 260 г/л. Отже, 260: 40 = 7 разів ще потрібно внести сахарозу. Так, як тривалість процесу біосинтезу декстрану бактеріями L. mesenteroides PCSIR-4 18 годин: (18 – 10): 7 = 1 година, тобто через кожну годину потрібно вносити 40 г/л сахарози в поживне середовище.
5.3 Обгрунтування стадій виділення та очищення цільового продукту
Після закінчення процесу культивування (18 год) та накопичення цільового продукту для можливості використання декстрану у фармацевтичній галузі, а саме в якості замінника плазми крові, необхідно провести такі технологічні процеси, як виділення та очищення ЕПС. Даний полісахарид являється позаклітинним продуктом бактерій штаму Leuconostoc mesenteroides PCSIR-4, тому немає необхідності проводити дезінтеграцію клітин.
Проаналізувавши особливості технологічного процесу, ми матимемо такі стадії:
1. Розбавлення водою культуральної рідини;
2. Центрифугування;
3. Осадження;
4. Фільтрування;
5. Розбавлення водою;
6. Деструкція ЕПС;
7. Нейтралізація кислоти;
8. Ультрафільтрація розчину (до 10 000 кДа);
Обгрунтування вибору всіх технологічних процесів наведено нижче по тексту [20, 22-27, 31, 33, 34].
5.3.1 Обгрунтування необхідності попередньої обробки культуральної рідини
Культуральна рідина, що містить у своєму складі декстран представляє собою високов’язку рідину, на що впливають умови культивування бактерій.
Таблиця 5.5 Залежність в’язкості продукту від часу та його виходу
| L. mesenteroides PCSIR-4 | ||
| Час культивування | Кількість декстрану, (г/л) | В’язкість, (сСт) |
| 36,80 | 23,15 | |
| 90,40 | 20,64 | |
| 34,00 | 18,72 | |
| 39,60 | 25,08 |
Максимальна кількість полісахариду накопичується після 18 годин культивування, далі кількість продукту поступово зменшується, а в’язкість збільшується, що свідчить про високу молекулярну масу речовини. В’язкість декстрану, який утворюється за 18 годин є оптимальною для того, щоб його можна було виділити та очистити. При подальшому збільшенні тривалості культивування спостерігається суттєве підвищення в’язкості декстрану до 25-27 сСт, що суттєво ускладнить процеси його подальшого оброблення. Також за цей час накопичується найбільша кількість продукту [28].
Виходячи з цього, необхідно розбавляти культуральну рідину водою, задля зменшення її в’язкості та полегшення подальшого процесу виділення ЕПС.
5.3.2 Обгрунтування вибору способу відділення біомаси та відповідного обладнання
Першою стадією у процесі виділення декстрану є процес відділення біомаси (L. mesenteroides PCSIR-4) від культуральної рідини та отримання супернатанту, що містить готовий продукт ЕПС.
В літературних даних представлено декілька способів отримання супернатанту: фільтрування, сепарування, центрифугування. Але за представленими недоліками ми не можемо використовувати деякі способи відділення бактеріальних клітин [25-27, 31].
Отже, ми маємо такі недоліки в процесах фільтрування та сепарування:
1. Культуральна рідина є достатньо в’язкою, навіть після розбавлення водою, що ускладнює процес фільтрування.
2. Процес фільтрування не забезпечить повне очищення культуральної рідини від бактеріальної мікрофлори.
3. Фільтрування є громіздкий процес за рахунок додаткових процесів оброблення культуральної рідини.
4. Виробництво декстрану є багатотоннажне, тому процес фільтрування займе велику кількість часу. За допомогою центрифугування ми скоротимо цей час.
5. Процес фільтрування є економічно затратний процес за рахунок можливості забивання фільтрів.
6. Сепарування використовується для дріжджових клітин.
Отже, найдоцільнішим способом відділення клітин продуценту та мікрочасточок у технологічному процесі виробництва декстрану буде процес центрифугування.
Центрифугування - спосіб розділення рідких неоднорідних систем під дією відцентрових сил, яке здійснюється в машинах-центрифугах [31].
Виходячи з конструктивних ознак, центрифуги розрізняють головним чином за розташуванням і способом закріплення валу. За цією ознакою центрифуги ділять на: вертикальні, горизонтальні і похилі. Існує три види вертикальних центрифуг: стоячі (з підпертим валом), підвішені на колонках і висячі (з верхнім підвісом головного валу). Горизонтальні центрифуги з ножовим зніманням осаду працюють періодичним способом, але оскільки в них можлива повна автоматизація всіх операцій, вони називаються автоматичними центрифугами.
За технологічним призначенням центрифуги розділяються на три типи: 1) освітлюючі – для очищення рідин від твердих домішок, 2) розділяючі – для розділення суспензій і емульсій, 3) концентруючі – для згущування суспензій шляхом відділення частини рідкої фази.
В даному технологічному процесі доцільним буде використання горизонтальної, автоматичної центрифуги.
Горизонтальна автоматична центрифуга (рис. 1.1) має дірчастий барабан 1, розташований між підшипниками горизонтального валу 3. Суспензія подається по трубі 3, введення і припинення подачі суспензії проводяться за допомогою клапана 4, роботою якого управляє гідравлічний (масляний) циліндр 5. Такий же циліндр приводить в дію ніж 6 для зняття осаду, масло поступає під поршень циліндра (під час підйому ножа) або зверху поршня (під час опускання ножа).
Головними перевагами такої центрифуги є: скорочення часу та повна автоматизація процесу.
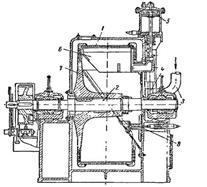
Рис. 5.1 Горизонтальна, автоматична центрифуга
5.3.3 Обгрунтування стадій осадження та розділення на фракції декстрану
Наступною стадією отримання ЕПС є стадія осадження декстрану. Даний процес можна здійснити за допомогою трьох осадників: метиловий та етиловий спирт, поліетиленгліколь. Вибір осадника залежить від того, де буде використовуватися продукт та як впливатиме осадник на декстран після осадження. В нашому випадку декстран використовується у якості замінника плазми крові, тому він повинен бути у першу чергу не токсичний [8, 20, 28, 29].
Якщо в якості осадника використовувати поліетиленгліколь, то в подальшому ми матимемо проблеми з очищенням фракцій ЕПС. Це збільшить час технологічного процесу та кількість коштів виділену підприємством на отримання даного продукту [22].
Метиловий спирт також негативно впливає на якість полісахариду, оскільки є надто токсичним, що унеможливлює використання декстрану в якості замінника плазми крові. Для того, щоб декстран був придатний до використання після осадження метиловим спиртом, необхідно проводити додаткові процеси його очищення [8].
Тому, найдоцільнішим буде використання етилового спирту. Хоч він є дорожчим, ніж метиловий спирт, але фінансові вклади в цьому випадку будуть нижчими, ніж під час додаткових процесів очистки ЕПС. Також він є менш токсичний і тому найкраще підходить для виробництва замінника крові [23, 24, 28].
Використання нативного декстрану без попередньої деструкції в фармакологічних препаратах, зокрема в плазмозамінниках крові, не представляється можливим.
Виходячи з цього є необхідним розділення декстрану на фракції, що включає два етапи:
1. Деструкція полісахариду;
2. Ультрафільтрація.
5.3.3.1 Обгрунтування вибору стадії деструкції
На виробництві плазмозамінників крові використовують низькомолекулярний декстран з молекулярною масою 30000-70000 кДа. Для цього нативний декстран піддають якого-небудь виду деструкції.
Відомі такі способи деструкції ЕПС:
· Кислотний гідроліз;
· Лужний гідроліз з Ɣ-опроміненням;
· Обробка електронами високих енергій;
· Термічна обробка.
Низькомолекулярний декстран, використовуваний на виробництві плазмозамінників крові, повинен відповідати ряду вимог:
· Молекулярна маса 30 000-70 000 кДа;
· Вузький молекулярно-масовий розподіл (ММР), щоб виключити вміст небажаних низькомолекулярних і високомолекулярних фракцій;
· Характеристична в’язкість водного розчину не повинна перевищувати значення 0,28-0,30.
Одним з технічних рішень є спосіб отримання низькомолекулярного декстрану шляхом опромінення сухого нативного декстрану електронами високих енергій. За вказаним способом розчин нативного декстрану попередньо висушують, а потім порошок в присутності лугу опромінюють електронами високих енергій [34].
Але в даному способі є ряд недоліків:
1. Відсутність повної гомогенності декстрану і лугу призводить до нерівномірності процесу деструкції, а це призводить до того, що кінцевий продукт (низькомолекулярний декстрин) має дуже широкий молекулярно-масовий розподіл;
2. Полідисперсність перевищує 10.
3. Внаслідок цього опромінений прискореними електронами декстран піддають спиртовому фракціонуванню. При цьому втрачається близько 30-40% декстрану, тобто вихід продукту, придатного для отримання плазмозамінника крові становить 60-70%.
4. Відсутні відомості про модифікацію низкомолекулярного декстрану.
5. Продукту, одержуваному за цим способом, притаманна інтенсивне жовто-коричневе забарвлення, яке знижують шляхом додаткової обробки розчину низкомолекулярного декстрану на сорбентах при нагріванні.
6. За вказаним способом для отримання низкомолекулярного декстрану з молекулярною масою 50000 кДа використовують дозу опромінення 800 кГр [34].
Ще одним способом розділення декстрану на фракції є лужний гідроліз з подальшим Ɣ-опроміненням [34].
Але недоліки цього методу не дають можливості його використання у даному технологічному процесі.
Недоліки методу:
1. Нерівномірність процесу деструкції;
2. Низькомолекулярний декстран має дуже широкий молекулярно-масовий розподіл;
3. Полідисперсність перевищує 10;
4. При цьому втрачається 30-40 % продукту;
5. Відсутні відомості про модифікацію низькомолекулярного декстрану;
6. Продукт набуває інтенсивного жовто-коричневого забарвлення, яке знижують за допомогою додаткових процесів очищення [34].
Найоптимальнішим рішенням буде використання соляної кислоти у якості деструктора (кислотний гідроліз). Метод кислотного гідролізу має переваги над тими, які описані вище:
ü Декстран має необхідний молекулярно-масовий розподіл;
ü Полідисперсність складає 2,3, що є необхідною нормою;
ü Втрати продукту складають менше 30 %;
Після деструкції ЕПС соляною кислотою, необхідно провести процес нейтралізації кислоти за допомогою гідрооксиду натрію задля отримання нейтрального значення рН (6,0-6,5) [33].
5.3.3.2 Обгрунтування стадії розділення декстрану на фракції
Після отримання розчину з фракціями декстрану різної молекулярної маси, необхідно провести процес їх розділення. В літературних даних представлені такі методи розділення декстрану на фракції: ультрафільтрація, використання активованого вугілля або катіонообмінних та аніонообмінних смол, застосування колонки Сефадекс С-15 [33].
Відомий спосіб очищення клінічних фракцій декстрану, заснований на застосуванні активованого вугілля, має ряд недоліків, що унеможливлює його використання у даному технологічному процесі.
Недоліки методу:
· Неможливість повністю очистити клінічні фракції від органічних домішок, що є причиною реактогенності кровозамінників;
· Втрати цільового продукту через незворотну сорбцію декстранів на вугіллі;
· Існує проблема освітлення сірих плівок;
· Випадання пластівчастого осаду в процесі зберігання препаратів за наявності мікрочастинок вугілля в готових лікарських формах;
· Процес багатостадійний та вимагає складного апаратурного оформлення [33].
Отримання низькомолекулярної фракції декстрану за допомогою колонки Сефадекс С-15 є економічно невигідним зважаючи на високу вартість. Дану установку можливо використовувати лише в лабораторних умовах [33].
Інші різновиди колонок, в тому числі і колонки з катіонообмінними та аніонообмінними смолами також можуть бути використані лише в лабораторних умовах.
Виходячи з цього, можна зробити висновок, що в технологічному процесі виробництва декстрану доцільним буде використання методу ультрафільтрації.
Ультрафільтрація - продавлювання рідини через напівпроникну мембрану — проникну для малих молекул і іонів, але непроникну для макромолекул і колоїдних часток. Промислове застосування технології ультрафільтрації - фракціонування макромолекул: великі молекули затримуються мембраною, в той час як невеликі молекули разом з молекулами розчинника вільно проходять через мембрану. Для підбору ультрафільтраційних мембран, виробники використовують концепцію молекулярної маси "відсікання" [51].
Перевагами даного методу є:
· Можливість проведення багатотоннажного процесу;
· Повна очистка і фракціонування готового продукту;
· Мінімальні фінансові затрати;
· Нескладне технологічне обладнання;
· Мінімальні затрати часу.
Для отримання низькомолекулярної фракції декстрану (40000-70000 кДа) будемо використовувати ультрафільтраційну установку «Амикон» DM 5 (США). Мембрани вироблені з поліелектролітного комплексу, робочий тиск 0,38 МПа [51].

Рис. 5.2 Ультрафільтраційна установка «Амикон» DM 5 (США)
 РОЗДІЛ 6
РОЗДІЛ 6
МАТЕРІАЛЬНИЙ БАЛАНС ТА ПРОДУКТОВИЙ РОЗРАХУНОК
Згідно з техніко-економічним обґрунтуванням і розрахунком потужності виробництва (див. розділ 3) кількість культуральної рідини, яку необхідно отримати за один цикл становить 6373 л. Реальний об’єм культуральної рідини буде вищим із врахуванням втрат на всіх етапах її одержання. А саме:
· отримання посівного матеріалу в інокуляторі–2%,
· отримання посівного матеріалу в посівному апараті 1–2%,
· отримання посівного матеріалу в великому посівному апараті — 3%,
· отримання посівного матеріалу у ферментері — 3%.
6.1 Матеріальний баланс на одну ферментацію (партію)
| № з/п | Використано | Отримано | ||||||||
| Назва сировини і напівпродукту | Кількість, кг/дм3 | Назва кінцевого продукту, відходів та втрат | Кількість, кг/дм3 | |||||||
| 1. | Приготування поживного середовища для інокулятора | |||||||||
| 1.2 | Сахароза | 1,89 | Поживне середовище (нестерильне) | 5,67 | ||||||
| 1.3 | Дріжджовий екстракт | 0,032 | ||||||||
| 1.4 | Пептон | 0,032 | ||||||||
| 1.5 | K2HPO4 | 0,095 | ||||||||
| 1.6 | NaCL | 0,00006 | ||||||||
| 1.7 | MgSO4×7H2O | 0,00006 | ||||||||
| 1.8 | MnCl2× H2O | 0,00006 | ||||||||
| 1.9 | CaCl2 | 0,00032 | ||||||||
| 1.10 | Вода | 3,62 | ||||||||
| 1.11 | Всього | 5,67 | Всього | 5,67 | ||||||
| Стерилізація поживного середовища в бутлях в автоклаві | ||||||||||
| 2.1 | Нестерильне поживне середовище | 5,67 | ПС стерилізоване в апараті | 6,3 | ||||||
| 2.2 | (Конденсат – 10% води) | 0,63 | ||||||||
| 2.3 | Всього | 6,3 | Всього | 6,3 | ||||||
| Отримання посівного матеріалу в інокуляторі | ||||||||||
| 3.1 | ПС стерилізоване в апараті | 6,3 | Посівний матеріал | 6,9 | ||||||
| 3.2 | Посівний матеріал з колб | 0,7 | ||||||||
| 3.3 | Втрати (частка) | 0,02 | Втрати (кількість) | 0,1 | ||||||
| 3.4 | Всього | Всього | ||||||||
| Приготування поживного середовища для посівного апарату 1 | ||||||||||
| 4.1 | Сахароза | 18,6 | Поживне середовище (нестерильне) | 55,8 | ||||||
| 4.2 | Дріжджовий екстракт | 0,31 | ||||||||
| 4.3 | Пептон | 0,31 | ||||||||
| 4.4 | K2HPO4 | 0,93 | ||||||||
| 4.5 | NaCL | 0,00062 | ||||||||
| 4.6 | MgSO4×7H2O | 0,00062 | ||||||||
| 4.7 | MnCl2× H2O | 0,00062 | ||||||||
| 4.8 | CaCl2 | 0,0031 | ||||||||
| 4.9 | Вода | 35,645 | ||||||||
| 4.10 | Всього | 55,8 | Всього | 55,8 | ||||||
| Стерилізація поживного середовища в посівному апараті 1 | ||||||||||
| 5.1 | Нестерильне поживне середовище | 55,8 | ПС стерилізоване в апараті | |||||||
| 5.2 | (Конденсат – 10% води) | 6,2 | ||||||||
| 5.3 | Всього | Всього | ||||||||
| Отримання посівного матеріалу в посівному апараті 1 | ||||||||||
| 6.1 | ПС стерилізоване в апараті | Посівний матеріал | 67,7 | |||||||
| 6.2 | Посівний матеріал малого посівного апарату 1 | 6,9 | ||||||||
| 6.3 | Втрати (частка) | 0,02 | Втрати (кількість) | 1,3 | ||||||
| 6.4 | Всього | Всього | ||||||||
| Приготування поживного середовища для посівного апарата 2 | ||||||||||
| 7.1 | Сахароза | 182,7 | Поживне середовище (нестерильне) | |||||||
| 7.2 | Дріжджовий екстракт | 3,045 | ||||||||
| 7.3 | Пептон | 3,045 | ||||||||
| 7.4 | K2HPO4 | 9,135 | ||||||||
| 7.5 | NaCL | 0,0061 | ||||||||
| 7.6 | MgSO4×7H2O | 0,0061 | ||||||||
| 7.7 | MnCl2× H2O | 0,0061 | ||||||||
| 7.8 | CaCl2 | 0,03 | ||||||||
| 7.9 | Вода | 350,03 | ||||||||
| 7.10 | Всього | Всього | ||||||||
| Стерилізація поживного середовища в посівному апараті 2 | ||||||||||
| 8.1 | Нестерильне поживне середовище | ПС стерилізоване в апараті | ||||||||
| 8.2 | (Конденсат – 10% води) | 60,9 | ||||||||
| 8.3 | Всього | Всього | ||||||||
| Отримання посівного матеріалу в посівному апараті 2 | ||||||||||
| 9.1 | ПС стерилізоване в апараті | Посівний матеріал | ||||||||
| 9.2 | Посівний матеріал з малого посівного апарату 2 | 67,7 | ||||||||
| 9.3 | Втрати (частка) | 0,03 | Втрати (кількість) | |||||||
| 9.4 | Всього | Всього | ||||||||
| Приготування поживного середовища для ферментера | ||||||||||
| 10.1 | Сахароза | 1773,9 | Поживне середовище (нестерильне) | 5321,7 | ||||||
| 10.2 | Дріжджовий екстракт | 29,565 | ||||||||
| 10.3 | Пептон | 29,565 | ||||||||
| 10.4 | K2HPO4 | 88,695 | ||||||||
| 10.5 | NaCL | 0,059 | ||||||||
| 10.6 | MgSO4×7H2O | 0,059 | ||||||||
| 10.7 | MnCl2× H2O | 0,059 | ||||||||
| 10.8 | CaCl2 | 0,296 | ||||||||
| 10.9 | Вода | 3399,5 | ||||||||
| 10.10 | Всього | 5321,7 | Всього | 5321,7 | ||||||
| Стерилізація поживного середовища в УБС | ||||||||||
| 11.1 | Нестерильне поживне середовище | 5321,7 | ПС стерилізоване в апараті | |||||||
| 11.2 | (Конденсат – 10% води) | 591,3 | ||||||||
| 11.3 | Всього | Всього | ||||||||
| Виробничий біосинтез | ||||||||||
| 12.1 | Стерильне поживне середовище | Культуральна рідина на центрифугування | ||||||||
| 12.2 | Посівний матеріал з посівного апарату | |||||||||
| 12.3 | Втрати (частка) | 0,03 | Втрати (кількість) | |||||||
| 12.4 | Всього | Всього | ||||||||
| 13. | Центрифугування культуральнї рідини | |||||||||
| 13.1. | Культуральна рідини на центрифгуування, л | Об'єм отриманого фільтрату | 5426,84 | |||||||
| 13.2. | Об'єм вологого осаду | 308,86 | ||||||||
| 13.3. | Втрати (частка) | 0,1 | Втрати (кількість) | 637,3 | ||||||
| Всього | Всього | |||||||||
| 14. | Концентрування розчину полісахариду ультрафільтацією | |||||||||
| 14.1. | Фільтрат зі стадії центрифугування | 5426,84 | Концентрат, л | 1269,62 | ||||||
| 14.2. | Пермеат, л | 3885,88 | ||||||||
| 14.3. | Втрати (частка) | 0,1 | Втрати (кількість) | 271,34 | ||||||
| Всього | 5426,84 | Всього | 5426,84 | |||||||
| 6.2 Продуктовий розрахунок | |||||||
| Вихідні дані для розрахунку: | |||||||
| Культура біологічного агенту – Leuconostoc mesenteroides PCSIR-4 | |||||||
| Річна потужність підприємства, кг/рік; | Gнт = | ||||||
| Кількість робочих днів у рік | Tрд = | ||||||
| Час виробничого циклу, год | Tц = | ||||||
| Концентрація біомаси в культуральній рідині, г/л | Хкр = | ||||||
| Концентрація полісахарида в культуральній рідині, г/л | Ркр = | 90.4 | |||||
| Вміст абсолютно сухих речовин в готовому продукті, частка (0,90...0,92) | СРгп = | 0,9 | |||||
| Коефіцієнт запасу (втрати культуральної рідини або посівного матеріалу від нестерильних операцій), 1,1; | K1 = | 1,1 | |||||
| Коефіціент заповнення ферментера, частка: | Kз = | 0,6 | |||||
| Коефіціент заповнення посівного апарата, частка | Kпа = | 0,6 | |||||
| Коефіціент заповнення інокулятора, частка | Kін = | 0,6 | |||||
| Коефіціент заповнення колб, частка | Kкол = | 0,2 | |||||
| Сумарні втрати активності пза цикл переробки культуральної рідини (сума всіх втрат по стадіям виділення готового продукту), частка | Eцп = | 0,41 | |||||
| Концентрація посівного матеріалу для виробничих ферментерів, частка (0,05-0,1) | Хвф = | 0,1 | |||||
| Концентрація посівного матеріалу для посівних апаратів, частка (0,02-0,1) | Хпа = | 0,1 | |||||
| Концентрація посівного матеріалу для інокуляторів, частка (0,02-0,1) | Хін = | 0,1 | |||||
| Концентрація посівного матеріалу для качалочних колб, частка (0,02-0,1) | Хкол=0.05 | 0,1 | |||||
| Втрати культуральної рідини при біосинтезі, частка (0,1- 0,2) | Еф = | 0,1 | |||||
| Втрати посівного матеріал при його культивуванні в посівних апаратах, частка (0,1- 0,2) | Епа = | 0,05 | |||||
| Втрати посівного матеріал при його культивуванні в інокуляторах, частка (0,1- 0,2) | Еін = | 0,05 | |||||
| Втрати посівного матеріал при його культивуванні в колбах, частка (0,01- 0,02) | Екол = | 0,01 | |||||
| CP1-6 частка абсолютно сухої речовини в компоненті | |||||||
| Склад поживного середовища для виробничого біосинтеза, г/л | |||||||
| Сахароза (0.9) | C1 = | 300,00 | |||||
| Дріжджовий екстракт (0.9) | C2 = | 5,00 | |||||
| Пептон (0.95) | C3 = | 5,00 | |||||
| K2HPO4 (СР2=0,98) | C4 = | 15,00 | |||||
| NaCl (СР6=0,95) MgSO4×7H2O(СР6=0,95) MnCl2× H2O (СР7=0,96) | C5 = C6 = C7= | 0,01 0,01 0,01 | |||||
| CaCl2(СР6=0,95) | C8= | 0,05 | |||||
| Разом: | CΣ = | 325,08 | |||||
| 1.Розрахунок кількості партій продукту (виробничих циклів) | |||||||
| 1.1. Кількість полісахариду на добу, кг /добу | |||||||
| Gнтд = Gнт/Трд | Gнтд = | 245,78 | |||||
| 1.2. Кількість продукту на добу у урахуванням втрат за виробничий цикл (Есв), кг | |||||||
| Gпд = Gнтд/(1-Ецп) | Gпд = | 409,64 | |||||
| 1.3. Кількість продукту за цикл кг/цикл | |||||||
| Gцк = Gпд*Тцф/24 | Gцк = | 443,77 | |||||
| 1.6. Кількість ферментацій (циклів) на рік | |||||||
| Nцк = Gнт/Gцк | Nцк = | 72,96 | |||||
| Приймаємо цілочисельне значення кількості циклів | Nцк= | ||||||
| 1.4.Об'єм КР, що зливається за одну ферментацію (цикл), м3 | |||||||
| Vкр = К1*Gцк /(СРст*Ркр) | Vкр = | 6,00 | |||||
| 1.8. Реальний вихід полісахарида у кг з 1 м3 культуральної рідини | |||||||
| qнат. = Gцк/Vкр | qнат = | 73,96 | |||||
| 2.1. Розрахунок об'ємів поживного середовища та посівного матеріалу виробничих ферментерів | |||||||
| 2.2.1. Об'єм готового поживного середовища та посівного матеріалу у виробничих ферментерах з врахуванням втрат при біосинтезі (Еф), л | |||||||
| Vф = Vкр/(1-Еф) | Vф = | 6666,6 | |||||
| 2.2.2. Витрати посівного матеріалу на засів виробничих ферментерів (Хвф), л | |||||||
| Vпмф = Vф · Хвф | Vпмф = | 666,6 | |||||
| 2.2.3. Об'єм готового поживного середовища для виробничих ферментерів, л | |||||||
| Vпсф = Vф - Vпмф | Vпсф= | ||||||
| 2.2. Розрахунок складу поживного середовища виробничих ферментерів | |||||||
| 2.2.1. У відповідності з прийнятим складом поживного середовища його витрати на Vф (л ) культуральної рідини складають, кг: | Gсрпс= | 361,22 | |||||
| 2.3.1. Розбавлення виробничого поживного середовища конденсатом пари при його стерилізаціїї в УБС, л, Ккон = 0,2 | |||||||
| Vфк = Vпсф ∙ Ккон | Vфк = | 1200,0 | |||||
| 2.3.2. Витрати води на приготування виробничого поживного середовища,з врахуванням конденсату пари при стерилізаціїї в УБС, л | |||||||
| Vвф = Vпсф - Gф - Vфк | Vвф = | 4400,9 | |||||
| 3.1. Розрахунок об'ємів поживного середовища та посівного матеріалу | |||||||
| 3.1.1.Об'єм готового поживного середовища та посівного матеріалу з врахуванням втрат при культивування в посівних апаратах (Епа), л | |||||||
| Vпа =Vпмф/(1-Епа) | Vпа = | 740,66 | |||||
| 3.1.2. Витрати посівного матеріалу на засів посівних апаратів (Хпа), л | |||||||
| Vпмп = Vпа*Xпа | Vпмп = | 74,06 | |||||
| 3.1.3. Об'єм готового поживного середовища для посівних апаратів, л | |||||||
| Vпсп = Vпа - Vпмп | Vпсп = | 666,6 | |||||
| 3.2. Розрахунок складу поживного середовища посівних апаратів | |||||||
| 3.2.1. У відповідності з прийнятим складом поживного середовища його витрати на Vпсп (л ) культуральної рідини складають, г: | |||||||
| Gпа =Vпсп∙ CΣ ,в тому числі: | Gпа = | 42006,67 | |||||
| Сахароза (0.9) | C1 = | 37895,04 | |||||
| Дріжджовий екстракт (0.9) | C2 = | 189,5 | |||||
| Пептон (0.95) | C3 = | 126,316 | |||||
| K2HPO4 (СР2=0,98) | C4 = | 189,47 | |||||
| NaCl (СР6=0,95) MgSO4×7H2O(СР6=0,95) MnCl2× H2O (СР7=0,96) | C5 = C6 = C7= | 126,316 315,79 6,32 | |||||
| CaCl2(СР6=0,95) | C8 = | 3157,92 | |||||
| Разом: | CΣ = | 42006,67 | |||||
| Вміст абсолютно сухих речовин в поживному середовищі посівного апарата, кг | |||||||
| Gсpпа = (G1*СР1+G2*СР2 + G3*СР3+ G4*СР4+ G5*СР5 + G6*СР6+ G7*СР7 + G8*СР8)/1000 | Gсpпа = | 38,02 | |||||
| 3.3.1. Розбавлення поживного середовища конденсатом пари при його стерилізаціїї в посівному апараті (Ккон = 15%), л | |||||||
| Vпак = Vпсп ∙ Ккон | Vпак = | 94,73 | |||||
| 3.3.2. Витрати води на приготування поживного середовища у посівних апаратах з врахуванням конденсату пари при стерилізаціїї, л | |||||||
| Vвпа = Vпсп - (Gпа /1000) - Vпак | Vвпа = | 494,85 | |||||
| 4.1. Розрахунок об'ємів поживного середовища та посівного матеріалу для інокулятора | |||||||
| 4.1.1. Об'єм готового поживного середовища та посівного матеріалу з врахуванням втрат при культивуванні в інокуляторі (Еін), л | |||||||
| Vін = Vпмп/(1-Еін) | Vін = | 73,87 | |||||
| 4.1.2. Витрати посівного матеріалу на засів інокулятора (Хін), л | |||||||
| Vінм = Vін·Xін | Vінм = | 7,387 | |||||
| 4.1.3. Об'єм готового поживного середовища для інокуляторів, л | |||||||
| Vпсін = Vін - Vінм | Vпсі = | 66,483 | |||||
| 4.2. Розрахунок складу поживного середовища інокулятора | |||||||
| 4.2.1. У відповідності з прийнятим складом поживного середовища його витрати на Vпсін (л ) культуральної рідини складають, г: | |||||||
| Gін =Vпсін ∙ CΣ, в тому числі: | Gін = | 4421,7 | |||||
| Меляса | C1 = | 3988,98 | |||||
| K2HPO4 (СР2=0,98) | C2 = | 19,9 | |||||
| CaHPO4 (СР3=0,95) | C3 = | 13,3 | |||||
| MgSO4 (СР4=0,95) | C4 = | 19,9 | |||||
| K2SO4 (СР5=0,96) NaCl (СР6=0,95) FeCl3 (СР7=0,96) | C5 = C6 = C7= | 13,3 33,24 0,66 | |||||
| CaCO3 (СР6=0,95) | C6 = | 332,415 | |||||
| Разом: | |||||||
| Загальна витрата компонентів поживного середовища, г | GΣ= | 4421,7 | |||||
| 4.3. Розрахунок кількості води для приготування поживного середовища інокуляторів | |||||||
| 4.4.1. Розбавлення поживного середовища конденсатом пари при його стерилізаціїї в інокуляторі (Ккон = 15%), л | |||||||
| Vінк = Vпсін∙Ккон | Vінк = | 9,97 | |||||
| 4.4.2. Витрати води на приготування поживного середовища в інокуляторах з врахуванням конденсату пари при стерилізаціїї, л | |||||||
| Vвін = Vпсін - (Gін/1000) - Vінк | Vвін = | 52,1 | |||||
| 5.1. Розрахунок об'ємів поживного середовища та посівного матеріалу для колб | |||||||
| 5.1.1. Об'єм готового поживного середовища та посівного матеріалу з врахуванням втрат при культивуванні в колбах, л | |||||||
| Vкол = Vінм/(1-Eкол) | Vкол = | 7,46 | |||||
| 5.1.2. Витрати посівного матеріалу на засів качалочних колб, л | |||||||
| Vколм = Vкол · Xкол | Vколм= | 0,746 | |||||
| 5.1.3. Об'єм готового поживного середовища для колб, л | |||||||
| Vпск = Vкол - Vколм | Vпск = | 6,714 | |||||
| 5.2. Розрахунок складу поживного середовища качалочних колб | |||||||
| 5.2.1. У відповідності з прийнятим складом поживного середовища його витрати на Vкол (л ) культуральної рідини складають, г: | |||||||
| Gкол =Vпск∙ CΣ , в тому числі: | Gкол = | 446,55 | |||||
| Меляса | C1 = | 402,84 | |||||
| K2HPO4 (СР2=0,98) | C2 = | 2,01 | |||||
| CaHPO4 (СР3=0,95) | C3 = | 1,34 | |||||
| MgSO4 (СР4=0,95) | C4 = | 2,01 | |||||
| K2SO4 (СР5=0,96) NaCl (СР6=0,95) FeCl3 (СР7=0,96) | C5 = C6 = C7= | 1,34 3,36 0,07 | |||||
| CaCO3 (СР6=0,95) | C6 = | 33,57 | |||||
| Загальна витрата компонентів поживного середовища, г | GΣ | 446,54 | |||||
| 5.3. Розрахунок кількості води для приготування поживного середовища качалочних колб, л | |||||||
| Vвк = Vпск - (GΣ /1000) | Vвк = | 6,27 | |||||
| 6. Кількість абсолютно сухих речовин в ферментері Gсрф до біосинтеза, кг | |||||||
| Gcpф = Gаспс + Gаспа | Gсрф= | 399,24 | |||||
| 7. Втрати абсолютно сухих речовин при біосинтезі Gвт (краплевинос), кг | |||||||
| Gвт=Gсрф · Еф | Gвт= | 39,924 | |||||
| 9. Витрати сухих речовин на на енергію біосинтезу (СРбс = 10…15%), кг | СРбс= | 0,13 | |||||
| Gбc = Gсрф · СРбс | Gбс = | 51,9 | |||||
| 10. Кількість абсолютно сухих речовин в культуральній рідині, що пішли на подальшу переробку, кг | |||||||
| Gсркр =Gсрф - (Gвт+Gбс) | Gсркр= | 307,416 | |||||
| Стадія ТП. Виділення, очищення та отримання готової продукціі | |||||||
| 11. Центрифугування культуральної рідини | |||||||
| 11.1. Об'єм суспензії, що йде на подальшу переробку складає, м3 | |||||||
| Vcус = Vкр | Vcус = | 5,99 | |||||
| 11.2. Відсоток асолютно сухої біомаси в суспензії складає, мас.% | |||||||
| CРасб=Xкр/10 | CРасб = | 0,58 | |||||
| 11.3. Вміст води в клітинах біомаси складає Wкл= 65-85 %, | Wкл= | 75,0 | |||||
| тоді відсоток вологої біомаси в суспензії буде, мас.% | |||||||
| СРвб =СРасб/(1-Wкл) | СРвб= | 2,32 | |||||
| 11.4. При густині осаду ρос = 1010…1100кг/м3 маса | ρос= | 1 050,0 | |||||
| абсолютно сухого осаду в Vсусскладає,кг | |||||||
| Gос = Vсус · Gбм · ρос | Gос = | 145,9 | |||||
| при вологості осаду Woc (частка), його маса в суспензії складе, кг | Woc = | 0,55 | |||||
| Gосв = Gос /(1- Woc) | Gосв = | 324,3 | |||||
| 11.5. Об'єм волого осаду в суспензії становить, л | |||||||
| Vосв = Gосв · 1000/ρос | Vосв = | 308,86 | |||||
| 11.6. Об'єм отриманого фільтрату з урахуваннямвтрат при фільтраціії, л | Ефт = | 0,1 | |||||
| Vфгм=(Vсус -Vосв) · (1-Ефт) | Vфгм= | ||||||
| 11.5. Маса абсолютно сухих речовин у фільтраті становить, кг | |||||||
| Gфт= (Gсркр - Gос) | Gфт = | 161,5 | |||||
| 11.6. Вміст сухих речовин у фільтраті становить, мас.% | |||||||
| СРф=Gфт · 100/Vфгм | СРф= | 3,16 | |||||
| 12. Концентрування розчину полісахарида методом ультрафільтрації | |||||||
| 12.1. Об'єм концентрата полісахарида при ступені концентрування Суф,л, та при втратах на концентруванні Еуф (5-8 %) становить | |||||||
| Eуф= | 0,05 | ||||||
| Vуф = Vфгм · (1-Еуф)/Суф | Vуф = | 971,47 | |||||
| 12.2. Маса абсолютно сухих речовин після концентрування з врахуванням втрат, кг | |||||||
| Gуф= Gфт · (1-Eуф) | Gуф= | 153,4 | |||||
| 12.3. Вміст сухих речовин в концентраті становить, мас.% | |||||||
| СРуф=Gуф · 100/Vуф | СРуф= | 15,79 | |||||
| 12.4. Вміст абсолютно сухого полісахарида в концентраті СРкон становить, частка, | СРкон= | 0,63 | |||||
| 12.5. Маса абсолютно сухого полісахарида в концентраті складає, кг | |||||||
| Gанб = Gуф*СРкон | Gанб = | 96,64 | |||||
| 12.6. Маса баластних речовин в пермеаті | |||||||
| Gбр = Gуф-Gанб | Gбр= | 56,758 | |||||
| 13. Сушіння концентрату | |||||||
| 13.1. Масса концентрату, що йде на сушіння, при його густині ρуф = 1050...1100 кг/м3, кг | Еуп= | Еуп= | |||||
| Gуф =Vуф · 1000/ ρуф | Gуф= | 925,2 | |||||
| 13.2. Кількість висушеного препарату з врахуванням втрат (10%) сухої речовини з повітрям, що виходить з сушарки, при стандартній вологості препарату Wгп = 1-СРгп =1-0,9 = 0,1 | Есш= | 0,05 | |||||
| Gcш = Gанб · (1-Есш)/СРгп | Gcш = | ||||||
| 13.3. Об'єм води, що підлягає видаленню, л | |||||||
| Wсш = Gуф*(1- Есш) - Gcш | Wсш = | 776,9 | |||||
| 14. Стадія ПМВ. Пакування, маркування, відвантаження | |||||||
| 14.1. Препарат розфасовують в полієтиленові пакети по 10 кг, а потім у картонні туби. Втрати при фасуванні складають Еуп=0,5… 1%. Кількість упаковано препарату, кг | Еуп= | 0,01 | |||||
| Gуп = Gcш*(1-Еуп) | Gуп= | 100,98 | |||||
| або кількість пакетів Nпк =Gуп/10 | Nпк = | 10,098 | |||||
| 14.2. Механічні втрати, кг | |||||||
|
|
|
|
|
Дата добавления: 2015-08-31; Просмотров: 1015; Нарушение авторских прав?; Мы поможем в написании вашей работы!