
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
В неполиризованных клетках белки и липиды, по-видимому, автоматически переносятся от ЭР и аппарата
8-41
8-38
8.8.7. Дефекты GlcNAc-фосфотранеферазы вызывают у человека лизосомные болезни накопления [59]
Лизосомные долети накопления сыграли решающую роль в раскрытии механизма сортировки лизосомных гидролаз. Эти болезни обусловлены генетическими нарушениями, в результате которых одна или несколько лизосомных гидролаз оказываются дефектными.
Нерасщепленный субстрат такой гидролазы накапливается в лизосомах, что и обусловливает патологию. Обычно такие болезни вызываются мутацией в структурном гене, кодирующем отдельную гидролазу. Наиболее тяжелые симптомы характеризуют редкую форму патологии, называемую 1-клеточной болезнью (inclusion cell disease). У таких больных в лизосомах фиброблас-тов отсутствуют почти все гидролитические ферменты, а соответствующие нерасщепленные субстраты накапливаются в клетках в виде крупных «включений». I-клеточная болезнь обусловлена рецессивной мутацией единственного гена. Это означает, что она проявляется только у людей, получивших дефектные копии гена от обоих родителей.
При изучении 1-клеточной болезни оказалось, что в лизосомах все гидролазы отсутствуют, но в крови они обнаруживаются. Из этого следует, что структурные гены, кодирующие их, не повреждены. Аномалия в данном случае вызвана нарушениями процесса сортировки в аппарате Гольджи, в результате чего гидролазы вместо того, чтобы поступать в лизосомы, секретируются. Неправильная сортировка происходит из-за повреждения или отсутствия GlcNAc-фосфотранеферазы. Лизосомные ферменты в таких клетках не фосфорилируются и маннозофос-фатный рецептор не может собрать их в окаймленные пузырьки в транссеги 1 ольджи. Вместо этого они доставляются к клеточной поверхности и секретируются. Те олигосахариды, которые у нормальных лизосомных ферментов содержали бы М6Ф, превращаются в олигосахариды «сложного»
типа, содержащие GlcNAc, галактозу и сиаловую кислоту. Это показывает, что в норме фосфорилирование маннозы в г^мс-компартменте Гольджи предотвращает последующий процессинг олигосахаридов гидролаз в сложные формы в промежуточном и ш/?«нокомпартментах Гольджи.
Интенсивные исследования биохимического механизма 1-клеточной болезни в конце 60-х гг. натолкнули на мысль о том, что все лизосомные ферменты имеют общий маркер. В конце 70-х гг. при сравнении гидролаз у нормальных и больных людей было установлено, что им является маннозо-6-фосфат. Вскоре после этого удалось выделить и очистить рецептор маннозо-6-фосфата, GlcNAc-фосфотрансферазу, кроме того была выяснена роль аппарата Гольджи в механизме сортировки лизосомных гидролаз.
При 1-клеточной болезни лизосомы в клетках некоторых типов, например, в гепатоцитах, содержат нормальный набор лизосомных
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
ферментов. Это означает, что существует и другой механизм, направляющий гидролазы в лизосомы, который используется в одних клетках и не используется в других. Природа этого М6Ф-иезависимого пути в настоящее время неизвестна. Возможно, в данном случае сортировка гидролаз происходит путем прямого узнавания их сигнальных участков. Подобный МбФ-независимый путь существует во всех клетках в транс-cети
Гольджи для сортировки лизосомных мембранных белков и направления их в эндолизосомы. Непонятно, почему клетке необходим более чем один способ построения лизосом.
Заключение
Лизосомы специализируются ни внутриклеточном расщеплении веществ. Они содержат уникальные мембранные делки и большое
количество разных гидролитических ферментов, которые лучше всего работают при кислых точениях рН (рН5), характерных для содержимого
лизосо.м. Кислый рН в лизосомах поддерживается при помощи АТР-зависимой протонной помпы в их мембранах. Вновь синтезированные белки
лизосом переносятся в полость ЭР, затем транспортируются через аппарат Гольджи и из транс-сети Голъджи с помощью транспортных
пузырьков доставляются в промежуточный компартмент (эндолизосому).
Лизосомные гидролазы содержат N-связанные олигосахариды, которые модифицируются в цис-компартменте Гольджи таким
образом, что их остатки маннозы фосфори.шруются. Эти маинозо-6-фосфатньк (М6Ф) группы узнаются в транс-сети Гольджи М6Ф-
рецептором, который отбирает гидролазы и помогает упаковывать их в отпочковывающиеся покрытые клатрином пузырьки. Транспортные
пузырьки, содержащие рецептор маннозо-6-фосфата. действуют подобно челнокам, доставляя рецептор от транс-сети Гольджи к
эндолизосомам и обратно. Низкий уровень рН в эндолизосомах вызывает диссоциацию комплекса лизосомной гидролазы и рецептора, делая
транспорт гидролаз однонаправленным.
8.9. Транспорт из аппарата Гольджи к секреторным пузырькам и к клеточной поверхности [60]
В норме от аппарата Гольджи непрерывным потоком отделяются транспортные пузырьки, предназначенные для немедленного слияния с плазматической мембраной. Трансмсмбранные белки и липиды пузырьков обеспечивают клеточную мембрану новыми белками и липидами, а растворимые белки пузырьков секретируются во внеклеточное пространство. Таким способом клетка производит, например, протеогликаны и белки внеклеточного матрикса (см. разд. 14.2).
Такая конститутивная секреция существует во всех типах клеток, но в специализированных секреторных клетках имеется еще один способ секреции, при котором растворимые белки и другие вещества сначала накапливаются в секреторных гранулах, а затем по сигналу высвобождаются позднее (так называемая переключаемая, или регулируемая секреция (рис. 8-76).
В данном разделе мы проанализируем роль аппарата Гольджи в этих двух типах секреции и сравним участвующие в их реализации механизмы. Мы рассмотрим также, каким образом вирусы используют сортировочный аппарат клетки-хозяина и чем вообще вирусные частицы могут быть полезны при выяснении различных путей транспорта веществ внутри клетки.
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
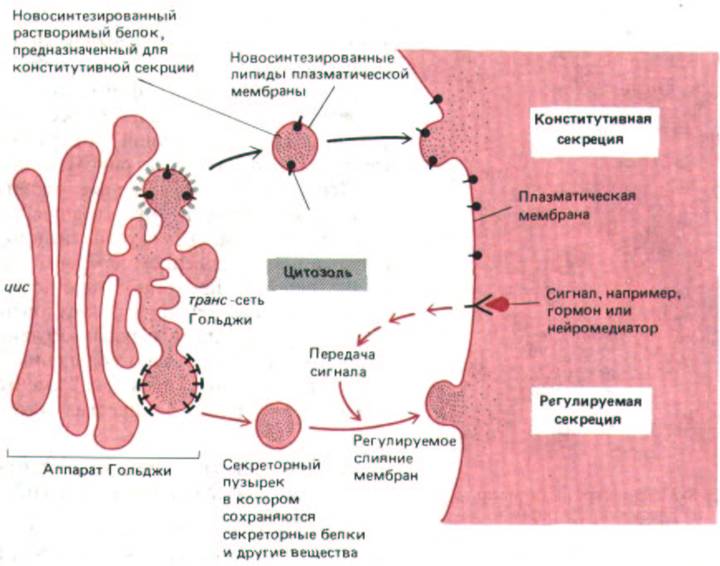
Рис. 8-76. Пути регулируемой и конститутивной секреции расходятся в транс-сети Гольджи. Многие растворимые белки непрерывно выводятся из" клетки по конститутивному секреторному пути, который существует во всех клетках. Этот же механизм снабжает плазматическую мембрану вновь синтезированными липидами и трансмембранными белками. Специализированные секреторные клетки имеют еше и регулируемый
секреторный механизм, с помощью которого определенные белки в транс-сети Гольджи направляются в секреторные пузырьки. В них белок концентрируется и хранится до тех пор, пока не будет получен внеклеточный сигнал, вызывающий их секрецию.
8.9.1. Секреторные пузырьки отпочковываются от транс -сети Гольджи [61]
В клетках, в которых секреция происходит в ответ на внеклеточный сигнал, секретируемые белки концентрируются и хранятся в секреторных пузырьках (их часто называют секреторными гранулами из-за темной сердцевины). При получении соответствующего сигнала они высвобождаются путем экзоцитоза. Секреторные пузырьки отпочковываются от транс-сети Гольджи. Полагают, что для их образования нужен клатрин и связанные с ним белки, создающие «кайму», потому что часть поверхности формирующихся пузырьков обычно покрыта клатрином. Эта кайма удаляется вскоре после того, как пузырек полностью сформируется (рис. 8-77).
Подобно лизосомным гидролазам, описанным в предыдущем разделе, белки, предназначенные для секреторных пузырьков (их часто называют секреторными белками) должны быть отобраны и упакованы в соответствующие пузырьки в транс -сети Гольджи. По-видимому, в этом случае происходит избирательная агрегация секреторных белков. Образовавшиеся агрегаты в электронном микроскопе выглядят как электроноплотный материал в транс-сети Гольджи. «Сигнал сортировки», направляющий белок к таким агрегатам, неизвестен, но, видимо, это сигнальный участок, общий для многих секреторных белков. Гакой вывод подтверждается следующими данными: если ген, кодирующий секреторный белок, перенести в секреторную клетку другого типа, в норме не синтезирующую данный белок, то чужой белок будет также упаковываться в секреторные пузырьки.
Неизвестно, каким образом при образовании секреторных пузырьков отбираются агрегаты, содержащие секреторные белки. Секреторные пузырьки имеют уникальные мембранные белки, часть из которых может служить рецепторами (в транс-сети Гольджи) для связывания агрегированного материала, подлежащего упаковке. Заметим, что секреторные пузырьки больше транспортных пузырьков, переносящих ли-
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
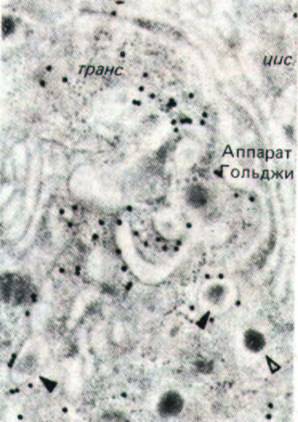
Рис. 8-77. Электронная микрофотография секреторных пузырьков, образующихся из транс-сети Гольджи в клетках поджелудочной железы, секретирующих инсулин. Для локализации молекул клатрина были использованы антитела, конъюгированные с частицами коллоидного золота (черные точки}. Незрелые секреторные пузырьки (черные стрелки), содержащие молекулы проинсулина, покрыты клатрином. Как только пузырек сформируется, клатриновая кайма быстро сбрасывается, и в зрелых секреторных пузырьках (светлые стрелки) она отсутствует.
(Микрофотография любезно предоставлена Lelio Orel.)
зосомные тидролазы, и агрегаты, которые в них содержатся, слишком велики для того, чтобы каждая молекула секретируемого белка могла связаться с рецептором в мембране пузырька, как это происходит при транспорте лизосомных ферментов (см. рис. 8-73). Захват этих агрегатов секреторными гранулами скорее напоминает поглощение частиц при фагоцитозе на клеточной поверхности, которое также происходит с участием покрытых клатрином мембран.
После того, как незрелые секреторные пузырьки отпочкуются от транс-сети Гольджи, они утрачивают кайму, и их содержимое сильно концентрируется. Такая конденсация происходит резко и, возможно, вызывается закислением среды в полости пузырька за счет работы АТР-
зависимой протонной помпы в его мембране. Агрегация секретируемых белков (или других компонентов) и последующая их конденсация в секреторных пузырьках обусловливает увеличение концентрации этих белков в 200 раз по сравнению с аппаратом Гольджи. Благодаря этому секреторные пузырьки имеют возможность высвобождать по «команде» большие количества материала.
8.9.2. Компоненты мембраны секреторных пузырьков используются вторично [62]
Многие секреторные клетки, такие, как ацинарные клетки поджелудочной железы, поляризованы, и экзоцитоз протекает только на их апикальной поверхности. Апикальная часть клеток обращена обычно в просвет системы протоков, собирающей секрет. Когда секреторный пузырек сливается с плазматической мембраной, его содержимое выбрасывается из клетки путем экзоцитоза, а мембрана становится частью плазматической мембраны (см. разд. 6.5.1). Это должно было бы сильно увеличивать поверхность плазматической мембраны. В действительности такое увеличение возникает очень ненадолго, потому что участки мембраны удаляются с поверхности путем эндоцитоза (или рециркулируют) почти с той же скоростью, с которой они добавляются при, экзоцитозе (рис. 8-78). Очевидно, что при таком удалении мембранные белки секреторных пузырьков возвращаются в аппарат Гольджи, где
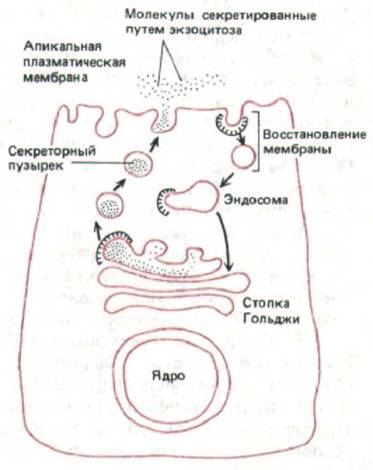
Рис. 8-78. После того, как секреторный пузырек сольется с плазматической мембраной в апикальной части клетки, его мембрана возвращается в круговорот. Количество мембран, добавляемых к плазматической мембране в процессе регулируемой секреции, может быть огромным. Но из нее все время образуются и возвращаются в транс-сеть Гольджи (возможно, через эндосомы) клатриновые окаймленные пузырьки; за счет этого поддерживается постоянная площадь апикальной поверхности клетки.
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
они могут быть использованы вторично. Рециркуляция обеспечивает постоянное распределение компонентов мембран между различными клеточными компартментами.
Гольджи к клеточной поверхности [63]
В клетках, способных к регулируемой секреции, белки, перед тем, как покинуть транс-сеть Гольджи, должны быть рассортированы по крайней мере на три группы. Первая из них включает белки, предназначенные для эндолизосом; вторая - белки, предназначенные для секреторных пузырьков, и наконец, в третью группу входят белки, которые прямо добавляются к клеточной поверхности. Белки, направляющиеся в эндолизосомы, отбираются для упаковки в пузырьки по сигналу (для лизосомных гидролаз им служит МбФ); каждый белок, поступающий в секреторные пузырьки, также должен иметь специальный сигнал. Возможно, белки третьей группы транспортируются к поверхности клетки «неизбирательным» образом (рис. 8-79). Существует гипотеза, согласно которой в неполяризованных клетках (к ним относятся лейкоциты и большинство культивируемых клеток) любой белок из ЭР, если он не будет оставлен в качестве постоянного компонента этой органеллы, аппарата Гольджи или отобран для специфичного транспорта, будет автоматически переноситься к клеточной поверхности. Привлекательность этой гипотезы состоит в ее простоте и в том, что она объясняет, каким образом поврежденные или неправильно адресованные белки выводятся из клетки.
Была предпринята попытка экспериментально проверить возможность такого неизбирательного «поточного» транспорта к плазматической мембране. Для этого клетки в культуре инкубировали с простым трипептидом (Asn-Tyr-Thr), содержащим сигнал гликозилирования Asn-X-Thr. Этот маленький пептид может проникать в клетки и через внутриклеточные мембраны; в полости ЭР он гликозилируется по аспарагиновому остатку. Добавление N-связанного олигосахарида предотвращает обратную диффузию данного трипептида в цитозоль. Вместо этого он транспортируется в одном направлении из ЭР в аппарат Гольджи и затем к клеточной мембране. Это происходит примерно за 10 минут, что совпадает со скоростью транспорта наиболее «быстрых» белков плазматической мембраны. Полученный результат согласуется
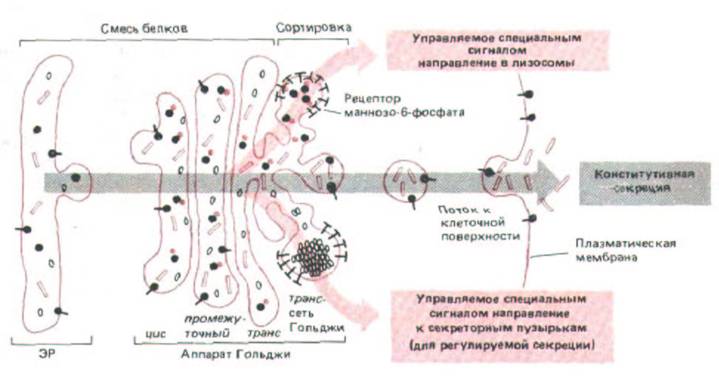
Рис. 8-79. Наиболее хорошо изученные пути сортировки белков в транс -сети Гольджи. Белки с ман-нозо-6-фосфатным маркером направляются в лизосомы (через эндолизосомы) в составе клатрино-вых окаймленных пузырьков (см. рис. 8-72). Белки, предназначенные для секреции, концентрируются в больших, покрытых клатрином окаймленных пузырьках, которые, утратив кайму, превращаются в секреторные пузырьки - путь, существующий только в специализированных секреторных клетках. Полагают, что в неполяризованных клетках белки, не имеющие специальных сигналов, направляются к поверхности клетки «по умолчанию» в процессе конститутивной секреции. В поляризованных клетках секретируемые белки и белки плазматической мемраны направляются избирательно к апикальной или базолатеральной части плазматической мембраны, и поэтому хотя бы один из этих потоков должен регулироваться специфическими сигналами.
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
с гипотезой о том, что существует неизбирательный поток жидкости, заполняющей полость органелл. который автоматически доставляет любую растворимую молекулу из ЭР к клеточной поверхности (если только она не остается в органелле или не направляется по сигналу куда-либо еще).
В принципе тот же неизбирательный поток может доставлять к клеточной поверхности трансмембранные белки и липиды, которые утратили сигналы сортировки. Он может также переносить белки, предназначенные для секреторных пузырьков, от ЭР к концу аппарата Гольд-жи.
ведь специфические сигналы, отличающие эти белки от белков, направляющихся к плазматической мембране, требуются только в транс-сети
Гольджи. Возможно, для того, чтобы белок остался в ЭР или аппарате Гольджи. необходим специальный механизм сортировки (см. разд. 8.1.5).
Полученные недавно данные о том. что некоторые постоянные белки ЭР (включая В.Р и протеиндисульфидизомеразу) содержат сигнальный пептид, ответственный за их пребывание в ЭР (см. разд. 8.1.7). подтверждают этот общий взгляд на транспорт белков внутри клетки.
Некоторые конститутивно секретируемые белки затрачивают много времени, чтобы покинуть ЭР и секретироваться. Чтобы увязать эти данные с гипотезой неизбирательного потока, предположили, что таким белкам необходимо время, чтобы правильно свернуться, и поэтому они долго удерживаются в ЭР либо за счет того, что пронизывают мембрану ЭР, либо за счет связи со специальными белками типа В.Р. Как только они свернутся правильным образом, эти белки тоже попадают в неизбирательный поток.
|
|
Дата добавления: 2015-08-31; Просмотров: 1631; Нарушение авторских прав?; Мы поможем в написании вашей работы!