
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Внеклеточному пространству
|
|
|
|
Поскольку олигосахаридные цепи присоединяются со стороны внутреннего пространства ЭР и аппарата Гольджи, расположение углеводов на мембранных белках и липидах несимметрично. Как и асимметрия самого липидного бислоя, эта асимметричная ориентация гликозилированных молекул сохраняется в процессе транспорта к плазматической мембране, секреторным пузырькам или лизосомам. В результате олигосахариды всех гликопротеинов и гликолипидов в соответствующих клеточных мембранах обращены в просвет органелл, а в плазматической мембране - во внеклеточное пространство (рис. 8-64).
8.7.3. Зачем нужно N-гликозилирование? [49]
Существует важное различие между синтезом молекул олигосахаридов и других макромолекул, таких, как ДНК, РНК и белки.
Нуклеиновые кислоты и белки копируются с матрицы путем многократного повторения одинаковых этапов, при этом используется один и тот же фермент (или ферменты). Сложные углеводы нуждаются в различных ферментах на разных этапах синтеза, и продукт каждой реакции узнается в качестве субстрата для следующей. Учитывая сложность биохимических механизмов, которые выработались в процессе эволюции для синтеза олигосахаридов, можно предположить, что эти соединения выполняют
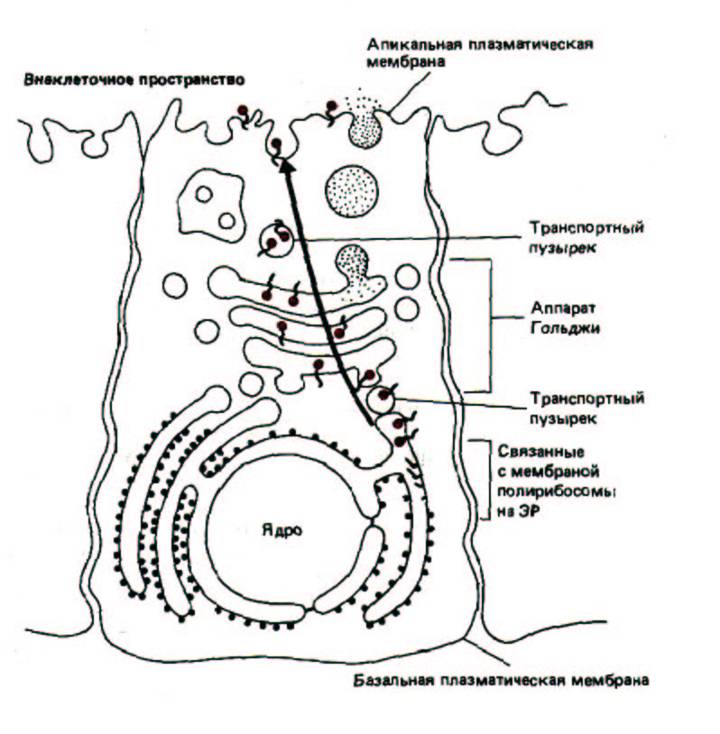
Рис. 8-64. Ориентация трансмембранного белка в мембране ЭР сохраняется при транспорте его к другим мембранам. Черные кружки на конце каждой молекулы гликопротеина обозначают N-связанный олигосахарид, который присоединяется к белкам в просвете (полости) ЭР.
Обратите внимание, что эти остатки Сахаров находятся только в просвете внутренних органелл, а после того, как транспортный пузырек сольется с плазматической мембраной, они оказываются обращенными во внеклеточное пространство.
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
важные функции, однако большая часть этих функций пока неизвестна.
К примеру, N-гликозилирование преобладает у всех эукариот, включая дрожжи, но отсутствует у эубактерий. Поскольку у большинства белков, переносимых через ЭР и аппарат Гольджи, имеется один или более N-связанных олигосахаридов (а процесс переноса специфичен для клеток эукариот), было выдвинуто предположение, что эти олигосахариды участвуют в транспорте. Однако оказалось, что препараты, блокирующие некоторые стадии гликозилирования (табл. 8-4), в общем не влияют на транспорт (имеется, правда, одно важное исключение -
транспорт в лизосомы, который мы обсудим ниже - см. разд. 8.8). Мутантные культивируемые клетки, у которых гликозилирование в аппарате Гольджи блокировано на разных стадиях, тем не менее жизнеспособны, и транспорт белков протекает у них нормально. Установлено, что некоторые белки без «своих» олигосахаридов не могут правильно свернуться, в результате они преципитируют в ЭР и становятся неспособными к транспорту, однако большинство белков сохраняет нормальную активность и без гликозилирования.
Поскольку цепочки сахаров имеют ограниченную гибкость, даже небольшой N-связанный олигосахарид выдается над поверхностью гликопротеина (рис. 8-65), и может, таким образом, ограничивать присоединение других макромолекул к поверхности этого гликопротеина. В результате присутствие олигосахарида в некоторых случаях обусловливает относительную устойчивость гликопротеина к действию протеаз.
Возможно, олигосахариды обеспечивали предковой эукариотической клетке защитную оболочку, которая, в отличие от жесткой клеточной стенки бактерий, позволяла ей изменять форму и двигаться. С тех пор олигосахариды могли модифицироваться для выполнения и других функций.
8.7.4. В аппарате Гольджи происходит сборка протеогликанов [50]
В процессе переноса белков из ЭР к местам конечного назначения через аппарат Гольджи изменяются не только N-связанные олигосахариды; многие белки модифицируются и другими способами. Например, как отмечалось выше, у некоторых белков сахара присоединяются к боковым цепям определенных остатков серина или треонина. Такое О-связанное гликозилирование, как и наращивание цепей N-
связанных олигосахаридов, катализируется гликозилтрансферазами. Эти ферменты добавляют к белку по одному сахару, используя в качестве субстрата нуклеотид-сахара, содержащиеся в полостях аппарата Гольджи. Обычно первым присоединяется N-ацетилгалактозамин, а за ним следует различное количество дополнительных остатков Сахаров, от нескольких до 10 и более.
Наиболее сильно гликолизируется протеогликановые коровые белки, которые в аппарате Гольджи модифицируются с образованием протеогликанов. Этот процесс включает полимеризацию одной или более цепей гликозаминогликанов (длинных неразветвленных полимеров, состоящих из повторяющихся дисахаридных единиц) с серинами корового белка. Судьба протеогликанов различна: одни из них секретируются в качестве компонентов внеклеточного матрикса, а другие остаются погруженными в плазматическую мембрану. Кроме того, протеогликаны составляют основу слизи, которая образует защитное покрытие множества эпителиев.
Сахара, входящие в состав гликозаминогликанов, сразу же после их полимеризации в аппарате Гольджи сильно сульфатируются, что придает протеогликанам отрицательный заряд. Сульфат переносится от
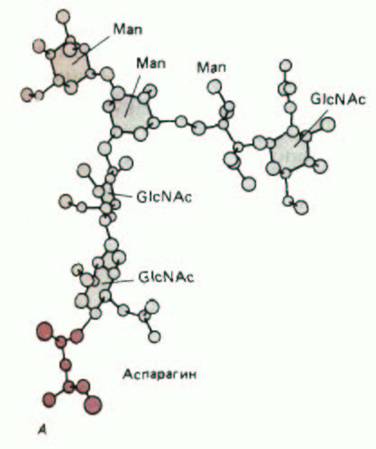

Рис. 8-65. Трехмерная структура небольшого N-связанного олигосахарида, определенная с помощью рентгеноструктурного анализа гликопротеина. Этот олигосахарид содержит всего 6 остатков Сахаров, тогда как в N-связанном олигосахариде, первоначально присоединенном к белку в ЭР, содержится 14 остатков сахаров (см. рис. 8-52). А. Шаростержневая модель, изображающая все атомы, кроме водородных; Б.
пространственная модель, темные атомы - остаток аспарагина. (С любезного разрешения Richard Feldman.)
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
активированного донора сульфатов 3'-фосфоаденозин-5'-фосфосульфата (PAPS), который поступает из цитозоля в аппарат Гольджи. Самая тонкая модификация, происходящая в этой органелле, - присоединение сульфата, взятого от PAPS, к гидроксильной группе определенных остатков тирозина в белках. Сульфатированные тирозины характерны для секретируемых белков, но иногда встречаются и у белков плазматической мембраны (в их обращенных во внеклеточное пространство доменах).
8.7.5. При образовании секреторных пузырьков белки часто подвергаются протеолизу [51]
Наиболее радикальная модификация, которой подвергаются белки перед секрецией, происходит в последнюю очередь. Многие полипептидные гормоны и нейропептиды синтезируются в форме неактивного белка-предшественника, из которого затем в результате протеолиза образуется активная молекула. Полагают, что это расщепление начинается в транс-сети Голъджи и продолжается в секреторных пузырьках.
Сначала связанная с мембраной протеаза расщепляет белок по связям основных аминокислот (Lys-Arg, Lys-Lys, Arg-Lys, или Arg-Arg), после чего происходит окончательная «доделка» секретируемого продукта (рис. 8-66). В простейшем случае полипептид часто имеет только один N-концевой про-участок, который отщепляется с образованием зрелого белка незадолго до секреции. Следовательно, такие белки синтезируются в виде пре-
про-белков, у которых пре-часть является сигнальным пептидом ЭР, удаляемым в шероховатом ЭР. В более сложном случае пептидные молекулы синтезируются в виде полипротеинов, содержащих множество копий одной и той же аминокислотной последовательности (см. рис. 8-66). И наконец, в клетке существуют пептиды, выступающие в роли предшественников для множества различных конечных продуктов. Эти конечные продукты по одному отщепляются от исходной полипептидной цепи. В разных типах клеток одни и те же полипротеины могут расщепляться, различным образом, увеличивая тем самым разнообразие молекул, участвующих в химической передаче сигнала между клетками.
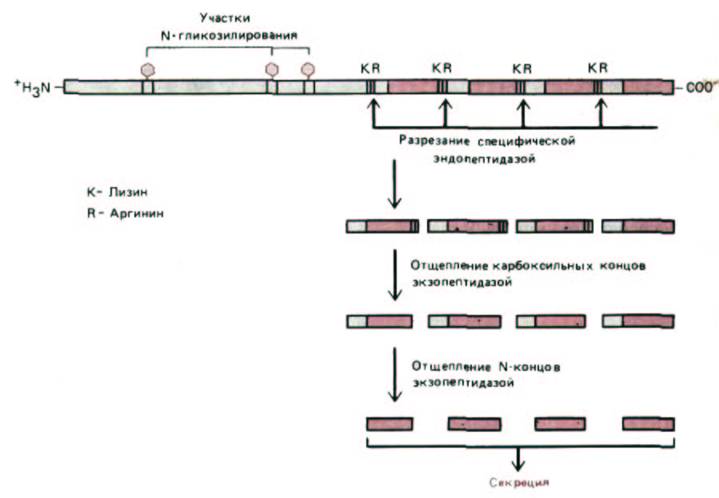
Рис. 8-66. Пример полипротеина, который разрезается с образованием множества копий одной и той же молекулы сигнального пептида. Обычно процессинг начинается с разрезания по парам основных аминокислот (здесь пары Lys-Arg), катализируемого специфической связанной с мембраной протеазой, расположенной в секреторных пузырьках или в транс-сети Гольджи. Здесь показан механизм процессинга, при котором образуется 13-ами-нокислотный пептид-α-фактор дрожжей Saccharomyces cerevisiae. Это секретируемый пептид, который регулирует у дрожжей половой процесс. (По R. Fuller, A. Brake, and J. Thorner, in Microbiology 1986 [L. Lieve, ed.], pp. 273-278. Washington, D. C: American Society for Microbiology, 1986.)
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
Почему для столь большого количества полипептидов характерен такой «задержанный» протеолиз? Возможно многие из них, например, энкефалины (нейропептиды, состоящие из пяти аминокислот), слишком коротки, чтобы их можно было эффективно синтезировать на рибосомах, ведь известно, что даже более длинные пептиды иногда утрачивают сигналы, необходимые для упаковки в секреторные пузырьки. Кроме того, задержка образования активного продукта до того момента, как он попадает в секреторный пузырек, может предотвращать действие данного продукта внутри клетки.
|
|
|
|
|
Дата добавления: 2015-08-31; Просмотров: 614; Нарушение авторских прав?; Мы поможем в написании вашей работы!