
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Изменения мРНК при талассемии демонстрируют механизм возникновения новых белков при сплайсинге 3 страница
|
|
|
|
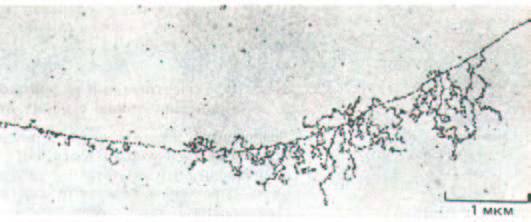
Рис. 9-72. Необычная область хроматина, в которой один из генов транскрибируется с высокой частотой; хорошо видно большое число молекул РНК-полимеразы II вместе с растущими цепями РНК-транскриптов. Транскрипция направлена слева направо (см. рис. 9-73). По V. Е. Foe, Z. Е. Wilkinson and CD. Zaird, Cell 9: 131-146. © 1976 Cell Press.)

Рис. 9-73. Схематическое изображение идеальной транскрипционной единицы, показывающее, как на основе электронномикроскопических данных можно определить направление синтеза цепи РНК и идентифицировать сайты начала и конца этой единицы.
polyT-связанным матриксом, молекулы с роlуА-„хвостом" будут избирательно задерживаться на такой колонке вследствие комплементарного спаривания Т и А. Этот метод широко используется для отделения гяРНК и мРНК от молекул рибосомной и транспортной РНК, составляющих основную массу РНК клетки.
9.4.6. Для кэпирования и добавления polyA требуется РНК-полимераза II [47]
5'-Кэпы и 3'-ро1уА-последовательности имеются только в тех молекулах, которые транскрибированы РНК-полимеразой II. Методы генетической инженерии сегодня позволяют отделить ген, транскрибируемый в норме РНК-полимеразой II, от своего промотора и поставить под промотор, узнаваемый РНК-полимеразами I или III. Оказалось, что если такой модифицированный ген вновь ввести в клетку, то он будет транскрибироваться одной из этих полимераз, но при этом вновь синтезированные молекулы РНК не будут ни кэпированы, ни полиаденилированы.
Следовательно, и кэпирование, и полиаденилирование осуществляются с участием ферментов, которые избирательно связываются с РНК-
полимеразой II и активны лишь в комплексе с ней. Такие ферменты можно рассматривать как факторы элонгации РНК-полимеразы II. Вероятно, именно необходимость кэпировать и полиаденилировать предшествен-
| Таблица 9-2. Популяция молекул мРНК в типичной клетке млекопитающих | |||||
| Класс | Общее число копий каждой индивидуальной последовательности мРНК на клетку | Число индивидуальных последовательностей мРНК в каждом классе | Общее число молекул мРНК в каждом классе | ||
| Богатый | X | = | |||
| Средний | X | = | |||
| Бедный | X | 1 1000 | = | ||
| Подобное деление клеточной мРНК на три дискретных класса в известной степени искусственное: в ряде случаев наблюдается более плавное распределение различных молекул мРНК в соответствии с их содержанием в клетке. В сумме в каждой нормальной клетке насчитывается от 10000 до 20000 разных видов мРНК, большинство из которых представлено малым числом копий (от 5 до 15 молекул на одну клетку). Обычно общая цитоплазм этическая РНК представлена в основном рРНК, а на долю мРНК остается всего лишь от 3 до 5%, так что на одну молекулу мРНК приходится примерно 10 рибосом. Клетка данного типа содержит в сумме около 360 000 молекул цитоплазматической мРНК. |
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
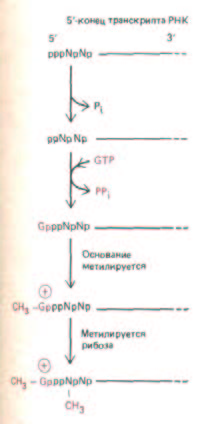
Рис. 9-74. Кэпирование 5'-концов молекул РНК, синтезированных РНК-полимеразой II. Присоединенный кэп содержит новую связь 5' →•
5' между положительно заряженным остатком 7-метил-G- и исходным 5'-коицом транскрипта РНК (см. рис. 5-24). Полагают, что по крайней мере некоторые ферменты, участвующие в этом процессе, связаны с полимеразой II, так как транскрипты, образуемые полимеразами I и II не кэпируются. Буквой N обозначается любой из четырех рибонуклеотидов, хотя цепь РНК обычно начинается с пурина (А или G). (По A, J. Shatkin, Bioessays 7: 275-277, 1987.)
ники мРНК можно объяснить, почему у эукариот эти молекулы синтезируются специальной РНК-полимеразой.
О том, что для реакции разрезания и полиаденилирования, по-видимому, необходим фактор элонгации, связанный с РНК-полимеразой, свидетельствовали следующие факты. В нескольких работах было показано, что каждая транскрибирующая молекула РНК-полимеразы II способна образовать только один полиаденилированный З'-конец, т. е. все сигналы AAUAAA, встречаемые полимеразой после первого такого сайта, игнорируются. Это дает основание для гипотезы, что полимераза содержит фактор, который после завершения реакций разрезания и полиаденилирования, теряется (рис. 9-75).
9.4.7. Большая часть РНК, синтезированной РНК-полимеразой II, в ядре быстро распадается [48]
Первые данные о нестабильности в ядре транскриптов, синтезированных РНК-полимеразой II, были получены в опытах на культуре клеток. В среду для культивирования на короткое время вводили [3Н]-уридин. При этом радиоактивная метка включается в молекулы гяРНК, за

Рис. 9-75. Синтез молекулы гяРНК (предшественника мРНК) с помощью РНК-полимеразы II. Полимераза на рисунке только начала синтез цепи РНК (стадия 5, рис. 9-65). Узнавание дополнительного сигнала полиаденилирования на растущем транскрипте РНК приводит к разрыву и полиаденили-рованию цепи. У дрожжей полимераза сразу же после этого заканчивает синтез РНК, однако у высших эукариот транскрипция часто продолжается. Представляется вероятным, что свойства полимеразы меняются, как только происходит расщепление одной цепи РНК; таким образом, полимераза не может участвовать в полиаденили-ровании транскриптов, считываемых после этого. Весьма возможно, что в таком виде полимераза лучше распознает последовательности, определяющие терминацию и высвобождение полимеразы. Самое простое объяснение, представленное на этом рисунке, заключается в том, что после разрезания транскрипта от полимеразы отделяется фактор (или факторы) элонгации.
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
| Таблица 9-3. Содержание различных видов РНК в типичной клетке млекопитающих. | ||
| Относительное содержание каждого вида РНК (в % от всей клеточной РНК) | «Удельный вес» биосинтеза каждого вида РНК, % | |
Ядерные предшественники рРНК 
| ||
| Цитоплазматические рРНК | _ | |
Гетерогенная ядерная РНК 
| ||
| Цитоплазматическая мРНК | - | |
| Низкомолекулярные стабильные РНК (главным образом тРНК) |
Приведенные данные получены на основе анализа культивируемых фибробластов мыши (L-клетки). Каждая такая клетка содержит 26 пг РНК (5 х 1010 рибонуклеотидов), причем 14% этого количества находится в ядре. (Таким образом, ядро клетки содержит вдвое больше ДНК, чем РНК.) Это приблизительно в 20 раз превышает среднюю скорость синтеза ДНК в S-фазе. Следует подчеркнуть, что хотя гяРНК составляет большую часть всей синтезируемой в клетке РНК, лишь очень небольшое ее количество избегает деградации в ходе ядерного процессинга РНК. Поэтому образующаяся из гяРНК мРНК представляет собой минорную фракцию клеточной РНК {по Brandhorst В. P., McConkey Е. Н. J. Моl. Biol. 85; 451-
563, 1974)
судьбой которых затем можно следить в течение более длительного времени. Эти эксперименты позволили сформулировать два важных вывода.
1. Длина вновь синтезированных молекул гяРНК быстро уменьшается, достигая размеров цитоплазматической РНК примерно за 30
минут. Первичные транскрипты РНК содержат в среднем около 6000 нуклеотидов, тогда как длина молекул мРНК составляет приблизительно 1500
нуклеотидов.
2. Примерно через 30 минут радиоактивно меченные молекулы РНК начинают покидать ядро в виде молекул мРНК. Однако всего лишь около 5% всей меченой гяРНК достигает цитоплазмы клетки. Оставшиеся молекулы примерно в течение часа распадаются в ядре на маленькие фрагменты.
Когда в начале 70-х гг. было обнаружено, что и мРНК, и гяРНК на З'-конце содержат polyA, естественно было предположить, что мРНК образуется путем значительной деградации гяРНК на 5'-концах, другими словами, что молекулы гяРНК состоят из очень длинной «5'-лидер-ной последовательности», расположенной перед кодирующей частью. Однако от этой гипотезы пришлось отказаться, когда на 5'-конце были обнаружены кэпы, которые, как выяснилось, при превращении молекул гяРНК в мРНК по большей части сохраняются. По-видимому, уже тогда можно было догадаться о том, что удаляется середина молекулы РНК, а ее 3'- и 5'-концы остаются интактными. Но в то время такое предположение сочли бы абсурдным. Более того, исследователи терялись в догадках, почему клетка должна избавляться от большей части вновь синтезированной РНК. Эта загадка была разгадана лишь тогда, когда стало возможным сравнивать нуклеотидную последовательность отдельной молекулы мРНК с последовательностью кодирующей ее геномной ДНК.
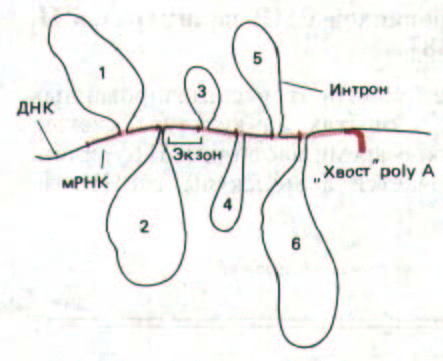
Рис. 9-76. Первые данные, свидетельствующие о существовании интронов в генах эукариот, получены при использовании метода «R-
петель». Комплекс, содержащий спаренные основания молекул мРНК и ДНК, визуализировали с помощью электронного микроскопа. Молекулы мРНК, содержащиеся в очень больших количествах, такие, как мРНК р-глобина или овальбумина, легко выделить из синтезирующих их специализированных клеток. При гибридизации таких препаратов одноцепочечной мРНК с клонированной двухцепочечной ДНК, которая содержит ген, кодирующий эту мРНК, РНК может заместить ДНК на участке гомологии с образованием спирали РНК-ДНК. Области, в которых спаривания не произошло, хорошо различимы: они выглядят как большие петли. Каждая из этих петель, пронумерованных от 1 до 6, представляет собой интрон, входящий в состав последовательности гена.
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
9.4.8. В ходе процессинга РНК из середины молекулы удаляются длинные последовательности нуклеотидов [48]
Открытие в 1977 г. прерывистых генов было совершенно неожиданным. Предшествовавшее этому событию многолетнее изучение бактерий привело исследователей к выводу, что гены состоят из непрерывных последовательностей, необходимых для кодирования аминокислотных остатков белка. Не было никаких причин полагать, что гены эукариот могут быть организованы как-то иначе. Первое указание на то, что в отличие от генов бактерий гены эукариот не являются непрерывными, получено при изучении РНК, синтезируемых аденовирусом
человека (крупный ДНК-содержащий вирус). Оказалось, что в той области вирусной ДНК, на которой синтезируются эти мРНК, присутствуют последовательности, никогда не встречающиеся в зрелой РНК. Предположение о том, что это явление присуще только вирусам, было быстро отвергнуто после того, как аналогичную прерывистость обнаружили в генах овальбумина и β-глобина позвоночных. Как уже упоминалось выше, последовательности, присутствующие в ДНК, но не входящие в состав мРНК, были названы интронами, а последовательности, присутствующие в зрелой мРНК, - экзонами (рис. 9-76 и 9-77).
Теперь известно, что первичный транскрипт РНК - это точная копия гена, содержащая как экзоны, так и интроны. Последовательности интронов вырезаются из середины транскрипта РНК, в результате чего образуется молекула мРНК, непосредственно кодирующая белок (рис. 3-13).
Поскольку кодирующие последовательности с обеих сторон интро-на после его удаления соединяются друг с другом, эту реакцию назвали сплайсингом РНК (to splice-сращивать). Сплайсинг РНК протекает в клеточном ядре вдали от рибосом и РНК переносится в цитоплазму только после завершения этого процесса.
В настоящее время известно, что гены млекопитающих содержат гораздо больше интронных последовательностей, чем экзонов (см. табл.
9-1). Вот почему очень длинные молекулы гяРНК (более 50000 нуклеотидов) после сплайсинга превращаются в более короткие молекулы цито-
плазматической мРНК (от 500 до 3000 нуклеотидов).
Перед тем как обсудить закономерности распределения интронов внутри эукариотических генов, а также их значение для клеток эукариот, необходимо объяснить, как последовательности интронов узнаются и удаляются при сплайсинге.
9.4.9. К транскриптам гяРНК сразу же присоединяются белки и мяРНП [49]
У эукариот в отличие от бактерий, вновь синтезированная РНК, по-видимому, сразу же конденсируется с образованием множества рядом

Рис. 9-77. Транскрибируемая часть гена р-глобина человека. Приведена последовательность той цепи ДНК, которая соответствует последовательности мРНК. Первичный транскрипт РНК обведен цветной линией, а нуклеотиды, входящие в состав трех кодирующих областей (экзонов), выделены цветом. Следует отметить, что экзон 1 содержит 5` -лидерную последовательность, а экзон У включает в себя 3` -трейлерную
(дополнительную) последовательность. Хотя эти последовательности и входят в состав мРНК, они не кодируют аминокислоты.
Высококонсервативные нуклеотиды GT и AG на концах каждого интрона обведены (см. рис. 9-79); обведены также сигналы разрезания и полиаденилирования вблизи З'-конца гена (ААТААА, см. рис. 9-75).
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
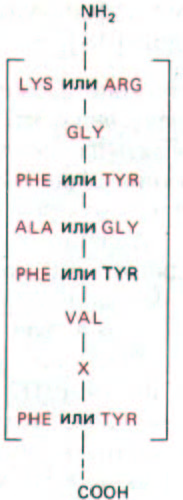
Рис. 9-78. Аминокислотная последовательность, присутствующая во многих эукариотических РНК-связывающих белках. Эта последовательность обнаруживается у столь различных организмов, как дрожжи, дрозофила и человек. Она входит в состав белков гяРНП-частиц;
белков, связывающихся с polyA-«хвостом» гяРНК; белков, образующих мяРНП; присутствует в нуклеолине-белке, который в избытке имеется в ядре. Выявление такой последовательности в белке, функция которого неизвестна, дает основание предполагать, что этот белок связывается с РНК.
расположенных частиц, содержащих белок. В состав этих частиц входит РНК длиной приблизительно 5000 нуклеотидов, нить которой намотана на белковый остов. Гетерогенное ядерные рибонуклеопротеиновые частицы (гяРНП-частицы) можно выделить путем обработки ядер рибонук-
леазой. Концентрация фермента должна быть подобрана таким образом, чтобы разрушить РНК, связывающую эти частицы. Константа седиментации гяРНП-частиц около 30S, а их диаметр примерно в два раза превышает диаметр нуклеосом (20 нм). Соответственно и белковая сердцевина этих частиц больше и сложнее по составу, в нее входит по крайней мере 8 различных белков массой от 34000 до 120000 дальтон. Все они принадлежат к классу наиболее часто встречающихся белков клеточного ядра. Охарактеризованные к настоящему времени белки этой частицы, как оказалось, содержат одну или более копий короткой последовательности аминокислот, которая часто встречается в составе многих белков, связывающихся с РНК (рис. 9-78).
Применение стандартных методик распластывания, благодаря которым транскрибирующиеся гены можно наблюдать под электронным микроскопом, к сожалению, часто приводит к разрушению частиц гяРНП (см. рис. 9-70). Тем не менее на этих препаратах удается обнаруживать необычного вида частицы. Их расположение достаточно убедительно доказывает участие в сплайсинге РНК. Стабильные частицы очень быстро образуются в местах соединения последовательностей интронов и экзонов и по мере элонгации транскрипта РНК они сливаются в пары с образованием больших агрегатов. Предполагают, что эти агрегаты представляют собой сплайсосомы, катализирующие сплайсинг РНК (рис. 9-79).
Биохимический анализ выявил в клеточном ядре еще один класс частиц, состоящих из белка и маленьких молекул РНК (250 нуклеотидов или меньше), которые произвольно были обозначены U1, U2,..., U12-PHK. Эти комплексы, названные малыми ядерными рибонуклеопро-
теинами (мяРНП), напоминают рибосомы в том отношении, что каждая из этих частиц содержит набор белков, связанных со стабильной молекулой РНК. По размеру, однако, эти частицы гораздо меньше рибосом (около 250000 дальтон по сравнению с 4,5 млн. дальтон рибосомы),
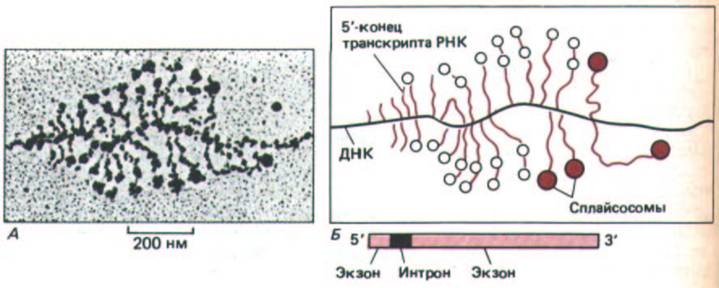
Рис. 9-79. Электронная микрофотография растянутого хроматина. Видны большие рибонуклеопротеиновые частицы, собирающиеся на 5'- и З'-сайтах сплайсинга и образующие сплайсосомы. На фотографии (А) представлен ген, кодирующий белок хориона дрозофилы;. положение сайтов сплайсинга на его первичных транскриптцх известно. Б. Большинство транскриптов РНК вблизи своих 5'-концов содержит одну или две большие РНП-частицы. Если на транскрипте присутствует две частицы (пустые кружки на схеме Б), то они, как правило, имеют диаметр 25 нм и расположены вблизи или в самих 5'- и З'-сайтах сплайсинга отдельных небольших последовательностей интронов (длиной 228 нуклеотидов) в области У-концов транскриптов. Более длинные, более зрелые транскрипты двух генов часто несут единственную частицу большего размера (цветные кружки на схеме Б} в области интрона. Вероятно, она возникает в результате стабильной ассоциации двух меньших частиц и представляет собой объединенную сплайсосому. Поскольку в ряде случаев сплайсинг происходит тогда, когда З'-конец РНК еще транскрибируется, можно сделать вывод, что для сплайсинга не нужна polyA-последовательность на 3'-конце молекулы гяРНК. (С изменениями по I. N. Osheim, О. Z. Miller and A.Z. Beyer, Cell 43: 143-151, 1985.)
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.

Рис. 9-80. Консенсусные последовательности 5'- и З'-сайтов сплайсинга РНК. Приведенная последовательность дана для цепи РНК.
Обязательные динуклеотиды GU и AG на каждом конце интрона выделены цветом (см. также рис. 9-77).
кроме того, в этих частицах отношение белок/РНК выше, чем у рибосом. Некоторые белки входят в состав различных типов мяРНП, другие присуши только одному типу частиц. Впервые это удалось показать в опытах с сывороткой крови, полученной от больных системной красной
волчанкой. У таких больных в крови имеются антитела к одному или более белку, входящему в состав мяРНП. Например, оказалось, что одно и то же антитело связывает U1-, U2--, U5- и U4/б-мяРНП. По-видимому, это объясняется тем, что в их состав входит один и тот же белок. Полагают, что отдельные мяРНП на основе комплементарности узнают специфические последовательности нуклеиновой кислоты. Некоторые частицы, вероятно, участвуют в сплайсинге РНК; какие-то мяРНП вовлечены в реакции расщепления, в ходе которых образуется З'-конец вновь синтезированных РНК;
функция других мяРНП неизвестна. Доказательства участия мяРНП в сплайсинге получены в опытах по изучению процессинга РНК in vitro.
9.4.10. Последовательности интронов удаляются в виде лассо-подобных РНК-структур [50]
Длина интронов варьирует от 80 до 1000 и более нуклеотидов. Интроны принципиально отличаются от экзонов тем, что для них, по-
видимому, не так важна строго определенная последовательность нуклеотидов. В ходе эволюции, вероятно, именно в них накапливаются мутации;
часто удается изменить большую часть последовательности интрона, не затрагивая активности гена. На основании этих данных было высказано предположение, что последовательности интронов функционально неактивны и служат главным образом генетическими «связками».
Единственными высококонсервативными областями в интронах являются последовательности, необходимые для их удаления. На каждом конце

Рис. 9-81. Метод получения РНК, пригодной для анализа сплайсинга РНК in vitro. Прежде всего, необходимо иметь большое количество соответствующей последовательности ДНК (сконструировать ее методом генетической инженерии и клонирования); кроме того, нужны относительно простые РНК-полимеразы из бактериофагов Т7 или SP6, с высокой активностью транскрибирующие РНК in vitro. Если соединить фрагмент эукариотической ДНК с промотором бактериофага, то РНК-полимераза может синтезировать in vitro большое количество РНК, кодируемой фрагментами эукариотической ДНК. 5'-кэп, входящий в состав гяРНК и необходимый для инициации транскрипции, можно присоединить к таким РНК, используя искусственно синтезированный кэпированный нуклеотид (не показано).
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.

Рис. 9-82. Катализ сплайсинга РНК сплайсосомой, образовавшейся при соединении U1-, U2-, U5- и U4/6-мяРНП (обозначены кружочками), и других компонентов (не указаны). После сборки сплайсосо-мы реакция проходит в две стадии: на стадии 1 определенный А-нукле-
отид, расположенный в последовательности интрона вблизи З'-сайта сплайсинга, атакует 5'-сайт сплайсинга, который в результате разрезается.
Разрезанный 5'-конец последовательности интрона ковалентне связывается с этим А-нуклеотидом, образуя разветвленную структуру, представленную на рис. 9-83. На стадии 2 З'-ОН-конец первого экзона, образовавшийся на первой стадии, соединяется с началом второго экзона, разрезая при этом молекулу РНК по З'-сайту сплайсинга. Таким образом, две последовательности экзонов соединяются вместе, а последовательность интрона высвобождается в виде лассо-подобноЙ структуры. Полный комплекс, образующий сплайсосому седиментирует при 60S; следовательно, по размерам он приближается к рибосоме. Процессинг РНК происходит в ядре, в результате этих событий из первичных РНК-
транскриптов (предшественники мРНК) образуются молекулы мРНК.
интрона имеются консенсусные области, которые во всех интронах почти одинаковы. Изменение этих последовательностей влияет на процесс сплайсинга, в результате которого из первичного транскрипта РНК удаляются последовательности интронов. На рис. 9-80 показаны такие консервативные последовательности для 5'-сайта сплайсинга (донорнын сайт) и З'-сайта сплайсинга (акцепторный сайт). Реакция разрыва и воссоединения РНК должна происходить абсолютно точно, так как ошибка даже в один нуклеотид сместит рамку считывания в образовавшейся молекуле РНК и сделает бессмысленной закодированную в ней информацию.
Механизм удаления интронов из первичных транскриптов анализировали в опытах in vitro. Для этого соответствующим образом сконструированную ДНК инкубировали с высокоочищенной РНК-полимеразой для получения индивидуальных РНК, содержащих единственный интрон (рис. 9-81). Когда такие молекулы РНК добавляли к клеточному экстракту, происходил сплайсинг. Реакция носила одноступенчатый характер, для нее были необходимы продолжительная инкубация с АТР, наличие определенных белков в экстракте и мяРНП U1, U2, U5 и U4/6. Эти составляющие соединяются с образованием многокомпонентного рибо-нуклеопротеинового комплекса или сплайсосомы. Анализ РНК, которые являются промежуточными продуктами в этой реакции, а также мяРНП, необходимых для их образования, привел к следующему выводу:
вырезание интрона сопровождается образованием лассо-подобной структуры (рис. 9-82 и 9-83).
В последнее время уточнена функция ряда мяРНП. Например, мяРНП U1 связывается с 5'-сайтом сплайсинга благодаря нуклеотидной последовательности в РНК U1, которая комплементарна консенсусной последовательности сигнала сплайсинга, состоящей из девяти нуклеота-дов (см. рис. 9-80). Поскольку известно, что молекула РНК обладает
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.

Рис. 9-83. Строение разветвленной цепи РНК, образующейся при сплайсинге РНК. А-нуклеотид, выделенный цветом, - это тот же самый нуклеотид, который фигурировал на рис. 9-82; здесь показано ответвление, образующееся на первой стадии реакции сплайсирова-ния. На этой стадии 5'-конец последовательности интрона разрезается и его фосфатная группа ковалентно связывается с 2'-ОН-рибозной группой А-нуклеотида, расположенного на расстоянии 30 нуклеотидов от З'-конца последовательности интрона. Разветвленная цепь остается в вырезаемой последовательности интрона и обусловливает его лассо-образную форму (см. рис. 9-82).
ферментативной активностью (см. разд. 3.2.11), катализировать разрыв и образование ковалентных связей, необходимых для сплайсинга РНК, может либо она сама, либо белковый компонент сплайсосомы.
9.4.11. Из каждого транскрипта РНК обычно удаляется несколько интронных последовательностей [51]
В связи с тем, что сплайсосома главным образом узнает консенсусную последовательность на границах интрона, существует опасность, что 5'-донорный сайт на конце любого интрона соединится с З'-сайтом сплайсинга не своего, а другого интрона. Когда 5'- и З'-половинки двух разных интронов в эксперименте соединяют вместе, получающиеся в результате последовательности гибридного интрона узнаются ферментом РНК-сплайсинга и удаляются.
Принимая во внимание эти данные может показаться странным, что гены позвоночных содержат иногда до 50 интронов (см. табл. 9-1).
Ведь если случайно по ошибке соединятся любые два 5'- и З'-сайта сплайсинга, это приведет к потере неких функционально активных последовательностей мРНК, что может иметь катастрофические последствия. Каким-то образом подобные ошибки не допускаются: механизм процессинга в норме гарантирует, что каждый 5'-сайт сплайсинга спарится именно с ближайшим к нему З'-сайтом сплайсинга, расположенным в направлении от 5' к 3` на линейной последовательности РНК (рис. 9-84). Пока неизвестно, как осуществляется такое последовательное соединение.
Вероятно, важную роль в этом играет сборка сплайсосом в ходе роста транскрипта РНК (см. рис. 9-79). Имеются также данные, свидетельствующие о том, что для правильного спаривания сайтов сплайсинга очень важна точная трехмерная конформация последовательностей интрона и экзона.
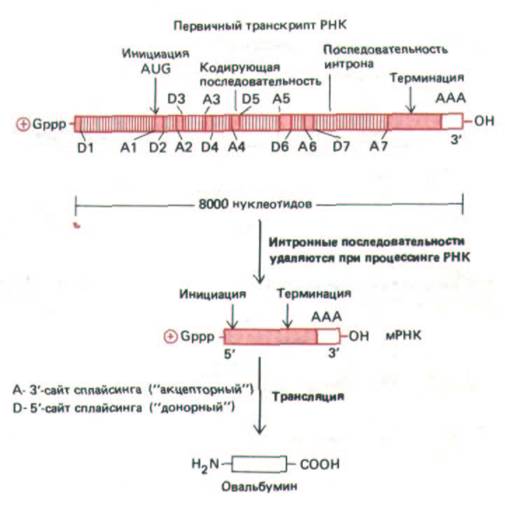
Рис. 9-84. Первичный транскрипт гена овальбумина курицы. Для получения активной молекулы мРНК из него удаляется семь интронов.
5'-сайты сплайсинга (до-норные сайты) обозначены буквой D, а З'-сайты сплайсинга (акцепторные сайты) обозначены буквой А.
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
|
|
|
|
|
Дата добавления: 2015-08-31; Просмотров: 1086; Нарушение авторских прав?; Мы поможем в написании вашей работы!