
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Цитированная 1 страница
|
|
|
|
Общая
10-23
9.4.16. Рибосомные РНК синтезируются на тандемно расположенных копиях идентичных генов [56]
Многие белки, присутствующие в дифференцирующейся клетке в больших количествах (например, гемоглобин в эритроцитах и миоглобин в клетках мышц), синтезируются с генов, представленных в гаплоидном геноме лишь одной копией. Количество этих белков в клетке велико благодаря тому, что с каждой из многих молекул мРНК, транскрибируемых с кодирующих их генов, за минуту может транслироваться до 10
белков. В норме в каждом клеточном поколении это приводит к образованию более 10000 молекул белка на одну молекулу мРНК. Однако такого рода амплификация невозможна в случае рибосомной РНК, так как эти молекулы и являются конечным продуктом гена. Тем не менее, в растущей клетке высших эукариот для того, чтобы получить необходимые 10 млн рибосом за каждую генерацию, должно синтезироваться 10 млн копий каждого типа молекул рибосомной РНК. Такие количества могут образоваться лишь в том случае, если клетка содержит множественные копии генов, кодирующих рибосомную РНК (гены рРНК).
Даже E.coli для обеспечения клетки нужным количеством рибосом должна иметь семь копий гена рРНК. В клетках человека содержится около 200 копий гена рРНК на гаплоидный геном, причем эти копии распределены небольшими кластерами по пяти различным хромосомам, В клетках шпорцевой лягушки Xenopus обнаружено приблизительно 600 копий гена рРНК на одной хромосоме. Множественные копии высококонсервативных генов рРНК в любой хромосоме расположены в виде серии тандемных повторов, отделенных друг от друга нетранскрибируемым участком ДНК, который называется спейсером. В гл. 10 мы изложим современные представления о механизме возникновения таких тандемно расположенных генов.
Благодаря тому, что кластеры тандемно повторяющихся генов рРНК сгруппированы и очень активно транскрибируются, они хорошо видны на электронномикроскопических препаратах хроматина. Молекулы РНК-полимеразы и ассоциированные с ними новообразованные транскрипты (на один ген их приходится до 100 и более) упакованы таким образом, что структура приобретает вид «елочки» (рис. 9-90). Как отмечалось ранее (см. рис. 9-73), верхушка каждой такой елочки представляет собой точку инициации транскрипции; конец же гена рРНК четко определяется по внезапному исчезновению молекул РНК-полиме-разы и соответствующих транскриптов.
Гены рРНК транскрибируются РНК-полимеразой I с образованием идентичных транскриптов. В клетках человека такие первичные транскрипты генов рРНК, известные как 45S-PHK, имеют в длину около 13000 нуклеотидов. Прежде чем покинуть ядро в составе собранной рибосомной частицы, молекула 45S-PHK подвергается специфическому расщеплению, в результате чего образуется по одной копии 28S-PHK (около 5000 нуклеотидов), 18S-PHK (около 2000 нуклеотидов) и 5,88-РНК (около 160 нуклеотидов), которые, собственно, и являются компонентами рибосом. Общее происхождение всех трех типов рРНК из одного и того же первичного транскрипта служит гарантией того, что они образуются в равных количествах. Остальная часть этого транскрипта (около 6000 нуклеотидов) деградирует в ядре (рис. 9-91). Не исключено, что эти «излишние» последовательности молекулы-предшественника рРНК играют определенную роль на ранних этапах сборки рибосомы, происходящих непосредственно по завершении синтеза 45S-РНК.
Другие тандемно повторяющиеся гены, также разделенные нетранс-
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
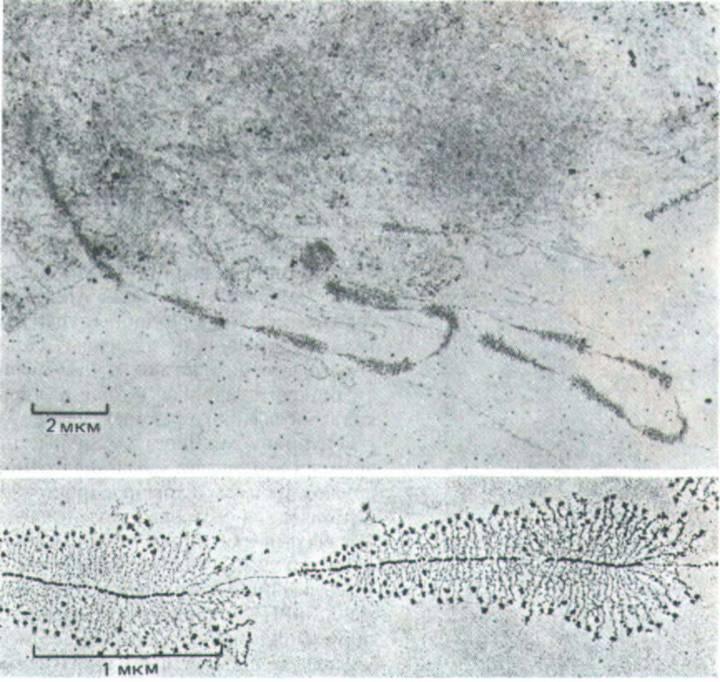
Рис. 9-90. Транскрипция тандемно расположенных генов рРНК, визуализированная с помощью электронного микроскопа. На верхней микрофотографии при меньшем увеличении хорошо различимы чередующиеся транскрибируемые гены и нетранскрибируемые спейсе-ры. Большие частицы на 5'-конце каждого транскрипта рРНК (нижняя фотография), как полагают, связаны с началом сборки рибосом. Хорошо видны также молекулы РНК-полимераз. (Верхний снимок V. Е. Foe, Cold Spring Harbor Symp. Quant. Biol. 42: 723-740, 1978, нижний снимок-с любезного разрешения Ulrich Scheer.)
лируемыми спейсерами, представлены генами 5S-PHK большой рибо-сомнои субъединицы (это единственная рРНК, которая транскрибируется отдельно от других). Гены 5S-pPHK насчитывают в длину всего лишь около 120 нуклеотидных пар и как большинство других генов, кодирующих маленькие стабильные РНК (наиболее известные из них-это гены тРНК), транскрибируются РНК-полимеразой III. У человека имеется приблизительно 2000 генов 5S-pPHK, которые тандемно расположены внутри единственного кластера, локализованного совершенно в другой области, чем остальные гены рРНК. Остается неизвестным, почему этот тип рРНК транскрибируется отдельно.
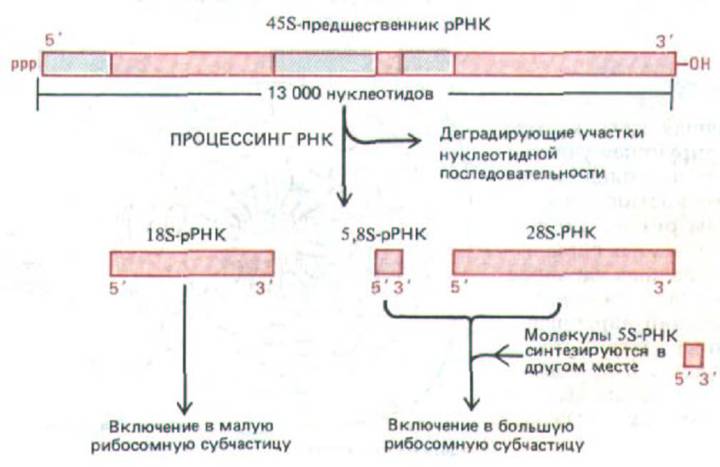
Рис. 9-91. Процессинг 45S-предшественника рибосомных РНК с образованием молекул РНК трех типов. Обратите внимание, что почти половина нуклеотидной последовательности пре-рРНК деградирует в ядре.
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
9.4.17. Ядрышко-это центр образования рибосом [57]
Непрерывная транскрипция дуплицированных генов обеспечивает клетку достаточным количеством рРНК. Новосинтезированные транскрипты незамедлительно связываются с рибосомными белками с образованием рибосом. Сборка рибосом происходит в ядре, а именно в той его специфической области с диффузной структурой, которая называется ядрышком. В составе ядрышка выявляются большие петли ДНК, содержащие гены рРНК, которые с необычайно высокой скоростью транскрибируются РНК-полимеразой I. Эти петли носят название «ядрышковые организаторы». Самое начало процесса сборки рибосомы можно увидеть в электронный микроскоп: 5'-концы рРНК-транскриптов, составляющих крону «елочек», компактизуются с образованием белок-содержащих гранул (рис. 9-90). Подобные гранулы не образуются на РНК-
транскриптах других типов, по-видимому, они отражают первые стадии РНК-белкового взаимодействия, происходящего в ядрышке.
Биосинтетические функции ядрышка можно изучать с помощью кратковременного радиоактивного мечения вновь синтезированной РНК [3Н]-уридином. Через различные промежутки времени, прошедшие со времени включения метки, клеточное содержимое фракционируют и выделяют меченые ядрышки (рис. 9-92). Эти эксперименты показали, что интактные 455-транскрипты сначала образуют крупные комплексы, связываясь с большим количеством различных белков, импортируемых из цитоплазмы, где синтезируются все клеточные белки. Большая часть из 70 различных полипептидных цепей, формирующих рибосому, а также 5S-pPHK включаются именно на этой стадии. Для правильного протекания процесса сборки необходимы и иные молекулы. Например, в ядрышке присутствуют и другие белки, связывающиеся с РНК, а также определенные маленькие рибонуклепротеиновые частицы (включая U3-мяРНП), которые, как полагают, катализируют сборку рибосом. Эти компоненты остаются в ядрышке, а субъединицы рибосом в готовом виде транспортируются в цитоплазму. Особенно заметным компонентом ядрышка является нуклеолин, хорошо изученный белок, который присутствует в больших количествах, и по-видимому, связывается только с транскриптами рибосомной РНК. Нуклеолин особым образом окрашивается серебром. Такое окрашивание характеризует и все ядрышко в целом.
Во время процессинга 45S-PHK этот гигантский рибонуклеопротеиновый комплекс постепенно теряет часть белков и последовательностей
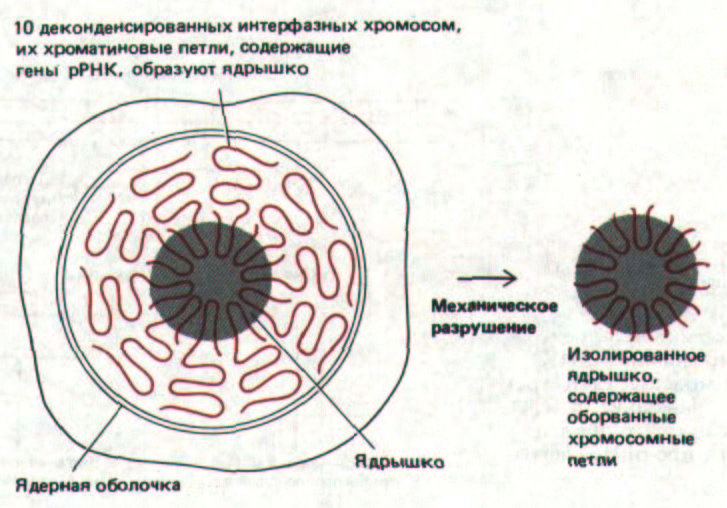
Рис. 9-92. Упрощенная схема клетки человека, иллюстрирующая участие хроматиновых петель, принадлежащих 10 отдельным хромосомам и содержащих гены рРНК, в образовании одного большого ядрышка. Препараты очищенных ядрышек весьма полезны в биохимических исследованиях функций ядрышка; получают такие препараты путем механического отделения образующих ядрышко хроматиновых петель от хромосом, как показано на рисунке.
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.

Рис. 9-93. Схема, иллюстрирующая функции ядрышка в биосинтезе рибосом. 458-рРНК-транскрипт упакован в составе крупной рибонуклеопротеиновой частицы, содержащей много рибосомных белков, импортированных из цитоплазмы. В ходе процессинга этой РНП-
частицы, протекающего в ядрышке, формируются предшественники большой и малой рибосомных субъединиц; часть гигантского РНП-комплекса при этом деградирует. Предполагается, что окончательное созревание рибосомных субъединиц происходит лишь после того, как они (каждая индивидуально) транспортируются через ядерные поры в цитоплазму.
РНК и затем специфически расщепляется, образуя самостоятельные предшественники большой и малой рибосомных субъединиц (рис. 9-93). Через 30 мин после введения радиоактивной метки первые зрелые малые субъединицы рибосом, содержащие меченую 18S-pPHK, выходят из ядрышка и появляются в цитоплазме. Сборка больших рибосомных субъединиц, содержащих 28S, 5,85, и 5S-PHK, требует несколько больше времени (около 1ч), поэтому в ядрышке накапливается гораздо больше недостроенных больших субъединиц, чем малых.
Заключительные стадии созревания рибосом осуществляются только после выхода рибосомных субъединиц из ядра в цитоплазму. Этим достигается изоляция функционирующих рибосом от незрелых ядерных транскриптов.
9.4.18. Ядрышко-это высокоорганизованная структура внутри ядра [57]
По данным световой микроскопии большое сфероидальное ядрышко-наиболее легко выявляемая структура в ядре немитотической клетки. Неудивительно поэтому, что оно было столь скрупулезно исследовано
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.

Рис. 9-94. Электронная микрофотография тонкого среза ядрышка в фибробласте человека. Хороню видны три дискретные зоны. А.
Общий вид ядрышка. Б. Детализация. (С любезного разрешения Е. G. Jordan and J. McGovern.)
первыми цитологами: обзор по данной теме, датированной 1898 г., содержал около 700 ссылок. К 1940 г. выяснилось, что в ядрышке находится большое количество РНК и белков, однако его биологическая роль, связанная с синтезом рибосомных РНК и сборкой рибосом, оставалась неизвестной вплоть до 60-х годов.
Некоторые детали строения ядрышка можно увидеть с помощью электронной микроскопии. В отличие от цитоплазматических органелл ядрышко не имеет мембраны, которая окружала бы его содержимое. Похоже, что оно образовано недозрелыми предшественниками рибосом, специфически связанными друг с другом неизвестным образом. На типичной электронной микрофотографии ядрышка можно различить три дискретные зоны (рис. 9-94): 1) слабоокрашенный компонент, содержащий ДНК из области ядрышкового организатора хромосомы, 2) гранулярный
компонент, в состав которого входят частицы диаметром 15 нм, представляющие наиболее зрелые предшественники рибосомных частиц, и 3)
плотный фибриллярный компонент, состоящий из множества тонких (5 нм) рибонуклепротеиновых фибрилл, представляющих собой РНК-
транскрипты.
Размер ядрышка отражает степень его функциональной активности, которая широко варьирует в различных клетках и может изменяться в индивидуальной клетке. Так, в некоторых покоящихся клетках растений ядрышко очень мало, тогда как в клетках, продуцирующих большое количество белков, оно может занимать до 25% объема всего ядра. Изменение размеров ядрышка связано главным образом с уменьшением или увеличением доли гранулярного компонента, что, в свою очередь, вероятно, контролируется на уровне транскрипции рибосомных генов: по данным электронной микроскопии доля активных рибосомных генов, равно как и эффективность транскрипции каждого гена, изменяется в зависимости от обстоятельств.
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
9.4.19. После каждого митоза ядрышко образуется заново из специфических участков хромосомы [58]
Внешний вид ядрышка заметно меняется в зависимости от фазы клеточного цикла. С началом митоза ядрышко уменьшается в размерах, а затем вовсе исчезает по мере того, как происходит конденсация хромосом и прекращается синтез всех типов РНК; как правило, в метафазной клетке ядрышко не обнаруживается. В конце митоза (в телофазе), когда возобновляется синтез рибосомных РНК, миниатюрные ядрышки вновь возникают на участках хромосом, содержащих гены рибосомной РНК (рис. 9-95).
В клетках человека гены рРНК локализуются на концах пяти пар хромосом, т.е. на 10 хромосомах из имеющихся 46 (см. рис. 9-40).
Поэтому сразу после митоза в клетке человека образуется 10 маленьких ядрышек; их редко удается увидеть, так как они быстро растут и сливаются друг с другом в одно большое ядрышко, типичное для многих интерфазных клеток (рис. 9-96).
Что же происходит с РНК и белковым компонентом дезагрегировавшего в процессе митоза ядрышка? По-видимому, какая-то часть их распределяется по всем метафазным хромосомам и переносится в ядра дочерних клеток. В телофазе митоза при деконденсации хромосом эти «старые» ядрышковые компоненты могут участвовать в построении новых ядрышек.
9.4.20. Во время интерфазы отдельные хромосомы находятся на определенных местах в ядре [59]
Как отмечалось выше, при образовании ядрышка нужные для этого гены интерфазных хромосом собираются вместе в определенной области ядра. В связи с этим возникает вопрос, а не расположены ли хромосомы в ядре неслучайным образом? Этот важнейший вопрос был впервые поставлен биологами еще в конце XIX в, но до сих пор убедительный ответ на него не получен.
Некоторая упорядоченность в расположении хромосом связана с конфигурацией, которую они имеют в конце митоза. Известно, что непосредственно перед делением клетки конденсированные хромосомы растаскиваются к полюсам микротрубочками, которые прикреплены к центромерам. Таким образом, центромеры идут впереди, а дистальные плечи хромосом, оканчивающиеся теломерами, оказываются позади.
Хромосомы во многих ядрах в течение всей интерфазы стремятся сохранить эту так называемую Раблъ-ориентацию, при которой их

Рис. 9-95. Внешний вид ядрышка в клетках человека изменяется на разных стадиях клеточного цикла. На схеме изображено только клеточное ядро.

Рис. 9-96. Микрофотографии культивируемых фибробластов человека, демонстрирующие различные стадии ассоциации ядрышка. (С любезного разрешения Е. G. Jordan and J. McGovern.)
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
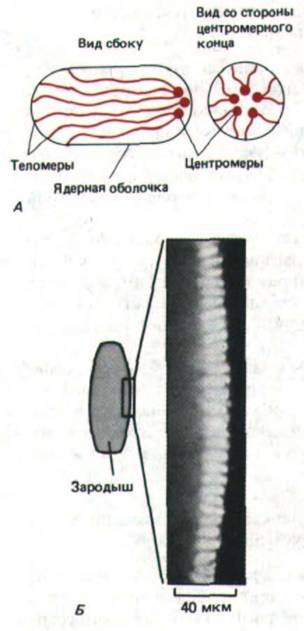
Рис. 9-97. Поляризованная ориентация хромосом в интерфазных клетках раннего эмбриона дрозофилы. А. Рабль-ориентация: все центромеры направлены к одному полюсу ядра, а все теломеры-другому. Обратите внимание, что у эмбриона все ядра имеют удлиненную форму.
Б. Полученная при небольшом увеличения световая микрофотография эмбриона дрозофилы на стадии клеток бластодермы; хромосомы окрашены флуоресцирующим красителем. Следует отметить, что области, окрашенные ярче всего (хромоцентры), ориентированы к наружной поверхности зародыша, и, следовательно, обращены в сторону апикальной плазматической мембраны каждой клетки. (С любезного разрешения John Sedat.)
центромеры обращены к одному полюсу ядра, а теломеры направлены к противоположному полюсу (рис. 9-97, А). В некоторых случаях полюсы ядра определенным образом ориентированы в клетке: например, в ранних зародышах дрозофилы все центромеры направлены к верхушке (рис. 9-
97, £). Подобная фиксированная ориентация ядра может в значительной мере влиять на полярность клетки, однако непонятно, какой эксперимент следует провести для проверки этого предположения.
В большинстве интерфазных клеток различные хромосомы невозможно отличить друг от друга, и, следовательно, трудно определить их расположение точнее, чем это описано выше. Исключение составляют гигантские политенные хромосомы интерфазных клеток личинок дрозофилы.
На этих хромосомах отдельные диски различаются достаточно хорошо, чтобы в интактном ядре можно было точно определить положение конкретных генов. Исследования показали, что набор интерфазных хромосом в целом не характеризует высокая упорядоченность, хотя Рабль-
ориентация сохраняется. В двух на вид идентичных клетках по соседству часто расположены разные хромосомы.
Анализ политенных хромосом свидетельствует о том, что в интерфазном ядре каждая хромосома расположена отдельно, т.е. разные хромосомы не сильно перевиты друг с другом (рис. 9-98). Более того, установлено, что в интерфазном ядре и другие типы хромосом, а не только политенные, стремятся занять дискретные домены. Например, методом гибридизации in situ с соответствующими ДНК-зондами можно выявить отдельную хромосому в гибридных млекопитающих, растущих в культуре (рис. 9-99). Замечено, что большая часть ДНК такой хромосомы занимает очень небольшую часть интерфазного ядра. Этот факт свидетельствует о том, что каждая отдельная хромосома остается компактной и структурированной, благодаря чему отдельные ее части могут активно участвовать в синтезе РНК.
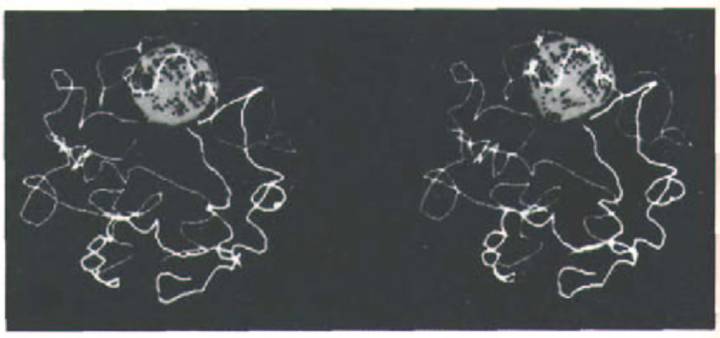
Рис. 9-98. Стереоизображение политенных хромосом в отдельном ядре клетки слюнных желез дрозофилы. Большой шар-это ядрышко.
Тело-меры обычно располагаются на поверхности ядерной оболочки напротив той его области, под которой расположено ядрышко; вблизи ядрышка расположены все центромеры. Хромосомы в ядре никогда не перепутываются, однако детали их укладки и соседи в одинаковых ядрах различаются. (С любезного разрешения Mark Hoch-strasser and John W. Sedat.)
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
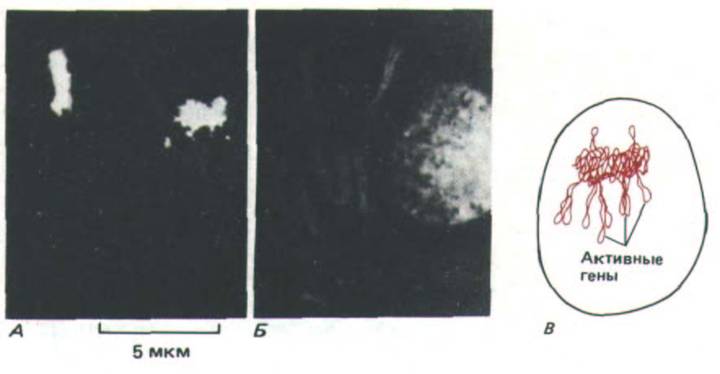
Рис. 9-99. Селективное мечение отдельной хромосомы в ядре культивируемых клеток млекопитающих в интерфазе. А. Результаты гибридизации in situ (с использованием флуоресцирующего зонда), позволяющей идентифицировать отдельные хромосомы человека в гибридной линии клеток человек - хомяк. Б. Тот же препарат, вся ДНК которого помечена флуоресцирующей меткой. В. Схема хромосомы человека в интерфазном ядре, представленном в части А. (А и Б-с любезного разрешения Joyce A. Kobori and David R. Cox.)
9.4.21. Насколько сильно структурировано ядро? [60]
Внутренняя часть ядра-это не случайно перемешанные молекулы РНК, ДНК и белков, входящих в его состав. Выше уже шла речь о том, что ядрышко представляет собой эффективное устройство для сборки рибосом, а кластеры сплайсосом, по-видимому, организованы в виде дискретных островков, где и происходит сплайсинг РНК (см. рис. 9-89). Упорядоченность структур хорошо видна и на электронных микрофотографиях ядерных пор: хроматин расположен вдоль внутренней ядерной мембраны, но отсутствует вокруг каждой ядерной поры и под ней (т. е. проход между цитоплазмой и нуклеоплазмой свободен (рис. 9-100). Более того, оказалось, что в некоторых случаях положение ядерных пор на ядерной оболочке не случайно, а строгим образом упорядочено (рис. 9-101). Подобная упорядоченность свидетельствует о соответствующей организации ядерной ламины, к которой и прикреплены поры.
Существует ли какая-либо внутриядерная структура, аналогичная цитоскелету, на которой и расположены ядерные компоненты? Многие биологи, изучающие клетку, убеждены, что такая структура существует. Ядерным матриксом или скелетом называют нерастворимый материал, остающийся в ядре после ряда биохимических экстракций. Можно показать, что белки, входящие в его состав, связывают определенные последовательности ДНК, называемые SAR или MAR (области, связанные со скелетом - scaffold -associated regions ипи с мятриксом - matrixassociated regions). Предполагают, что такие последовательности образуют основание петли ДНК (см. рис. 9-34). Благодаря сайтам прикрепления хромосом матрикс может участвовать в организации
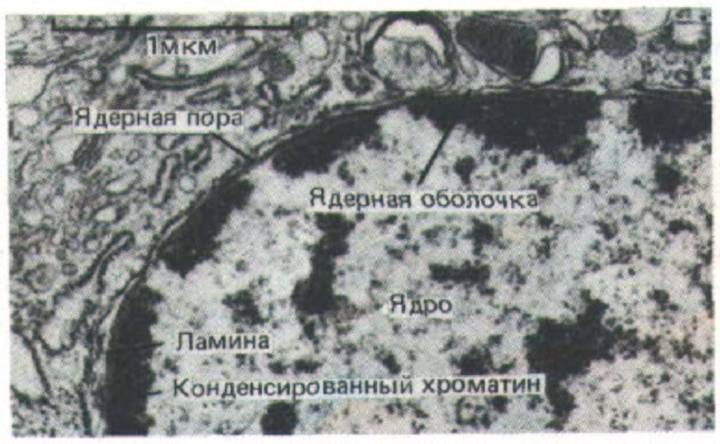
Рис. 9-100. Электронная микрофотография ядра клетки млекопитающего. Отчетливо видно, что конденсированный хроматин, выстилающий ядерную оболочку, отсутствует вокруг ядерных пор. (С любезного разрешения Zarry Gerace.)
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.

Рис. 9-101. Электронная микрофотография ядерной оболочки споры папоротника, полученная с помощью метода «замораживание -
скалывание». Видно упорядоченное расположение комплексов ядерных пор, лежащих параллельными рядами. На ядерной оболочке других клеток наблюдались либо сконцентрированные в одной области кластеры ядерных пор, либо необычные зоны, лишенные ядерных пор (они определенным образом ориентированы относительно других структур клетки). (С любезного разрешения Don H. Northcote, по К. Roberts and D. H. Northcote, Microsc. Acta 71: 102-120, 1971.)
хромосом, определять локализацию генов, регулировать транскрипцию и репликацию ДНК в ядре. Однако в связи с тем, что структурные компоненты матрикса еще не идентифицированы, остается неизвестным, представляет ли собой матрикс, полученный в ходе экспериментов, структуру, идентичную той, которая присуща интактным клеткам.
Заключение
РНК-полимераза, фермент, катализирующий транскрипцию ДНК, представляет собой сложную молекулу, состоящую из многих
полипептидных цепей. В эукариотических клетках обнаружено три РНК-полимеразы I, II и III. Эти ферменты эволюционно связаны друг с другом
и с бактериальной РНК-полимеразой, у них имеются одинаковые субъединицы. По-видимому, после инициации транскрипции от каждого
фермента отделяются одна или несколько субъединиц, называемых факторами инициации. Вместо них к ферментам присоединяются
субъединицы, называемые факторами элонгации. Они необходимы для удлинения цепи РНК, ее терминации и модификации. Вероятно, факторы
элонгации у различных типов полимераз разные, именно этим можно объяснить, почему транскрипты, синтезируемые каждым ферментом, модифицируются по-разному.
Большая часть мРНК клетки образуется в результате сложного процесса, начинающегося с синтеза гетерогенной ядерной РНК.
Первичные транскрипты гяРНК синтезируются РНК-полимеразой II. Эти транскрипты затем кэпируются путем добавления к 5'-концу
специального нуклеотида и после этого полиаденилируются на З'-конце. Модифицированные молекулы РНК обычно затем подвергаются
процессингу, в ходе которого из середины гяРНК удаляются последовательности интронов. Эта реакция катализируется большим
рибонуклепротеиновым комплексом, известным под названием сплайсосома. При этом значительная часть первичного транскрипта РНК
удаляется и распадается в ядре. Хотя обычно гяРНК составляет около половины всей РНК, синтезированной клеткой, образующаяся в
результате процессинга мРНК,-это всего лишь 3% РНК клетки.
В отличие от генов, кодирующих белки и транскрибирующихся поли-меразой U, гены, кодирующие большую часть структурных РНК, транскрибируются полимеразами I и 111. Эти гены обычно амплифицированы, собраны в тандемные кластеры. РНК-полимераза III синтезирует
стабильные небольшие РНК, включая тРНК и 5S-pPHK. РНК-полимераза I ответственна за образование большой молекулы-предшественника
рРНК (45S-pPHK). Все рибосоми клетки, за исключением митохонд-риальных и хлоропластных, собираются в ядрышке-отдельной ядерной
органелле, формирующейся вокруг тандемно расположенных генов рРНК, которые собираются вместе из нескольких хромосом.
Литература
Lewin В. Gene expression, Vol. 2. Eucaryotic Chromosomes, 2nd ed. New York, Wiley, 1980.
Levfin B. Genes, 3rd ed. New York, Wiley, 1987.
Newport J. W., Forbes D. J. The nucleus:structure, function, and dynamics. Annu. Rev. Biochem, 56, 535--566, 1987.
Watson J. D., Hopkins N. H.. Roberts J. W., Sleitz J. A., Weiner A. M. Molecular Biology of the Gene, 4th ed. Menlo Park, CA, Benjamin-
Cummings, 1987.
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
1. Adolph К. W., ed. Chromosomes and Chromatin, Vols. 1-3. Boca Raton FL, CRC Press, 1988.
Felsenfeld G. DNA. Sci. Am., 253 (4), 58-67, 1985.
Hsu T.C. Human and Mammalian Cytogenetics:A Historical Perspective. New York, Springer-Verlag, 1979.
2. Kacenoff R, Klotz L. C., Zimm В. Н. On the nature of chromosome-sized DNA molecules. Cold Spring Harbor Symp. Quant. Biol., 38, 1-8, 1974.
3. Burke D. Т., Carle G. F., Olson M. V. Cloning of large segments of exogenous DNA into yeast by means of artificial chromosome vectors.
Science, 236, 806-812, 1987.
Murray A. W. Chromosome structure and behavior. Trends Biochem. Sci., 10, 112-115, 1985.
4. Gall J. G. Chromosome structure and the C-value paradox. J. Cell Biol., 91, 3s-14s,1981.
Ohta Т., Kimura M. Functional organization of genetic material as a product of molecular evolution. Nature, 233, 118-119, 1971.
5. Mapping and Sequencing the Human Genome. Washington DC, National Academy Press, 1988.
Wilson A. C., Ochman H., Prager Е. М., Molecular time scale for evolution. Trends Genet., 3, 241-247, 1987.
6. Fried, M., Crothers D. M. Equilibria and kinetics of lae-repressor-operator interaction by polyacrylamide gel electrophoresis. Nucleic Acids Res., 9, 6505-6525, 1981.
7. Kadonaga J. Т., Tjian R. Affinity purification of sequence-specific DNA binding proteins. Proc. Natl. Acad. Sci. USA, 83, 5889-5893, 1986.
Rosenfeld P.J., Kellv T.J. Purification of nuclear factor I by DNA recognition site affinity chromafography. J. Biol. Chem., 261, 1398-1408, 1986.
Staudt L. M. et al. Cloning of a lymphoid-specific cDNA encoding a protein binding the regulatory octamer DNA motif. Science, 241, 577-580, 1988.
|
|
|
|
|
Дата добавления: 2015-08-31; Просмотров: 1938; Нарушение авторских прав?; Мы поможем в написании вашей работы!