
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Изменения мРНК при талассемии демонстрируют механизм возникновения новых белков при сплайсинге 4 страница
|
|
|
|
9.4.12. Один и тот же транскрипт РНК может сплайсироваться по-разному, при этом образуются мРНК, кодирующие разные белки [52]
Хотя большинство интронных последовательностей сами по себе, по-видимому, не обладают специфическими функциями, в ходе сплайсинга могут образоваться несколько различных мРНК. Следовательно, один и тот же транскрипт способен дать начало нескольким различным белкам, что сообщает клетке дополнительную генетическую пластичность. В гл. 10 будет показано, что в процессе дифференцировки клетки происходит изменение схемы сплайсинга многих транскриптов РНК, и таким образом по мере развития клетки, одни и те же кодирующие последовательности ДНК могут использоваться в разных целях (см. разд. 10.4.2).
Пластичность, обусловленная сплайсингом РНК, впервые была обнаружена у аденовирусов, у которых, собственно, и был открыт этот процесс. Геном аденовирусов детерминирует синтез очень длинных транскриптов РНК, кодирующих различные белки. В нормальной эукариотической клетке этого не происходит. Здесь каждая отдельная молекула мРНК кодирует лишь один белок, трансляция инициируется только вблизи 5'-кэпа и останавливается на первом же терминирующем кодоне. Однако у аденовируса существует определенный механизм сплайсинга РНК, который может использовать кодирующие последовательности в качестве интронов и удалять их, при этом один и тот же 5'-кэп способен соединяться с любой из лежащих за ним кодирующих последовательностей, образуя различные мРНК в соотношениях, необходимых для жизнедеятельности вируса. Такой альтернативный сплайсинг РНК дает возможность использовать один и тот же 5'-кэп в качестве сигнала инициации синтеза различных белков (рис. 9-85). Этот способ широко используется вирусами, что позволяет небольшому числу различных транскриптов РНК кодировать значительное количество белков.
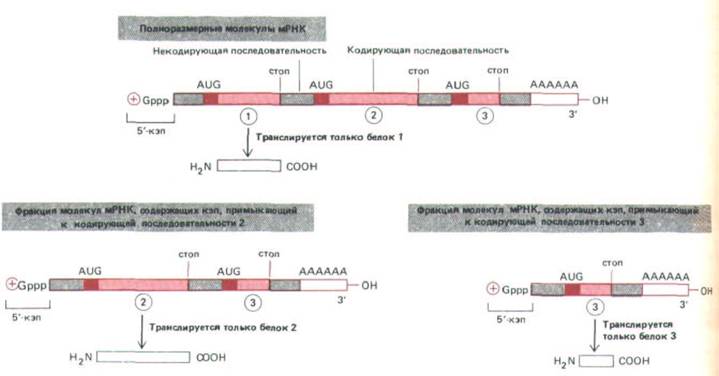
Рис. 9-85. У некоторых вирусов один и тот же первичный транскрипт сплайсируется по-разному, при этом образуется три (или более)
молекулы мРНК, каждая из которых кодирует свой белок. Во всех случаях транслируется лишь кодирующая последовательность, примыкающая к 5'-кэпу.
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
[53]
Благодаря методам генной инженерии исследователи получили возможность использовать для изучения клеточных механизмов мутации человека. Например, известно, что группа наследственных заболеваний крови, объединяемых под названием талассемии, характеризуется резким падением уровня гемоглобина. Секвенирование ДНК 50 больных талассемией показало, что в большинстве случаев снижение уровня гемоглобина было вызвано нарушением в сплайсинге РНК. Единичные замены нуклеотидов, обнаруженные в ДНК, либо инактивировали сайт сплайсинга, либо приводили к возникновению нового такого сайта. Удивительно, но анализ мРНК этих же больных показал, что потеря сайта сплайсинга не ведет к его отменению; оставшийся нормальным второй, участвующий в сплайсинге сайт, «ищет» поблизости подходящий участок и соединяется с ним.
При этом может реализоваться несколько вариантов сплайсинга, т. е. мутантный ген способен детерминировать несколько измененных белков (рис.
9-86). Таким образом, сплайсинг представляет собой весьма пластичный процесс. Итак, мутация в эукариотической клетке может привести к тому, что с одного гена будет синтезироваться несколько разных новых белков, следовательно, клетка обладает возможностью весьма эффективно опробовать заложенные в ней генетические варианты. Благодаря этому сплайсинг РНК может играть решающую роль в эволюции высших эукариот. Сплайсинг у низших эукариот, например дрожжей, регулируется значительно более строго, что ограничивает вероятность появления новых мРНК в результате нарушения этого процесса. Следовательно, скорость дивергенции форм и функций у низших эукариот должна быть более медленной, чем у высших эукариот.
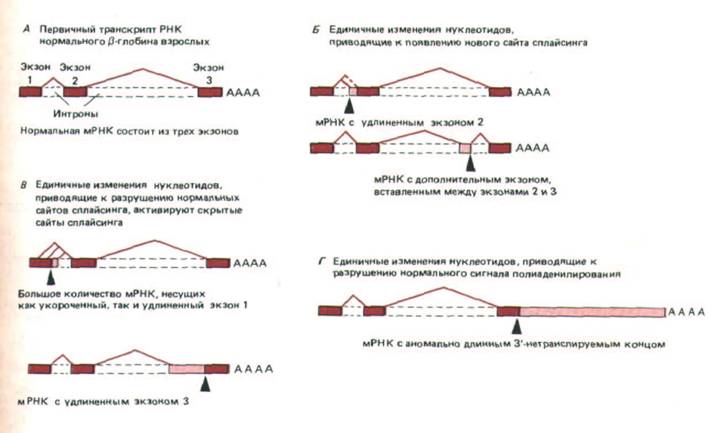
Рис. 9-86. Примеры аномального процессинга первичных транскрип-тов РНК р-глобина у больных талассемией. Мутантные сайты обозначены черными стрелками. Цветные прямоугольники соответствуют трем нормальным экзонам, изображенным на рис. 9-77. Цветные линии соединяют 5'- и З'-сайты сплайсинга, участвующие в процессинге первичного транскрипта РНК. Незакрашенные участки представляют новые последовательности нуклеотидов, которые включаются в конечную молекулу мРНК в результате мутации. Следует отметить, что если при мутации нормальный сайт сплайсинга остается без партнера, то в качестве партнера используется один из аномальных «скрытых» сайтов сплайсинга, расположенных рядом. (По S. Н. Orkin, In: The Molecular Basis of Blood Diseases. [G, Stanato-gannopoulos et al., eds.] pp. 106-126, Philadelphia:
Saunders, 1987.)
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
9.4.14. Сплайсинг РНК, катализируемый сплайсосомами, возможно, возник из самосплайсинга [54]
Открытие промежуточных структур, имеющих форму лассо, при сплайсинге ядерной РНК озадачило молекулярных биологов. Зачем клетке использовать такой причудливый способ сплайсинга, почему в ней не происходит простого соединения соответствующих 5'- и З'-сайтов? По-
видимому, ответ на этот вопрос можно найти, рассмотрев путь возникновения сплайсосом.
Согласно гипотезе, о которой шла речь в гл. 1, первые клетки в качестве основных катализаторов использовали молекулы РНК, а не белка, и генетическую информацию хранили в виде РНК, и не ДНК. Возможно, сплайсинг, катализируемый РНК, в этих первых клетках играл важную роль, а некоторые самосплайсирующиеся интроны сохранились до сих пор, например в ядерных генах рРНК у Telrahymena, у бактериофага Т4 и в некоторых генах митохондрий и хлоропластов. В этих случаях большие фрагменты последовательностей интронов продемонстрировали крайне высокую консервативность, вероятно, в связи с тем, что для образования каталитической поверхности на молекуле РНК они должны были складываться. Хорошо различимы два класса самосплайсирующихся интронов: интроны I группы начинают реакцию сплайсинга, связываясь с гуаниновым нуклеотидом в последовательности интрона, при этом G активируется и образует ударную группу, которая разрывает первую из фосфодиэфирных связей, расщепляемых при сплайсинге (связь на 5'-сайте сплайсинга). У интронов II группы эту роль выполняет адениновый нуклеотид; в результате его действия образуется структура, напоминающая лассо. Иными словами, ход реакции в этих двух случаях одинаков, и оба они, по-видимому, представляют собой составные части существовавших некогда механизмов (рис. 9-87).
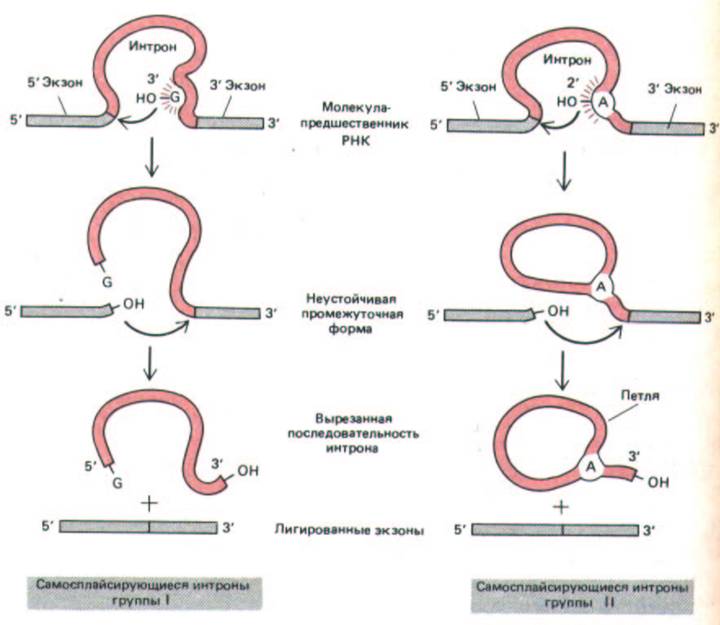
Рис. 9-87. Два известных класса самосплайсирующихся интронов. У интронов группы I для инициации сплайсинга с определенным сайтом связывается свободный G-нуклеотид (см. рис. 3-19), а у интронов группы II используется особым образом активированный А-нуклеотид.
Эти две группы интронов изображены таким образом, чтобы были видны их общие свойства. В обоих случаях ускорение реакции определяется белками, но в катализе участвует и РНК, входящая в состав интрона. Механизм, используемый интронами группы II, приводит к образованию лассо-подобных структур и напоминает реакцию, катализируемую сплайсосомой (ср. рис. 9-82). (По Т.К. Cech, Cell 44: 207-210, 1986.)
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
В ходе эволюции сплайсинга ядерной РНК сохранились реакции, используемые самосплайсирующимися интронами II группы, однако каталитическая функция последовательностей интронов перешла к отдельным компонентам сплайсосом. Следовательно, маленькие РНК U1 и U2
вполне могут быть остатками, например, последовательностей катализаторов. Передача функций катализа от интрона к сплайсосоме, вероятно, сняла большинство ограничений с эволюции интронов и сделала возможным появление новых интронных последовательностей.
9.4.15. Экспорт мРНК в цитоплазму происходит только после завершения сплайсинга [55]
Согласно общепринятой гипотезе (гл. 8), зрелые молекулы мРНК узнаются рецепторными белками (входящими в состав ядерных пор), которые способствуют продвижению мРНК в цитоплазму посредством активного переноса. Однако основные белки, входящие в состав гяРНП, и различные процессирующие молекулы, связанные в ядре с РНК, по-видимому, никогда не покидают ядро и, вероятно, соскальзывают с РНК по мере ее продвижения через ядерные поры (рис. 9-88). Изучение мутантов дрожжей показало, что в случае РНК, имеющей сайты сплайсинга, процесс переноса может начаться лишь после завершения сплайсинга. У условно летальных мутантов дрожжей, не способных сплайси-ровать свою РНК при высокой температуре, все несплайсированные предшественники мРНК остаются в ядре, тогда как мРНК, не требующие сплайсинга (а таких большинство у этого одноклеточного эукарио-тического организма), нормально переносятся в цитоплазму. Это наблюдение ВПОЛНе согласуется с гипотезой, согласно которой РНК задерживаются связанными с ними сплайсосомами, образующими многочисленные агрегаты внутри ядра высших эукариот. Такие агрегаты могут служить «островками сплайсинга», хотя, как они образуются и функционируют, пока неизвестно (рис. 9-89). Возможно, они представляют собой аналоги ядрышка, значительно большей и заметной структуры в ядре, чья организация и функция изучены хорошо.
Известно, что ядрышко - это место в ядре, где из РНК-предшественника образуются молекулы рибосомной РНК (рРНК), которые связываются с соответствующими белками и собираются в рибосомные частицы. Однако перед тем, как обсуждать строение ядрышка, необходимо рассмотреть синтез молекул-предшественников рРНК на генах рРНК.
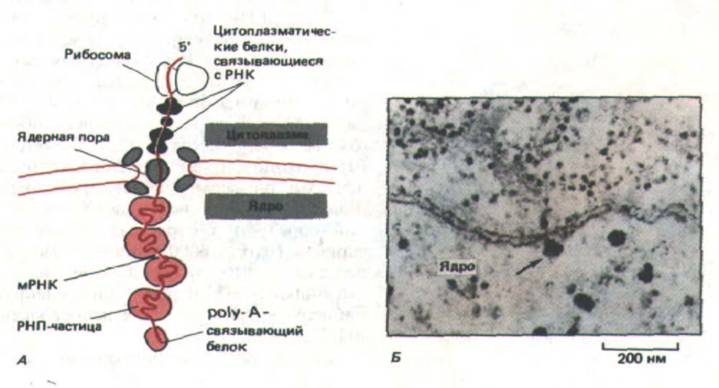
Рис. 9-88. Перемещение молекул мРНК через ядерные поры. А. Изменения, происходящие в белках, связанных с молекулой РНК при ее выходе из ядра. Б. Электронная микрофотография большой молекулы мРНК, образовавшейся в глетке слюнной железы насекомого. Очевидно, эта молекула «поймана» в момент выхода в цитоплазму (указано стрелкой). (По В. J. Stevens and H. Swift, J. Cell Biol. 31: 55-77, 1966.)
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
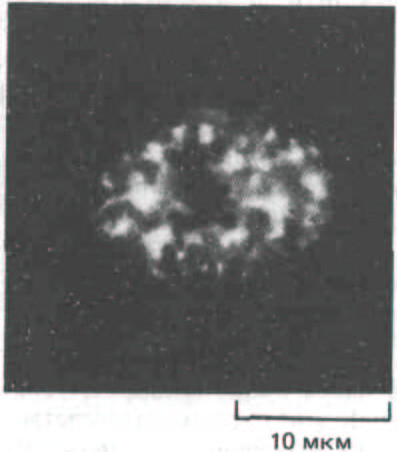
Рис. 9-89. Иммунофлуоресцентное мечение ядра фибробласта человека моноклональными антителами к мяРНП-частицам, участвующим в сплайсинге молекул-предшественников мРНК. Частицы мяРНП образуют большие агрегаты, которые могут функционировать как «островки сплайсинга». Антитела выявляют определенные белки, присутствующие в ряде мяРНК и участвующие в работе сплайсосомы. (С любезного разрешения N. Ringertz.)
|
|
|
|
|
Дата добавления: 2015-08-31; Просмотров: 1099; Нарушение авторских прав?; Мы поможем в написании вашей работы!