
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Позиционные сигналы и автономные клеточные программы контролируют деление клеток в растущем
|
|
|
|
Клеток
Как уже говорилось в гл. 12, рецепторы для большинства факторов роста, в том числе и PDGF, - это тирозин-специфические протеинкиназы, которые при их активации фосфорилируют сами себя и различные другие белки. Одна группа онкогенов кодирует аномальные формы таких рецепторов, включая только что описанные измененные рецеп-
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.

Рис. 13-35. Эта электронная микрофотография показывает, что протеинкиназа, кодируемая онкогеном v-src вируса саркомы Рауса, прикреплена к внутренней поверхности плазматической мембраны; как полагают, белок src, образующийся под действием белка c-src, по-
видимому, находится там же, но его труднее обнаружить, так как он обычно присутствует в очень малых количествах. Локализация белка src была определена на этом препарате по его реакции со специфическими антителами, к которым были присоединены электроноплотные частицы ферритина. {С любезного разрешения Ira Pastan; M. С. Willingham, G. Jay, I. Pastan, Cell 18: 125-134, 1979. Copyright Cell Press.)
торы для EGF и M-CSF (рис. 13-34). Другое небольшое семейство сходных протоонкогенов, гены c-ras, кодирует белки, которые связывают и гидролизуют GTP и, возможно, отдаленно родственны G-белкам, участвующим в передаче многих типов сигналов (разд. 12.3.11). Действие мутантных генов ras, обусловливающих трансформацию клеток, связано с повышенными концентрациями или повышенной эффективностью внутриклеточных медиаторов инозитолтрифосфата и диацилглицерола, и они делают клетку сверхчувствительной к некоторым факторам роста; эти факторы, как полагают, индуцируют выработку упомянутых медиаторов. Гены, гомологичные ras, имеются у почкующихся дрожжей, где они участвуют в регуляции цикла клеточного деления в зависимости от количества питательных веществ в среде.
Нормальный ответ животной клетки на стимуляцию факторами роста включает и многие другие внутриклеточные эффекты, в том числе изменения в рН, в концентрациях Са2+ и циклического AMP, в фосфорилировании белков, в транскрипции генов, в процессинге и распаде мРНК, в белковом синтезе и в цитоскелете. Многие из этих изменений происходят за несколько секунд, для других требуются часы. Большинство белковых продуктов протоонкогенов, участвующих в этой сложной сети управляющих систем, пока еще плохо поддаются классификации. Некоторые из них, например упоминавшиеся выше рецепторы для фактора роста, являются тирозин-специфическими протеин-киназами, связанными с мембраной.
Другие, например продукт гена cdc/28 у дрожжей, - это серин/треонин-специфические протеинкиназы, содержащиеся в цитоплазме. Третью категорию составляют белки, находящиеся главным образом в ядре (см, рис. 13-34); один из них, белок c- jun, был идентифицирован как регулятор транскрипции АР-1 (разд. 10.2.8, табл. ЮЛ); он может комбинироваться с другим членом того же семейства - белком c-fos, образуя с ним комплекс, связывающийся с ДНК.
Другой белок ядерной группы, соответствующий протоонкогену с-тус, видимо, может служить показателем того, находится ли клетка в пролиферативном состоянии: в быстро делящихся клетках белок с-тус присутствует в постоянной низкой концентрации на протяжении всего цикла, но как только клетка переходит в состояние покоя G0, он исчезает. Когда в среду с покоящимися клетками добавляют факторы роста, концентрация белка с-тус резко возрастает, достигая пика за несколько часов, а затем падает до более низкого ненулевого уровня. В отличие от с-
тус подавляющее большинство других белков в клетке почти не изменяют своей концентрации при переходе из пролиферативного состояния в стадию покоя или обратно.
13.4.6. Влияние онкогенов на регуляцию клеточного деления тесно связано с воздействием на адгезию клеток [32, 33]
Одним из наиболее интенсивно изучаемых протоонкогенов является c-src, соответствующий онкогену v-src вируса саркомы Рауса. Он принадлежит к небольшому семейству гомологичных протоонкогенов и кодирует белок src - тирозин-специфическую протеинкиназу с мол. массой 60000 (поэтому иначе ее называют P60src), которая содержит ковалентно связанную жирную кислоту, прикрепляющую ее к внутренней стороне плазматической мембраны (разд. 8.2.3). В своей онкогенной форме эта киназа сверхактивна, и для того, чтобы она могла вызывать трансформацию клетки, необходимо ее прикрепление к мембране (рис. 13-35). Эксперименты с антителами показывают, что
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.

Рис. 13-36. Белок src присутствует во многих участках клетки, но особенно концентрируется, видимо. в фокальных контактах и других местах прикрепления клетки к внеклеточному матриксу. А. Иммуно-флуоресцентная фотография, выявляющая распределение белка src по связыванию src-специфических антител. Б. Вид той же клетки при использовании метода оптической интерференции, выявляющего места плотного прикрепления клетки к субстрату (темные участки). Распределение светлых пятен белка src на фото А соответствует распределению темных пятен прикрепления на фото Б (указано стрелками). Эти фотографии показывают распределение вирусного белка src в клетке, трансформированной вирусом саркомы Рауса. По-видимому, белок src, синтезируемый в нормальной клетке, распределяется сходным образом, но его труднее выявить, так как он присутствует в меньших количествах. (L. R. Rohrschneider, Proc. Natl. Acad. Sci. USA 77: 3514-3518, 1980.)
белок src концентрируется в фокальных контактах, т. е. в местах, где клетка прикреплена к субстрату при помощи соединений с матриксом, в которых участвуют внутриклеточные актиновые филаменты (рис. 13-36). По-видимому, белок src играет роль в прикреплении актина к мембране, поскольку активация термочувствительной разновидности белка v-src (путем понижения температуры) сразу же приводит к увеличению складчатости мембраны (в результате движения ламеллоподий при участии актина; см. разд. 11.2.11), а также к ослаблению клеточной адгезии, включающему разрушение фокальных контактов, так что клетка округляется (см. рис. 13-30). Наблюдаемое изменение адгезии объясняют по меньшей мере двумя независимыми воздействиями белка src. Первое из них состоит в том, что активная киназа v-src фосфорилирует остаток тирозина в находящемся внутри клетки «хвостe» рецептора фибронектина (разд. 11.2.8). Исследования in vitro позволяют предполагать, что это фосфорилирование уменьшает сродство рецептора как к талину (внутри клетки), так и к фибронектину (вне клетки). Кроме того, клетки, трансформированные v-src, выделяют большое количество протеолитического фермента, называемого активатором плазминогена. Это название связано с его способностью активировать другой протеолитический фермент, плазмин, путем расщепления предшественника - плазминогена;
однако активатор плазминогена способен и непосредственно разрушать другие белки. Очевидно, и при прямом, и при косвенном воздействии он помогает клетке ослаблять ее прикрепление и мигрировать во внеклеточном матриксе. Когда в культуральную среду добавляют моноклональное антитело к активатору плазминогена, клетки становятся более адгезивными и проявляют тенденцию распластываться на субстрате. Таким образом, чрезмерная активность тирозинкиназы v-srct видимо, ослабляет клеточную адгезию двумя способами: она фосфорилирует рецепторы фибронектина (и другие трансмембранные молекулы из группы интегринов, участвующие в прикреплении клеток к матриксу - см. разд. 14.1.3) и вызывает секрецию протеинкиназы, которая разрушает фибронектин (и другие молекулы матрикса).
Какое отношение могут иметь эти факты к регуляции роста клеток? Если покоящийся фибробласт обработать PDGF, это сразу же вызовет складчатую деформацию и фокальные контакты клеток изменят свою структуру за несколько минут: из этих контактов ненадолго исчезнет винкулин, и прикреплявшиеся здесь пучки актиновых филаментов будут временно разрушены. Таким образом, в стимулируемой к делению покоящейся клетке PDGF вызывает много изменений того же типа, что возникают и под действием v-src. В самом деле, среди немедленных изменений, вызываемых PDGF, отмечается и усиленное фосфорилирование белка c-src, которое, повышая киназную активность src, могло
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
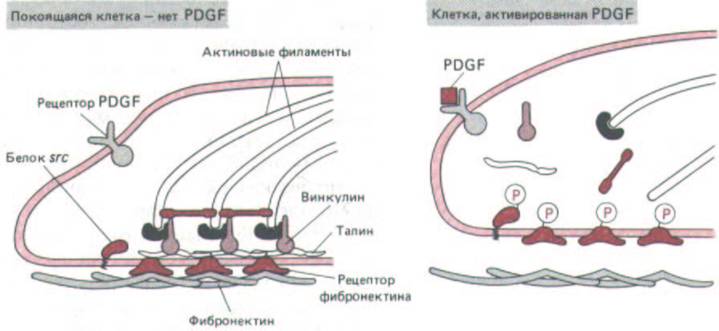
Рис. 13-37. Умозрительная модель, поясняющая, как могли бы происходить быстрые изменения клеточной адгезии при стимуляции клеток к делению фактором PDGF. Связывание PDGF с его рецептором приводит (пока не известным путем) к фосфорилированию белка c-src. В результате эта протеинкиназа, связанная с плазматической мембраной, активируется и в свою очередь фосфорилирует тирозиновые остатки соседних трансмембранных белков клеточной адгезии, в том числе рецептор фибронектина. Это приводит к тому, что фокальные контакты и другие участки клеточной адгезии частично разрушаются и связанные с ними актиновые филаменты теряют связь с мембраной. Частично эта модель основана на наблюдениях над клетками, трансформированными вирусом саркомы Рауса, которые содержат постоянно активный модифицированный белок src (v-src). Тирозин-протеинкиназы, кодируемые двумя другими протоонкогенами семейства src - c-abl и cyes,-
могли бы действовать таким же образом, как белок c-src в описанном выше механизме. Однако такими ферментами обычно фосфорилируется много белков, и не ясно, какие из них играют решающую роль в контроле клеточного деления. Некоторые важные мишени могут быть представлены в клетке одной или несколькими копиями (этого слишком мало для определения их обычными биохимическими методами), и у разных клеток мишени могут быть различными. Кроме того, трудно установить причинные взаимосвязи в сложной сети взаимодействующих компонентов, где многие факторы могут действовать параллельно и один и тот же эффект может достигаться разными способами.
бы прямо объяснить это сходство эффектов (рис. 13-37). С этой точки зрения трансформация клеток онкогеном v-src (и многими другими онкогенами с подобным же действием) - это как бы преувеличенный эффект нормального механизма стимуляции роста, который включает и ослабление клеточной адгезии. Опасность онкогенов для организма заключается в том, что в отличие от PDGF, стимулирующего клетку лишь кратковременно, белки, подобные v-src, стремятся необратимо вывести клетку из состояния G0 и таким образом удерживать ее в пролиферативном состоянии.
13.4.7. Связь между клеточной пролиферацией и клеточной адгезией пока еще непонятна [33]
Наше обсуждение контроля нормальной пролиферации клеток позвоночных приводит к парадоксу. С одной стороны, ясно: чтобы выйти из состояния G0 и начать делиться, нормальные клетки должны формировать адгезивные контакты с субстратом (адгезия между клетками и матриксом). Это наводит на мысль, что трансмембранные белки, связывающие клетки с внеклеточным матриксом (включая рецептор фибронектина и другие белки группы интегринов), создают некий
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
внутриклеточный сигнал, который облегчает деление клеток, находящихся в соответствующем состоянии. С другой же стороны, адгезия сама по себе еще не достаточна для запуска деления - необходимы еще факторы роста. Парадокс здесь в том, что факторы роста, по-видимому, частично действуют так, что временно ослабляют адгезию, от которой зависит пролиферация нормальных клеток (рис. 13-37). Такое действие заставляет вспомнить о втором наблюдении: во многих случаях недолгая обработка остановленных в росте нормальных клеток протеолитическим ферментом (например, трипсином), приводящая к потере прикрепленными клетками контакта с субстратом и к их округлению, дает еще побочный эффект -
запуск одного цикла деления. Видимо, пролиферация клеток кратковременно стимулируется как внеклеточными протеазами, непосредственно ослабляющими адгезию между клетками и матриксом в результате переваривания адгезионных внеклеточных белков, так и факторами роста, которые нарушают эту адгезию косвенно, воздействуя на фокальные контакты через внутриклеточные медиаторы.
Исследования на раковых клетках усиливают этот парадокс. Большинство таких клеток, в том числе и трансформированные хорошо изученными онкогенами, представленными на рис. 13-34, отличаются от их нормальных двойников тем, что для деления им не нужно прикрепляться к субстрату. Поскольку такая независимость от прикрепления дает возможность трансформированным клеткам расти в новых условиях, где нормальные контакты клеток между собой и с матриксом установить нельзя (разд. 13.3.6), можно предполагать, что она явилась результатом естественного отбора клеток, формирующих опухоли. Но почему многие раковые клетки не просто делятся независимо от прикрепления, но не прикрепляются прочно к внеклеточному матриксу даже тогда, когда такая возможность существует? Намек на ответ следует из наблюдений над трансформированными клетками, которые искусственно заставляют прикрепиться к культуральной чашке. Как отмечалось выше, фибробласты куриного эмбриона, трансформированные с помощью v-src, выделяют в больших количествах активатор плазминогена, который ослабляет их прикрепление к чашке. Если такие клетки растут в присутствии антитела, блокирующего активность этой протеазы, то они более прочно прикрепляются к чашке и в то же время становятся более подверженными нормальному социальному контролю клеточного деления: вместо образования многослойной структуры они проявляют тенденцию прекращать деление при взаимном контакте. Таким образом, прочное сцепление с внеклеточным матриксом, видимо, тормозит рост этих трансформированных клеток.
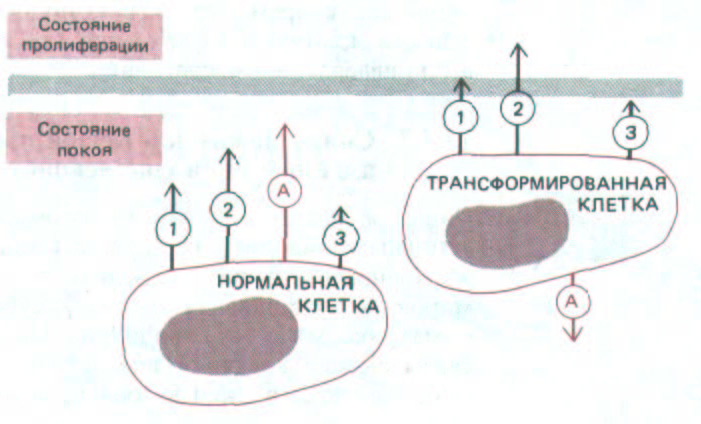
Рис. 13-38. Общая природа сигналов социального контроля, воздействующих на нормальные и трансформированные клетки. В обоих случаях различные факторы роста (обозначенные здесь цифрами 1, 2 и 3) действуют совместно, «поднимая» клетку из G0 в пролиферативное состояние. Поскольку трансформированная клетка поддерживается в положении, близком к границе перехода (цветная линия), она может часто стимулироваться к пролиферации только одним фактором роста (или очень низкой концентрацией смеси факторов роста). Однако, как отмечалось в тексте, есть существенная разница в эффекте прикрепления (обозначенном как А) между этими двумя типами клеток: для пролиферации нормальных клеток прикрепление необходимо, тогда как у трансформированных клеток оно скорее тормозит пролиферацию.
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
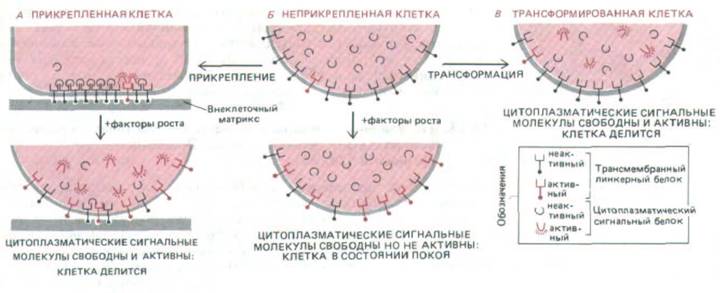
Рис. 13-39. Гипотетическая схема, объясняющая наблюдаемую зависимость пролиферации нормальных и трансформированных клеток от адгезии между клетками и матриксом. Главное внимание уделяется двум типам молекул: 1) цитоплазматическому белку, который служит внутриклеточным сигналом к делению, и 2) трансмембранному линкерному белку, который может связываться как с цитоплазматической сигнальной молекулой по одну сторону клеточной мембраны, так и с внеклеточным матриксом по другую сторону. Это связывание -
кооперативный процесс, так что сигнальные молекулы, связавшиеся с линкерным белком внутри клетки, стабилизируют трансмембранную структуру и способствуют ее связыванию с внеклеточным матриксом; и наоборот, связывание с внеклеточным матриксом способствует связыванию сигнальных молекул с линкерным белком внутри клетки. Чтобы клетка получила сигнал к делению, сигнальные молекулы должны быть несвязанными в цитоплазме и находиться в активной конформации, в которой они менее прочно связываются с линкерным белком.
Предполагается, что сигнальные молекулы активируются при их фосфорилировании, которое происходит благодаря киназной активности линкерного белка.
Когда прикрепленную клетку стимулируют факторы роста (А), включается киназная активность; сигнальные молекулы фосфорилируются и отсоединяются от линкерных белков, что служит для клетки сигналом к делению и ослаблению адгезии. Нормальные клетки в суспензии (Б) не делятся при воздействии факторов роста потому, что очень мало сигнальных молекул внутри клетки связывается с линкерными белками, которые могли бы их фосфорилировать. Трансформированные клетки (В) отличаются пониженной адгезивностью и могут делиться даже в суспензии, так как в их регуляторной системе имеется «шунт», благодаря которому сигнальные молекулы всегда находятся в фосфорилировашюм состоянии.
Различные условия, необходимые для роста нормальных и трансформированных клеток, и противоположное влияние на них адгезии к клеточному матриксу (рис. 13-38) могут иметь логическое объяснение. Сложная структура, формирующаяся в фокальном контакте между клеткой и субстратом, в каком-то отношении, вероятно, играет очень важную роль в возникновении внутриклеточных сигналов, регулирующих деление клеток. Наблюдаемые явления можно было бы объяснить, предположив, что для нормального запуска деления необходимы три шага: 1)
прикрепление клетки к матриксу при участии упорядоченного комплекса цитоскелетных белков, образующегося внутри клетки (разд. 11.2.8); 2)
активация этого комплекса, как правило, одним или несколькими факторами роста для создания сигнала к делению; и 3) частичное
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
разрушение контактов клетки с матриксом, как этап, необходимый для подачи такого сигнала. Для трансформированной клетки первый шаг становится ненужным, и разъединенные внутриклеточные компоненты контактов с матриксом будут необходимы и достаточны для возникновения сигнала к пролиферации. Гипотетическая модель такого механизма регуляции роста представлена на рис. 13-39.
организме [20, 34]
Эксперименты, проведенные в упрощенных искусственных условиях клеточной культуры, дают нам многое из того, что мы знаем о молекулярных механизмах, контролирующих рост и деление клеток у многоклеточных животных. Пока эта работа, однако, выявила только некоторые из основных «болтов и гаек» значительно более сложной системы социального контроля, которая должна действовать в интактном организме для регулирования пролиферации каждой группы клеток в соответствии с ее пространственным положением и предшествующим ходом развития.
Обсуждая проблему клеточного старения, мы высказали мысль, что клетками часто управляют долговременные внутриклеточные программы, поэтому текущее пролиферативное поведение клетки зависит от предыстории воздействия определенных факторов за много клеточных поколений до этого (разд. 13.3.10). Хотя взаимоотношения между долговременными и кратковременными механизмами контроля все еще остаются загадкой, по-видимому, в тех и других участвует много одинаковых молекул, в том числе факторов роста и продуктов протоонкогенов. В процессе эмбрионального развития программы деления клеток могут быть удивительно сложными и четкими. Это ярко продемонстрировано, например, на нематоде Caenorhabditis elegans, оплодотворенное яйцо которой делится так, что производит в точности 959 ядер соматических клеток взрослого животного; уже начато изучение некоторых генных продуктов, участвующих в реализации этой программы (разд. 16.3.3).
Однако не следует предполагать, что рост зародыша регулируется простым подсчетом клеточных делений. Это стало ясно, например, при сравнении тритонов разной плоидности. Клетки пентаплоидного тритона примерно в пять раз крупнее клеток гаплоидного, но благодаря тому, что их в каждой ткани в пять раз меньше, чем у гаплоида, размеры

Рис. 13-40. Вверху изображены типичные срезы почечных канальцев аксолотлей разной плоидности. У пентаплоидных аксолотлей клетки крупнее, чем у гаплоидных, однако сами животные и их органы имеют одинаковые размеры, так как каждая ткань пентаплоидного животного состоит из меньшего числа клеток. Это указывает на то, что размеры клеток регулируются каким-то механизмом, в основе которого лежит учет размеров и расстояний, а не числа делений или числа клеток. [G. Frankhauser, In: Analysis of Development (В. H. Willier, P. A. Weiss, V.
Hamburger, eds.), pp. 126-150. Philadelphia, Saunders, 1955.]
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
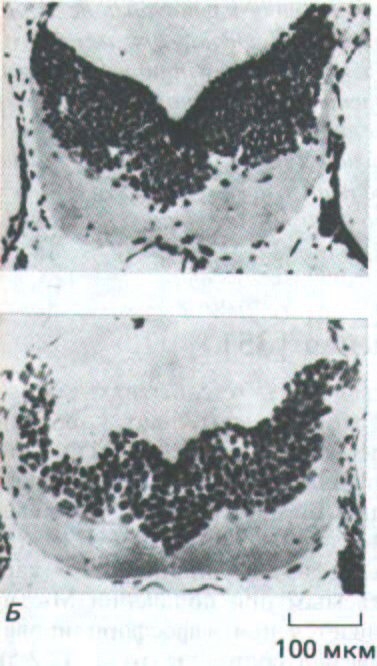
Рис. 13-41. Микрофотографии срезов мозга гаплоидного и тетраплоидного аксолотлей (см. также рис. 13-40). А. Поперечный срез заднего мозга гаплоидного аксолотля. Б. Соответствующий срез мозга тетраплоидного аксолотля; видно, что уменьшенное число клеток компенсируется увеличением их размеров. (G. Frankhauser, Int. Rev. Cytol. 1: 165-193, 1952.)
тела и органов у обоих животных практически одинаковы (рис. 13-40 и 13-41). Очевидно, у позвоночных механизмы контроля клеточного деления, регулирующие размеры тела, основаны на измерении длин, а не на простом подсчете числа клеток или циклов деления. Такие механизмы нуждаются в сложном позиционном контроле, в котором важную роль могли бы играть диффундирующие факторы роста.
Позиционный контроль клеточного деления может работать с удивительной специфичностью. Когда часть эпителия ножки одного таракана пересаживают на гомологичный участок другому, она «вживляется» без заметного деления клеток. Однако если ее трансплантировать в негомологичное место, то и клетки трансплантата, и соседние клетки хозяина начинают делиться, а затем дифференцируются с образованием таких клеток, которые в норме лежали бы между участком, откуда был взят трансплантат, и участком, куда он был пересажен (разд. 16.4.9).
Молекулярная основа такого поведения совершенно не известна.
Вообще деление клеток в процессе эмбрионального развития регулируется при совместном участии как автономных клеточных программ, так и межклеточных взаимодействий, но важность каждого из этих факторов меняется от вида к виду и от одной части тела к другой. В зрелых тканях клеточное деление тоже регулируется сложной сетью различных механизмов: при заживлении глубокой кожной раны у позвоночных, чтобы возместить потерю ткани, должны регенерировать в надлежащих количествах около 12 типов клеток, начиная с фибробластов и кончая шванновскими клетками. Кроме того, в системе социального контроля существует избыточность с многочисленными ограничителями, действующими параллельно так, чтобы утрата одного контролирующего компонента в одной клетке (обычно это результат соматической мутации)
не повредила целому организму вследствие появления огромного клона интенсивно делящихся клеток. Исследования в области рака показывают, что в данной клеточной линии должно произойти от четырех до шести мутаций, прежде чем она даст начало злокачественной опухоли (разд.
21.1.4).
Изучение молекулярных деталей тщательно отлаженных механизмов социального контроля, позволяющих развиться и существовать во взрослом организме такому органу, как почка, видимо, потребует работы нескольких поколений клеточных биологов. Теперь, однако, стали доступными такие мощные средства, как антитела, блокирующие специфические факторы роста или рецепторы, и получение трансгенных животных, у которых вырабатываются сигнальные молекулы, несвойственные определенным типам клеток (разд. 5.6.10). Благодаря таким новым подходам задача, хотя и труднейшая, уже не кажется неразрешимой.
Заключение
Аномальные клетки, не повинующиеся социальным сдерживающим факторам, пролиферируют с образованием опухолей в организме;
они также появляются при трансформации в культуре клеток. Хотя это часто приводит к гибели всего организма, как индивидуальные клетки
они получают селективное преимущество, и поэтому их легко выделять. Трансформация клетки часто сопровождается мутацией или
сверхэкспрессией специфических онкогенов, во многих случаях выявленных благодаря их наличию в РНК опухолевых вирусов (ретровирусов).
Нормальные гомологи таких вирусных онкогенов в здоровых клетках, называемые протоонкогенами, по-видимому, кодируют ключевые ком-
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
поненты нормальной системы социального контроля клеточного деления. Некоторые протоонкогены кодируют факторы роста, другие -
рецепторы для этих факторов или внутриклеточные регуляторные белки, участвующие и клеточной адгезии, а третьи — белки, помогающие
передавать сигналы клеточного деления в ядро клетки. Чтобы клетка превратилась в раковую, в ней должны подвергнуться изменению многие
гены социального контроля, что указывает на избыточность сложных регуляторных систем, влияющих на клеточную пролиферацию в тканях.
|
|
|
|
|
Дата добавления: 2015-08-31; Просмотров: 545; Нарушение авторских прав?; Мы поможем в написании вашей работы!