
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Примеры решения задач. 1. Вычислить z-потенциал с учетом поверхностной проводимости на границе раздела кварцевая диафрагма — раствор хлорида калия и построить график зависимости z
|
|
|
|
Задачи
1. Вычислить z-потенциал с учетом поверхностной проводимости на границе раздела кварцевая диафрагма — раствор хлорида калия и построить график зависимости z от концентрации электролита по следующим данным:

| 
| 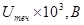
| 
|
| 0,05 | 1,0 | 10,1 | 3,25 |
| 0,1 | 2,06 | 8,5 | 1,5 |
| 0,5 | 2,24 | 7,0 | 1,3 |
| 1,0 | 6,0 | 3,1 | 1,05 |
2. Рассчитать z-потенциал и построить график зависимости от диаметра пор кварцевой диафрагмы в растворе хлорида калия без учета поверхностной проводимости и с учетом ее по следующим данным:
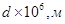
| 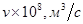
| 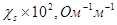
|
| 1,2 | 3,22 | |
| 1,5 | 2,25 | |
| 2,0 | 1,32 | |
| 2,8 | 0,52 | |
| 3,5 | 0,12 | |
| 3,6 | 0,075 |
 ;
; 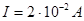 ;
;  ;
; 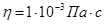
3. Построить графики зависимости z-потенциала от диаметра пор кварцевой диафрагмы без учета поправки на поверхностную проводимость и с учетом ее по следующим данным:
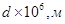
| 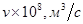
| 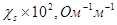
|
| 3,0 | 1,2 | 3,1 |
| 35,0 | 2,4 | 2,08 |
| 70,0 | 3,4 | 1,08 |
| 3,7 | 1,01 |
 ;
;  ;
; 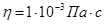 ;
; 
4. Рассчитать z-потенциал корундовой диафрагмы в растворе хлорида натрия и построить график зависимости z от диаметра пор диафрагмы по следующим данным:
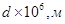
| 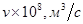
| 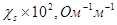
|
| 2,8 | 1,48 | |
| 3,2 | 1,3 | |
| 3,6 | 1,15 | |
| 3,9 | 1,05 | |
| 4,0 | 1,02 |
 ;
; 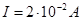 ;
; 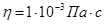 ;
; 
.5. Рассчитать z-потенциал керамической диафрагмы в растворе хлорида натрия и построить график зависимости z от диаметра пор диафрагмы по следующим данным:
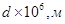
| 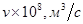
| 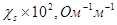
|
| 2,93 | ||
| 2,50 | ||
| 1,71 | ||
| 1,34 | ||
| 1,23 | ||
| 1,08 | ||
| 1,06 |
 ;
; 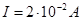 ;
; 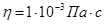 ;
; 
6. Рассчитать z-потенциал и построить график зависимости z от диаметра пор корундовой диафрагмы в растворе хлорида калия без учета и с учетом поверхностной проводимости но следующим данным:
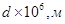
| 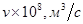
| 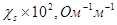
|
| 3,0 | 2,0 | 1,6 |
| 10,0 | 3,2 | 0,48 |
| 25,0 | 3,9 | 0,08 |
| 75,0 | 4,0 | 0,03 |
 ;
; 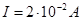 ;
; 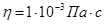 ;
; 
7. Рассчитать z-потенциал с учетом и без учета поверхностной проводимости и построить график зависимости z от диаметра пор керамической диафрагмы в растворе хлорида натрия по следующим данным:
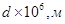
| 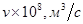
| 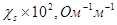
|
| 1,3 | 2,9 | |
| 1,5 | 2,4 | |
| 2,0 | 1,9 | |
| 2,5 | 1,5 | |
| 3,0 | 1,25 | |
| 3,5 | 1,08 |
 ;
; 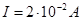 ;
; 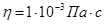 ;
; 
8. Построить график зависимости потенциала течения от давления для кварцевой диафрагмы в растворе хлорида калия по следующим данным: р (Па) равно а) 5´10-3, б) 10´103, в) 15´-108, г) 20´103, д) 25´103; z=8´10-2В; e=81;h=1´10-3Пас; cn=2,1´10-2 Ом-1м-1; a=1,2.
9. Рассчитать скорость электрофореза частиц оксида алюминия в воде с учетом электрофоретического торможения по следующим данным: z=20´10-3В; E =5´102В/м; e=81;h=1´10-3Пас; a=5´10-7 м; c=1´107м-1.
10. Рассчитать скорость электрофореза частиц оксида алюминия в метаноле с учетом электрофоретического торможения по следующим данным: z=30´10-3В; E =8´102В/м; e=33; h=0,8´10-3Пас; a=1.5´10-8 м; c=2´108м-1.
то скорость электрофореза частиц корунда, образующих диафрагму, в том же растворе без учета электрофоретического торможения равна 24´10-6 м/с; h=1´10-3 Па×с; Е=4´102В/м; e=81, a=5´10-8м; c= 2´108м-1; р=4´103 Па; cn=1,5´10-2 Ом-1м-1; a=1,5.
12. Рассчитать потенциал течения через диафрагму из частиц карбоната кальция в водном растворе хлорида натрия, если известно, что скорость электрофореза частиц карбоната в том же растворе без учета электрофоретического торможения равна 10´10-6м/с; e=81;h=1´10-3Па×с; Е=2´102В/м; а=3´10-7м; c=1,5´107м-1; р=5´103 Па; cu=2,5´10-2 Ом-1м-1; a=1,2.
13. Рассчитать электрофоретическую подвижность частиц карбоната стронция в воде, если z, рассчитанный по скорости электрофореза без учета электрофоретического торможения, равен 50´10-3В; h=l´10-3 Па×с; Е =4´102 В/м; e=81; c=1,5´108 м-1; а=2´10-8 м.
14. Рассчитать скорость электроосмоса раствора хлорида калия через корундовую диафрагму, если известно, что z-потенциал, рассчитанный по скорости электрофореза частиц корунда в том же растворе без учета электрофоретического торможения, равен 35´10-3В; h=10-3Па×с; e=81; Е=2´102В/м; I=2´10-2А; cu=2´10-2Ом-1м-1; a=1,1; cа=3.
15. Вычислить z, если известно, что потенциал течения, определенный при продавливании раствора хлорида калия через корундовую диафрагму под давлением 20´103Па, равен 22,5´10-3В. Удельная проводимость раствора cu=1,37´10-2Ом-1м-1, коэффициент эффективности диафрагмы a=1,8; вязкость раствора h=1´10-3 Па×с; e=81
16. Вычислить электрофоретическую подвижность частиц оксида железа по следующим данным; скорость электроосмоса через диафрагму из таких же частиц в том же растворе u=2´10-8 м3/с; cu=1,2´10-2 Ом-1м-1; cs=2´10-2Ом-1м-1; I=1,6´10-2А; e=81; h=10-3Па×с.
17. Рассчитать массу осадка, полученного на цилиндрическом электроде при электрофорезе водной суспензии оксида железа. Длина электрода l=2´10-2м; радиус внутреннего электрода r2=1´10-3м; радиус наружного r1=28´10-3м; z=20´10-3В; напряжение на электродах U=20В; c0=0,5´103кг/м3; h=1´10-3Па×с; ст=1´103кг/м3;e=81; t=15с.
18. Рассчитать массу осадка, полученного на цилиндрическом электроде при электрофорезе водной суспензии СаСО3. Длина электрода l=2´10-2м; радиус внутреннего электрода г1=1´10-3м; радиус наружного r1=28´10-3м; z=25´10-3B; U=30B; с0=0,3´103 кг/м3; cm=l´103Kr/M3; h=1´10-3Па×с; e=81; t=20с.
19. Рассчитать массу электрофоретического осадка, полученного из водной суспензии глины на цилиндрическом электроде длиной l=1´10-2м и радиусом r2=0,5´10-3м в ванне с наружным цилиндрическим электродом г1=14´10-3м; z=30´10-3В; U=5B; с0=0,5´103 кг/м3; сm=1,0´103 кг/м3; h=1´10-3Па×с; e=81; t=10с.
20. Рассчитать массу осадка, образовавшегося на электроде при электрофорезе водной суспензии корунда при напряженности электрического поля 1´102; 2´102; 4´102 В/м; концентрация суспензии с =2,0´103 кг/м3; продолжительность осаждения t=10с; z-потенциал, определенный по скорости электроосмоса без учета поверхностной проводимости, равен 49,6´10-3В; коэффициент эффективности диафрагмы равен 1,8; e=81; поверхность плоского электрода S=1´10-4м2; h=1´10-3 Па×с.
21. Рассчитать электрофоретическую подвижность частиц корунда в воде, если известно, что скорость электроосмоса через корундовую диафрагму в том же растворе составляет 2´10-8м3/с, удельная электрическая проводимость раствора cu=1,2´10-2Ом-1м-1, поверхностная проводимость диафрагмы cs=2´10-2 Ом-1м-1; вязкость раствора h=1´10-3 Па×с; сила тока при электроосмосе I=4,5´10-2А; e=81.
22. Рассчитать потенциал седиментации частиц оксида алюминия в водном растворе хлорида калия по следующим данным:
j=0,1; e=81; z=50´10-3; r—r0=3´103 кг/м3; h=1´10-3Па×с; cu=1´10-2 Ом-1м-1.
23. Рассчитать потенциал течения и построить график его зависимости от концентрации электролита с по следующим данным:

| 0,1 | 0,5 | 1,0 | |
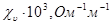
| 2,13 | 20,6 | 79,4 | 154,0 |
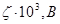
| 90,0 | 78,0 | 66,0 | 44,0 |
h=1´10-3Па×с; р=5×103Па; e=81; a=1,0.
24. Под каким давлением должен продавливаться раствор хлорида калия через керамическую диафрагму, чтобы потенциал течения Uтеч составил 4´10-3В; z=30´10-3В; cu=1,3´10-2Ом-1м-1; a=1,5; e=81; h=1´10-3Па×с.
25. Вычислить z-потенциал по следующим данным: потенциал течения Uтеч=45´10-3В;p=4´104 Па; a=1,8; cu=l,5´10-2Ом-1м-1; e=81; h=1´10-3 Па×с.

Глава 7. Строение мицеллы гидрофобного золя. Коагуляция гидрофобного золя
Синтез гидрофобных дисперсных систем (суспензий, золей, в том числе аэрозолей, эмульсий) осуществляют методами диспергирования и конденсации. Диспергирование твердых и жидких веществ в выбранных средах проводят в шаровых и коллоидных мельницах вибропомола, ультразвуковых установках и др. Эффект усиливается при введение в среду ПАВ (эффект Ребиндера). Конденсационные методы основаны на физической или химической конденсации атомов или молекул с последующим образованием новой фазы в виде дисперсных частиц, распределенных в объёме среды (газообразной, жидкой или твердой).
Методом физической конденсации получают золи, дымы, дисперсные металлы. При химической конденсации частицы новой фазы образуются в результате протекания в системе химической реакции с образованием малорастворимых соединений.
Гидрофобные дисперсные системы термодинамически неустойчивы, так как частицы дисперсной фазы склонны к агрегации. Их термодинамическая агрегативная неустойчивость обусловлена избытком поверхностной энергии. Межфазное поверхностное натяжение в гидрофобных системах больше рассчитанного по соотношению Ребиндера-Щукина. Поэтому они не могут быть получены самопроизвольным диспергированием как лиофильныесистемы; для их образования должна быть затрачена внешняя энергия.
Укрупнение частиц дисперсной фазы при потере агрегативной устойчивости достигается в результате изотермической перегонки (растворение мелких и рост крупных частиц в соответствии с уравнением Кельвина) или за счет слипания (слияния) частиц – коагуляции. Наиболее распространен процесс коагуляции. В зависимости от природы системы и концентрации дисперсной фазы этот процесс может заканчиваться или осаждением частиц, или структурообразованием.
Гидрофобные дисперсные системы характеризуются кинетической агрегативной устойчивостью, определяемой скоростью процесса коагуляции. Кинетика коагуляции определяется уравнением Смолуховского:
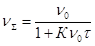 или
или 
где  - суммарное число частиц дисперсной фазы ко времени τ;
- суммарное число частиц дисперсной фазы ко времени τ; 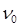 - первоначальное число частиц;
- первоначальное число частиц; 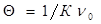 - время половинной коагуляции; К – константа скорости коагуляции.
- время половинной коагуляции; К – константа скорости коагуляции.
Константа К определяется соотношением
 или
или 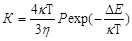
где Кб – константа скорости быстрой коагуляции; Р – стерический множитель, учитывающий благоприятные пространственные расположения частиц при столкновении; ΔЕ – энергия взаимодействия частиц, или потенциальный барьер; κ - константа Больцмана; η – вязкость дисперсионной среды.
Константа скорости коагуляции К (константа скорости медленной коагуляции) является мерой кинетической агрегативной устойчивости. Если ΔЕ=0 и Р= 1, то эта константа равна константе скорости быстрой коагуляции, зависящей от вязкости среды и температуры системы. Если ΔЕ≠0 и Р≠1, то не все соударения частиц эффективны, и происходит медленная коагуляция. Замедление коагуляции, обусловленное потенциальным барьером, характеризуется фактором устойчивости, или коэффициентом стабильности:
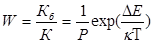
При значительном потенциальном барьере может наступить такое состояние системы, когда скорость агрегации частиц равна скорости дезагрегации и система окажется термодинамически устойчивой к коагуляции.
Таким образом, агрегативная устойчивость коллоидных систем обуславливается термодинамическими и кинетическими факторами. Термодинамические факторы, действие которых направлено на снижение поверхностного натяжения и увеличение энтропии, уменьшают вероятность эффективных соударений между частицами, создают потенциальные барьеры. Кинетические факторы снижают скорость столкновения частиц и связаны в основном с гидродинамическими свойствами системы.
Различают следующие факторы устойчивости (стабилизации) дисперсных систем.
1. Электростатический фактор (термодинамический); заключается в уменьшении поверхностного натяжения вследствие возникновения двойного электрического слоя на поверхности частиц в соответствии с уравнением Липпмана. 2. Адсорбционно-сольватный фактор (термодинамический); состоит в уменьшении поверхностного натяжения в результате взаимодействия частиц с дисперсной средой (уравнение Дюпре) или благодаря адсорбции стабилизаторов (адсорбционное уравнение Гиббса). 3. Энтропийный фактор (термодинамический); проявляется в стремлении дисперсной фазы к равномерному распределению по объёму систему под действием теплового движения. 4. Структурно-механический фактор (кинетический); связан с тем, что на разрушение пленок, образующихся на поверхности частиц и обладающих упругостью и механической прочностью, требуется энергия и время. 5. Гидродинамический фактор (кинетический); заключается в снижении скорости движения частиц при изменении вязкости и плотности дисперсионной среды. 6. Смешанные факторы наиболее характерны для реальных систем; агрегативная устойчивость обеспечивается действием нескольких факторов одновременно.
Каждому фактору устойчивости соответствует специфический метод его нейтрализации. Например, электростатический фактор очень чувствителен к введению электролитов. Действие структурно-механического фактора можно предотвратить с помощью веществ, разжигающих упругие структурированные слои на поверхности частиц, а также механическим, термическим способами и др.
Устойчивость дисперсных систем определяется балансом энергии притяжения и энергии отталкивания между частицами. По теории ДЛФО (Дерягина, Ландау, Фервея, Овербека), учитывающей только электростатическую составляющую расклинивающего давления (давления отталкивания), энергия отталкивания убывает с расстоянием по экспоненциальному закону.
Для области малых электрических потенциалов суммарная энергия взаимодействия частиц (пластин) равна
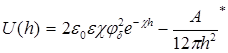
где φδ – электрический потенциал диффузного слоя; χ – величина, обратная толщине диффузного слоя; А* - константа Гамакера; h – расстояние между частицами (пластинами); ε – диэлектрическая проницаемость дисперсной среды; ε0 – электрическая постоянная.
При больших потенциалах и расстояниях между частицами (пластинами) эта энергия определяется уравнением
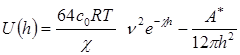
Суммарная потенциальная энергия взаимодействия частиц отрицательна на близких и далеких расстояниях (преобладает энергия притяжения). Она может быть положительна на средних расстояниях (преобладает энергия отталкивания). Максимум потенциальной кривой (рис 1.) отвечает потенциальному барьеру ΔЕ. Первый минимум I соответствует непосредственному соприкосновению частиц, а второй II – притяжению частиц, между которыми имеются прослойки среды.
Коагуляция гидрофобныхдисперсных систем может происходить в результате различных внешних воздействий, например при механическом воздействий (ультразвука), действии электрического поля, при нагревании или замораживании системы. Коагуляция гидрофобных золей может быть вызвана также их сильным разбавлением или концентрированием. Наиболее часто коагуляция дисперсных систем происходит при добавлении электролитов. Различают два типа электролитной коагуляции коллоидных систем: 1) нейтрализационную, происходящую в результате снижения поверхностного потенциала частиц; 2) концентрационную, протекающую вследствие сжатия диффузной части двойного электрического слоя (потенциал поверхности в этом случае не изменяется).
Нейтрализационная электролитическая коагуляция характерна для коллоидных систем, содержащих слабо заряженные частицы. Концентрационная коагуляция обычно наблюдается в сильно заряженных дисперсных системах.

Рис.1. Зависимость энергии взаимодействия U двух частиц от расстояния между ними h.
.
Введение электролитов снижает высоту потенциального барьера, но при небольших концентрациях электролита энергетический барьер остается достаточно велик и коагуляция не происходит. Агрегация наступает при введении определенного для данной системы количества электролита, соответствующего порогу коагуляции. Порок быстрой коагуляции ск определяет количество электролита, необходимое для коагуляции единицы объёма коллоидной системы при полном исчезновении потенциального барьера ΔЕ. При сохранении небольшого потенциального барьера в системе протекает медленная коагуляция.
При электролитной коагуляции по концентрационному механизму (для сильно заряженных частиц) порок коагуляции ск в соответствии с правилом Дерягина-Ландау (обоснование эмпирического правила Шульца-Гарди) обратно пропорционален заряду z противоионов в шестой степени, т. е.
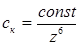
При нейтрализационной коагуляции (при малых потенциалах поверхности φ0 частиц) показатель степени z в уравнении уменьшается до двух (правило Эйлерса-Корфа).
Строение коллоидной мицеллы схематически может быть изображено на примере мицеллы иодида серебра:
{[(AgI)n mI-] xK+} (m-x)K+
| Агрегат или кристаллик твердого вещества | Потенциалопределяющие ионы | Ионы адсорбционного слоя | Ионы диффузного слоя |
ядро
частица

мицелла
1. Определите, к какому электроду должны перемещаться частицы золя, получаемого при реакции при небольшом избытке H2S:
2H3AsO3+3H2S=As2S3+6H2O
Решение. Потенциал определяющими ионами в данном случая могут быть ионы SH-, так как в состав агрегата входят ионы серы. Состав адсорбционного слоя могут входить ионы Н+. Ионы Н+ образуют диффузный слой. Таким образом, схематическое строение мицеллы золя можно выразить следующей формулой:
{[(As2S3)m·n SH-]· Н+}(n-x) Н+
Частица имеет отрицательный заряд, - следовательно, электрофоретическое движение направлено к аноду.
2. Время половинной коагуляции золя иодида серебра при исходном содержании частиц в 1 м3, равном 3,2·1014, составляет 11,5 с. Определите константу скорости коагуляции.
Решение. Расчет проводим, используя формулу, связывающую константу скорости коагуляции с временем половинной коагуляции:
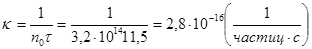
3. Золь иодида серебра, получаемый по реакции:
KI+AgNO3→AgI+KNO3
при некотором избытке KI, коагулируют растворами сульфата калия и ацетата кальция. Коагулирующее действие какого электролита сильнее?
Решение. Строение мицеллы золя таково:
{[(AgI)m·nI-]xK+}(n-x)K+
Ионами, образующими диффузный слой, т.е. противоионами, являются катионы K+. Следовательно, при сравнении коагулирующего действия необходимо сравнивать заряды катионов вводимого электролита. Так как заряд иона Са2+ выше заряда иона K+, то в соответствии с правилом Шульце-Гарди коагулирующее действие Са(СН3СОО)2 сильнее.
|
|
|
|
|
Дата добавления: 2015-08-31; Просмотров: 3855; Нарушение авторских прав?; Мы поможем в написании вашей работы!