
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основные процессы изменения состояния идеальных газов
|
|
|
|
К основным термодинамическим процессам относят следующие четыре процесса:
изохорный – при постоянном объеме (V = const);
изобарный – при постоянном давлении (P = const);
изотермический – при постоянной температуре (T = const);
адиабатный – без теплообмена с внешней средой (dq = 0).
В реальных условиях указанные ограничения практически не выполняются. В связи с этим в технической термодинамике существует понятие политропного процесса как общего случая термодинамического процесса. Предполагается, что политропный процесс обратим и теплоемкость рабочего тела (идеального газа) Cn в ходе данного процесса не изменяется.
Уравнение политропного процесса имеет вид:
РVn= const, (1.60)
где  постоянная величина, называемая показателем политропы.
постоянная величина, называемая показателем политропы.
Политропных процессов существует бесчисленное множество, т. к.

Изохорный процесс
В диаграмме Рυ этот процесс изображается прямой 1-2, параллельной оси ординат. Уравнение прямой 1-2 (рис. 1.2), называется изохорной, V = const.
Зависимость между параметрами процесса:
 (1.61)
(1.61)
Изменение внутренней энергии:
 . (1.62)
. (1.62)
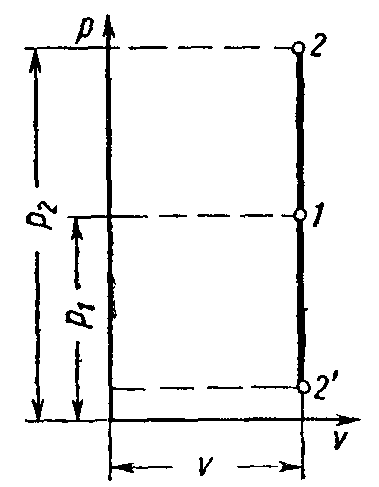
Рис. 1.2 Изображение изохорного процесса в координатных осях Pυ
Если в процессе участвует M, кг или Vн, м3 газа, то количество тепла или изменение внутренней энергии газа подсчитывается по формуле:
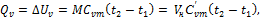 (1.63)
(1.63)
где Vн – количество газа в м3 при нормальных условиях.
Если количество тепла необходимо подсчитать, пользуясь нелинейной зависимостью теплоемкости от температуры, то следует пользоваться формулой (1.40).
В изохорном процессе газ работы не совершает (L = 0).
Изобарный процесс
В диаграмме Pυ этот процесс изображается прямой 1-2, параллельной оси абцисс. Уравнение прямой 1-2 (рис. 1.3), называемой изобарой,
P = const.

Рис. 1.3 Изображение изобарного процесса в координатных осях Pυ
Зависимость между начальными и конечными параметрами процесса:
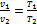 . (1.64)
. (1.64)
Работа 1 кг газа:
 (1.65)
(1.65)
или:
 (1.66)
(1.66)
Для M кг газа:
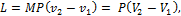 (1.67)
(1.67)
или:
 (1.68)
(1.68)
Если в процессе P=const участвует M, кг или Vн, м3 газа, то количество тепла подсчитывается по формуле:
 (1.69)
(1.69)
где Vн – количество газа в м3 при нормальных условиях.
Если количество тепла необходимо подсчитать, пользуясь нелинейной зависимостью теплоемкости от температуры, то следует пользоваться формулой (1.41). Изменение внутренней энергии газа определяется по формуле (1.46):
 ,
,
или с учетом формулы (1.35):

Изотермический процесс
Кривая изотермического процесса, называемая изотермой, в диаграмме PV изображается равнобокой гиперболой (рис. 1.4).
Уравнение изотермы в координатах Pυ:Pυ = const.
Зависимость между начальными и конечными параметрами по формулам:
 (1.70)
(1.70)
 (1.71)
(1.71)

Рис. 1.4. Изображение изотермического процесса в координатных осях Pυ
Работа 1 кг идеального газа определяется из уравнений:
 (1.72)
(1.72)
 (1.73)
(1.73)
 (1.74)
(1.74)
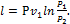 (1.75)
(1.75)
Если в процессе участвуют М, кг газа, то полученные из формул (1.72)-(1.75) значения нужно увеличить в М раз. Можно так же для этого случая в формулах (1.74) и (1.75) заменить удельный объем υ полным объемом V. Получим:
 , (1.76)
, (1.76)
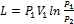 . (1.77)
. (1.77)
Так как в изотермическом процессе t = const, то для идеального газа:
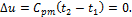
Количество тепла, сообщаемое газу или отнимаемого от него, равно:
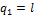 , (1.78)
, (1.78)
или для М, кг газа:
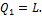 (1.79)
(1.79)
Натуральный логарифм, входящий в формулы, может быть заменен десятичным по соотношению:

Адиабатный процесс
Уравнение адиабаты в системе координат Рυ (рис. 1.5) при постоянной теплоемкости (Cv = const) для идеального газа:
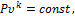
где 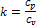 - показатель адиабаты.
- показатель адиабаты.
Зависимости между начальными параметрами процесса:
между Р и υ:
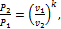 (1.80)
(1.80)
между T и υ:
 (1.81)
(1.81)
между Р и T:
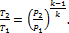 (1.82)
(1.82)

Рис. 1.5 Изображение адиабатного процесса в координатных осях Pυ
Работа 1 кг газа определяется по следующим формулам:
 (1.83)
(1.83)
 (1.84)
(1.84)
 (1.85)
(1.85)
 (1.86)
(1.86)
Для определения работы М, кг газа нужно в формулах (1.83), (1.84) и (1.86) заменить удельный объем υ общим объемом V газа. Тогда получим:
 (1.87)
(1.87)
 (1.88)
(1.88)
 (1.89)
(1.89)
Формула (1.85) для М, кг газа примет следующий вид:
 (1.90)
(1.90)
Уравнение первого закона для адиабатного процесса имеет следующий вид:

следовательно,
 ,
,
или:
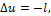 (1.91)
(1.91)
т. е. изменение внутренней энергии газа и работа адиабатного процесса равны по величине и противоположны по знаку.
Изменение внутренней энергии идеального газа в адиабатном процессе может быть также выражено уравнением:
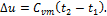 (1.92)
(1.92)
Политропный процесс
Уравнение политропы в системе координат Рυ (рис. 1.6) при постоянной теплоемкости

где n – показатель политропы.
Показатель политропы n принимает для каждого процесса определенное числовое значение. Для основных процессов: изохорных n=±∞, изобарных n = 0, изотермных n = 1 и адиабатных n = k.
Теплоемкость политропного процесса определяем из формулы:
 . (1.93)
. (1.93)
Уравнение (1.93) позволяет определить теплоемкость политропного процесса для каждого значения n.
Если в уравнение (1.93) подставить значения n для частных случаев, то получаем теплоемкости рассмотренных процессов:
изохорного процесса n=±∞, Cn=Cυ;
изобарного процесса n=0, Cn=kCυ=CP;
изотермного процесса n=1, Cn=±∞;
адиабатного процесса n=k, Cn=0.

Рис. 1.6. Изображение политропного процесса в координатных осях Pυ
Характеристикой политропного процесса является величина:
 (1.94)
(1.94)
которая может быть определена из выражения:
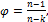 (1.95)
(1.95)
где n – показатель политропы, а 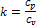 .
.
Зависимости между начальными и конечными параметрами процесса: между P и υ:
 (1.96)
(1.96)
между T и υ:
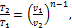 (1.97)
(1.97)
между P и T:
 (1.98)
(1.98)
Работа 1, кг газа в политропном процессе определяется по следующим формулам:
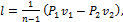 (1.99)
(1.99)
 (1.100)
(1.100)
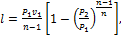 (1.101)
(1.101)
 (1.102)
(1.102)
Если количество тепла, участвующего в процессе, известно, то работа может быть также вычислена по формуле:
 (1.103)
(1.103)
Для определения работы М, кг газа нужно в формулах (1.99)-(1.101) заменить удельный объем υ полным объемом газа V. Тогда:
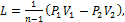 (1.104)
(1.104)
 (1.105)
(1.105)
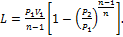 (1.106)
(1.106)
Формулы (1.102) и (1.103) для М, кг имеют следующий вид:
 (1.107)
(1.107)
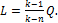 (1.108)
(1.108)
Теплоемкость политропного процесса может быть определена из уравнения (1.94):
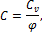
или, заменяя  его значением из уравнения (1.95),
его значением из уравнения (1.95),
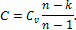
Количество тепла, сообщаемого газу или отнимаемого от него:
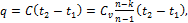 (1.109)
(1.109)
 (1.110)
(1.110)
Величина Q может быть так же определена из формулы (1.108), если известна работа политропного процесса:
 (1.111)
(1.111)
Изменение внутренней энергии газа в политропном процессе находим либо по общей для всех процессов формуле:
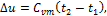
либо по формулам:
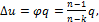

Изменение энтропии газа в политропном процессе определяется по формуле:
 . (1.112)
. (1.112)
Если известны значения двух параметров в начальном и конечном состоянии, то, пользуясь уравнениями (1.96)-(1.98), можно определить значение n из формул:
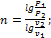 (1.113)
(1.113)
 (1.114)
(1.114)
 (1.115)
(1.115)
Показатель политропы может быть также определен из уравнения (1.95). Решая его относительно n, получаем:
 (1.116)
(1.116)
|
|
|
|
|
Дата добавления: 2017-01-14; Просмотров: 2163; Нарушение авторских прав?; Мы поможем в написании вашей работы!